小分子干渉RNA(siRNA)製剤は、RNA干渉(RNAi)経路を使用して特定の遺伝子をサイレンシングする薬剤クラスです。このプロセスは1998年にCaenorhabditis elegansで初めて報告され、メッセンジャーRNA(mRNA)を標的としてさまざまな疾患に関与するタンパク質の生成を抑制するsiRNA分子の開発につながりました。
2006年、siRNAを介した遺伝子サイレンシングを発見した科学者たちは、ノーベル生理学・医学賞を受賞しました。最初に承認されたsiRNA製剤であるパチシランは、2018年に遺伝性トランスサイレチン型アミロイドーシスの治療薬として規制当局の承認を受けました。その後、急性肝性ポルフィリン症に対するギボシラン、原発性高シュウ酸尿症1型に対するルマシラン、高コレステロール血症管理に対するインクリシランなど、追加のsiRNA薬が承認されました。さらに最近では、ブトリシランおよびネドシランが承認され、siRNA製剤の応用領域は代謝疾患、心血管疾患、遺伝性疾患へと拡大しています。
これらの進歩により、siRNAはさまざまな臨床分野における正確な治療アプローチとして確立されました。がんからアルツハイマー病、HIVに至るまで、さまざまな疾患がsiRNA製剤の対象となる可能性があり、Pharmaprojectによれば、260を超えるsiRNA薬候補が前臨床または臨床開発段階にあります。
これは有望ですが、これまで、これらの治療薬を使用した一貫した信頼性の高い医薬品開発には大きな課題がありました。化学修飾や特殊なデリバリーシステムを伴わずに投与される未修飾siRNAは、生体内の体液に広く存在するリボヌクレアーゼによって急速に分解されやすく、有効半減期が著しく短縮し、標的細胞への到達能力も低下します。さらに、その固有の負電荷と親水性により細胞内への効率的な取り込みが阻害され、細胞膜を透過して十分な細胞内濃度に達することが妨げられます。さらに、化学修飾を施さない場合、自然免疫応答を誘発するリスクも高まり、標的外の炎症経路を活性化させる可能性があり、全体的な安全性が損なわれる可能性があります。
研究者たちは、これらの根強いハードルを克服する可能性のある新たなブレークスルーを見つけています。化学的な修飾と高度な薬物送達システムは進歩を見せており、その結果、siRNA製剤は多くの疾患にわたる精密医療の強化に近づいています。
siRNA製剤の仕組み
siRNAは保存され制御されたRNAi経路を介して遺伝子サイレンシングを媒介し、特定の遺伝子転写物の転写後ダウンレギュレーションを促進します(図1を参照)。

外因的に投与されるsiRNA二本鎖は、通常21〜23ヌクレオチドの長さを持ち、3′末端に2ヌクレオチドのオーバーハングを有しています。これらは細胞質内に導入され、多タンパク質複合体であるRNA誘導サイレンシング複合体(RISC)によって認識されます。RISC活性化の中心的役割を担うのはエンドヌクレアーゼであるArgonaute 2(AGO2)であり、これはATP非依存的な二本鎖の解離後にガイド鎖を選択的に保持し、同時にパッセンジャー鎖を排出します。
成熟した単一のsiRNA-RISC複合体は、その後、主にシード領域(ヌクレオチド2~8)内で、ワトソン-クリック塩基対形成を介して相補的な標的mRNA転写産物と結合します。siRNA処理の次の段階において、AGO2はガイド鎖の5'末端から10番目と11番目に相当するヌクレオチド間のmRNAを部位特異的に切断します。この切断によってmRNAの安定性は損なわれ、細胞質内のエキソヌクレアーゼによる分解が促進され、その結果として翻訳は効果的に阻害されます。
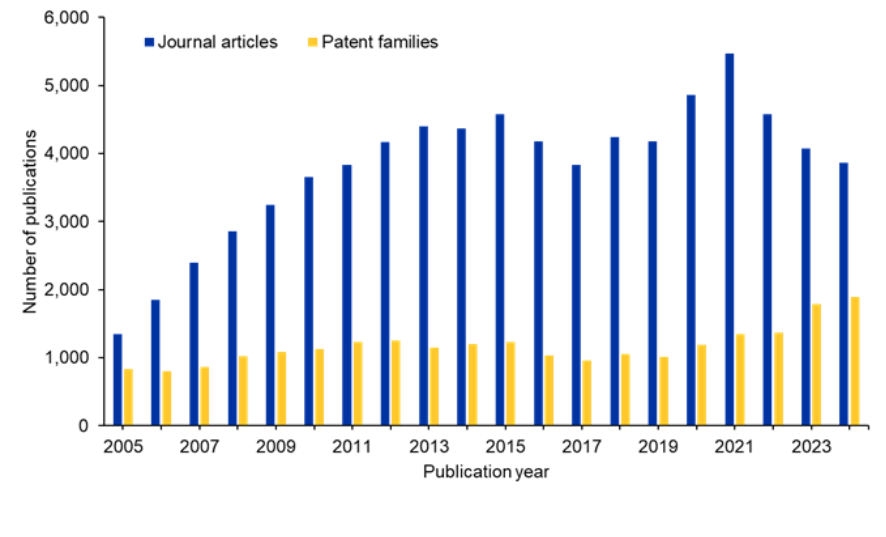
当社は、siRNAの研究環境をより深く理解するために、人間ががキュレーションした世界最大規模の科学情報のリポジトリであるCASコンテンツコレクションTMを調査しました。過去10年間のジャーナル、雑誌の発表には、わずかな変動の傾向が見られます。しかし、特許公報の数は増加し続けており、この分野に対する商業的関心が持続していることを示唆しています(図2を参照)。
前述のように、siRNA製剤は、病態を引き起こす遺伝子を正確にサイレンシングすることにより、複数の疾患領域にわたって有望な治療法として急速に発展しています。CASコンテンツコレクションの分析によると、研究対象の最も顕著な治療分野はがん(71%)で、次に感染症(8%)、神経疾患(6%)、心血管障害(5%)、糖尿病(5%)が続きます(図3を参照)。

しかし、化学的修飾や高度な薬物送達システムがなければ、これらの治療薬は疾病を効果的に治療する潜在能力を十分に発揮できません。研究者たちは、siRNAを治療レベルで送達・維持することを可能にする可能性のある、これら二つの分野で進展を見せています。
例えば、2′-O-メチル基、2′-フルオロ基、ホスホチオエート結合などの化学修飾は、ヌクレアーゼ抵抗性を高め、結合親和性を向上させ、免疫原性を低減することで、循環中のsiRNAを安定化させます。同時に、脂質ナノ粒子(LNPs)、ポリマー系キャリア、標的化コンジュゲートといった先進的な送達システムは、エンドソームからの脱出を促進し組織特異的分布を可能にすることで、siRNA取り込みの物理的障壁を克服する上で極めて重要です。これらの技術革新について、さらに詳しく見ていきましょう。
siRNA製剤の化学修飾
化学修飾の選択と組み合わせは、RNAi活性の維持、安定性の向上、免疫原性の低減、薬物動態の最適化、費用対効果など、複数の要因に左右されます。合親和性や標的特異性といった特性の微調整も可能にする。これらの修飾は一般的に、影響を受けるsiRNA分子の構造的構成要素に基づいて分類されます。具体的には、糖(リボース)、リン酸骨格、塩基、末端基、および追加された官能基への結合が挙げられます。
化学修飾の選択と組み合わせは、RNAi活性の維持、安定性の向上、免疫原性の低減、薬物動態の最適化、コスト効率など、いくつかの要因によって決定されます。一部の修飾は大きな利点をもたらしますが、大規模生産における設計の複雑化と合成コストの増加とのバランスを考慮する必要があります。
糖(リボース)の修飾
リボースの2′位の修飾は、最も頻繁に使用されています。
- 2′-O-メチル (2′-OMe) 基はヌクレアーゼ耐性を向上させ、免疫刺激を軽減します。
- 2′-O-メトキシエチル(2′-MOE)修飾は、安定性をさらに高め、毒性を低下させます。
- 2′-フルオロ(2′-F)置換は、高い活性を維持しつつ、酵素による分解耐性を大幅に向上させます。
- 2′-O-アリル修飾は薬物動態特性の調整に用いられ、全身循環において利点をもたらします。
ロック核酸(LNA)のような立体構造修飾は、その制約された二環式構造により高い結合親和性を付与する一方、アンロック核酸(UNA)は骨格に柔軟性をもたらし、オフターゲット相互作用を低減する可能性があります。2′-4′架橋型核酸もまた、立体構造の剛性を向上させることで標的特異性を高めるために用いられています。
リン酸骨格修飾
siRNAのリン酸骨格は、分子の安定性と細胞への取り込みに重要です。
- ホスホロチオエート (PS) 修飾では、非架橋酸素を硫黄に置き換えて、ヌクレアーゼ活性に対する耐性を大幅に向上させます。
- 両方の非架橋酸素が硫黄に置き換えられたホスホロジチオエート修飾は、さらに高いレベルの保護を提供します。
- ボラノホスフェート修飾はボラン基を骨格に導入し、骨格の特性を変化させる一方、メチルホスホネート修飾は骨格を中性にし、細胞内送達性を損なうことなく免疫原性を低減します。
塩基修飾
核酸塩基修飾は、ワトソン・クリックの塩基対形成を妨げることなく、免疫センサーによる認識を調節し、結合親和性を変化させるように設計されています。
- 5-メチルシトシンの取り込みは免疫活性化を低下させます。
- シュードウリジンは、免疫反応を緩和しながら、全体的なRNAの安定性を高めます。
- 2-チオウリジンは方向性結合を強化するために使用され、イノシンはゆらぎ塩基対を可能にし、意図しないオフターゲット効果を軽減するのに役立ちます。
末端および共役修飾
末端修飾により、siRNAの薬理学的特性がさらに強化されます。特に5′末端では、免疫認識を抑制するためにリン酸の除去や一時的なシリル保護などの修飾が行われます。3'末端では、コレステロールの結合やアミノ基の追加により、細胞膜との相互作用と取り込みが促進されます。肝細胞認識のためのGalNAc、がん細胞標的化のための葉酸、そして組織特異的デリバリーのためのアプタマーや抗体などの標的リガンドは、siRNAの生体内分布をさらに精密に制御する役割を果たします。
安定化とパターンに基づく修飾
追加の戦略としては、オーバーハングや内部修飾による構造の調整が挙げられます。オーバーハング修飾(dTdTヌクレオチドの導入や化学修飾オーバーハングなど)はヌクレアーゼに対する耐性を高めます。パターンに基づく修飾には非対称修飾や位置特異的修飾が含まれます。例えば、ガイド鎖では最小限の修飾にとどめつつパッセンジャー鎖に強い修飾を施すことで、RNAi機構を望ましい機能鎖へ誘導できます。さらに、RISCの負荷や活性に重要な位置(末端領域、中央領域、シード領域など)を標的とした修飾により、特異性と活性をさらにさらに精密に調整できます。
高度な修飾
従来の修飾を超えた高度な類似体には、グリコールヌクレイン酸(GNA)、ペプチドヌクレイン酸(PNA)、モルホリノ修飾、トリシクロ-DNAなどがあり、これらは骨格構造を完全に変える革新的なアプローチです。これらの修飾は、安定性や特異性、全体的な薬理特性を向上させる代替手段を提供するとともに、従来のRNA修飾では得られない全く新しい特性を導入することもあります。
siRNA治療薬の送達システム
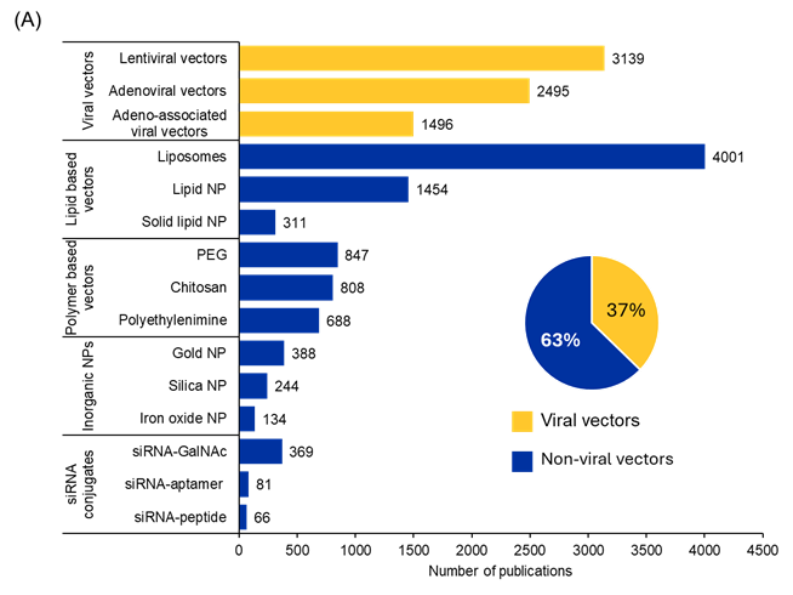
安定性の低さ、細胞取り込みの低さ、毒性、オフターゲット効果などの長年の課題に対処するために、siRNA研究は大幅に進歩しました。CASコンテンツコレクションの分析では、siRNA投与に一般的に使用される送達システムを調べたところ、ほとんどの出版物(63%)が非ウイルス送達システムに言及しているのに対し、37%がウイルスベクターベースの送達システムに言及していることがわかりました(図4Aを参照)。
さらに、これらのシステムそれぞれについて、過去数年間の論文数の傾向を分析しました(図4B参照)。脂質ベースのベクターは過去数年間で最も顕著な論文数の増加を示しており、siRNA複合体も微妙な増加を示しています。ウイルスベクターとポリマーベースのベクターには同様の傾向がありますが、無機ナノ粒子はここ数年は横ばい状態にあるようです。
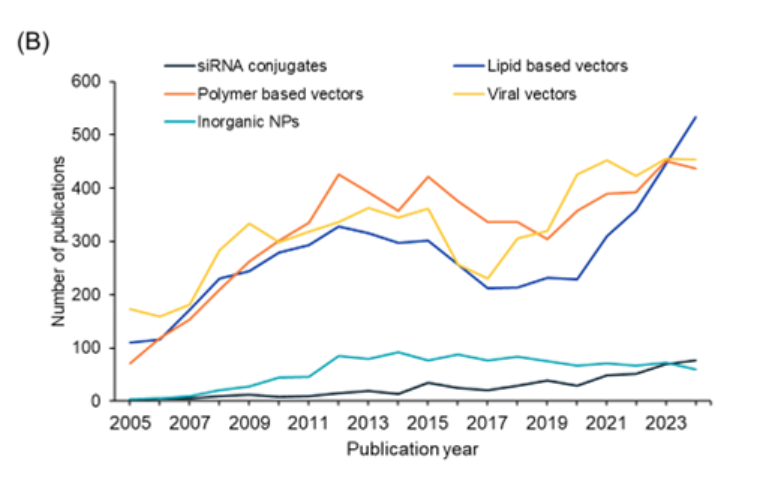
ウイルスベクターは、その自然な細胞侵入機構により高いトランスフェクション効率を発揮し、改変されたカプシドによって組織特異的標的化を可能にする場合もあります。例えば、AAVベクターは低免疫原性と特定の組織親和性から神経系および眼疾患の臨床試験で研究されており、レンチウイルス系は癌遺伝子を標的とした前臨床の遺伝子サイレンシング研究で重要な役割を果たしています。
脂質ベースのベクターは、臨床的に最も進んだプラットフォームとして位置づけられています。LNPは、イオン化可能な脂質、ヘルパー脂質、PEG化脂質、コレステロールを組み合わせたもので、現在siRNA送達の標準となっており、FDA承認治療薬である遺伝性トランスサイレチン媒介アミロイドーシス治療薬パティシランがその例です。カチオン性および中性のリポソームも、エンドソームからの脱出を促進するためのpH感受性脂質を加えた形で、がんや遺伝疾患を含む多くの適応症で臨床および前臨床評価が進められています。固体脂質ナノ粒子(SLN)やリポプレックスは、薬物放出の制御やスケーラブルな製造プロセスを提供するといった特長により、脂質ベースプラットフォームの多様性に寄与しています(参考文献参照)。
ポリマーベースのベクターは、siRNAとカチオン性ポリマーの静電的複合化を利用することで、これらの送達オプションを拡張し、細胞内取り込みを促進しエンドソームからの脱出を容易にします。ポリエチレンイミン(PEI)、ポリ-L-リジン(PLL)、キトサン、PAMAMデンドリマーなどの材料は、炎症性疾患、神経疾患、腫瘍性疾患での使用に最適化されています。研究者たちは、標的送達のために修飾により受容体媒介性取り込みを可能とする、ポリ(β-アミノエステル)などの合成ポリマーや、ヒアルロン酸を含む天然ポリマーも開発しています。
無機ナノ粒子は、siRNAキャリアとしても注目を集めています。金ナノ粒子(AuNPs)は、カチオン性ポリマーによる機能化によりsiRNAの確実な結合を保証でき、光熱的放出メカニズムについてがんモデルで評価されています。メソポーラスシリカナノ粒子は、調整可能な細孔サイズと表面アミノ基機能化を有し、腫瘍微小環境におけるsiRNAの制御された放出を目的として設計されています。鉄酸化物で構成される磁性ナノ粒子は、外部磁場による指向性送達とMRIを用いたリアルタイムイメージングという二重の利点を持ち、診断と治療の両面での利用が期待されています。
直接化学的結合戦略は、siRNAデリバリーのもう一つの効率的な方法です。GalNAcクラスターなどの標的化リガンドにsiRNAを共有結合させることで、研究者はアシアロ糖タンパク質受容体を介した肝細胞特異的送達を実現しました。この受容体は肝疾患において極めて重要であることが証明されています。コレステロール、脂肪酸、胆汁酸、細胞透過性ペプチドなどの他の結合基は細胞内取り込みを促進し薬物動態を改善するため、がんや代謝性疾患など幅広い治療応用の可能性を拡大しています。興味深いことに、FDA承認済みsiRNA治療薬6剤のうち5剤にGalNAc修飾が施されています。
天然および生物応答性材料を活用した他の高度な送達システムも登場しています。エクソソームは、生体内でのコミュニケーション機能と血液脳関門を越える能力で知られ、CNS疾患におけるsiRNAキャリアとして改良が進められています。並行して、pH変化、酵素活性、酸化還元状態、さらには光照射といった特定のトリガーに応じてsiRNAを放出するよう設計された生体応答性材料が、固形腫瘍モデルや膵臓癌において前臨床評価を受けています。さらに、RNAiマイクロスポンジは、多孔性のスポンジ状構造内にsiRNAを封入することでRNAi療法への新たなアプローチを提供し、従来のsiRNA送達法と比較して送達効率と安定性の向上が期待されています。
総合的に、これらの多様な送達プラットフォームは、siRNAの安定性、生体内分布、細胞内取り込みを改善するだけでなく、肝疾患や遺伝性疾患から腫瘍学や中枢神経系障害に至るまでの臨床応用の範囲を拡大します。先端材料科学と分子標的戦略の統合により、次世代のsiRNA治療への道が開かれ、さまざまな疾患領域にわたってより正確で効果的かつ安全な治療法が提供されます。
今日の精密医療におけるsiRNA製剤
siRNA製剤の化学的修飾や送達システムの開発により、様々な疾患の治療にこれらの薬剤を使用する研究が増加しています。図3にあるように、最も注目されている標的はがんと心血管系疾患ですが、他にも注目されている分野があります。
- がん:前臨床研究と初期段階の臨床試験では、さまざまながんにおける KRAS、VEGF、EGFR、HER2、C-MYCなどの標的が調査されています。これらの標的は、腫瘍の成長、血管新生、免疫回避の鍵となります。初期の発見では、これらのドライバーがダウンレギュレーションされると、腫瘍の退縮と転移に顕著な影響があることが示唆されています。しかし、腫瘍の不均一性と腫瘍微小環境の複雑さは依然として大きな課題であり、siRNAが目的の細胞に効果的かつ安全に到達するようにするには、高度な送達システム、例えば、カスタマイズされた脂質ナノ粒子や受容体特異的複合体などの開発が必要です。最近の研究では、化学療法薬や免疫チェックポイント阻害薬との併用によるがん治療におけるさらなる可能性が示されています。
- 心血管疾患:siRNAアプローチは、LDLコレステロール値を強力に低下させるためにPCSK9を標的とするインクリシランのような薬剤の承認により、すでに重要なマイルストーンに到達しています。ANGPTL3、APOB、LPA などの他の標的も調査中であり、初期の臨床データは、正確な肝臓標的化が脂質プロファイルを効果的に調節できることを示唆しています。
- 神経疾患および神経変性疾患:APP、BACE1、タウ、α-シヌクレインなどのタンパク質を標的とするsiRNAの使用は、アルツハイマー病、パーキンソン病、ALSなどの疾患に対して有望です。しかし、血液脳関門は依然として困難な障壁であり、中枢神経系への取り込みを促進するため、直接投与法(例:髄腔内注射)や新規ナノ粒子キャリアの開発が模索されています。
- 感染症:siRNAは、HBV転写物やHIV調節タンパク質を標的とする候補に見られるように、ウイルス遺伝子をサイレンシングする能力や、SARS-CoV-2の文脈におけるACE2のような宿主要素を調節する能力について評価が進められています。これらの戦略は、初期の研究でウイルス量の減少を示す有望な結果を示していますが、ウイルスの急速な変異と自然免疫応答の潜在的な活性化が継続的な課題となっています。
- 糖尿病:糖尿病に対するsiRNA製剤の臨床段階への移行はまだ始まったばかりです。しかし、いくつかの前臨床研究では、PTP1B、TXNIP、FOXO1などの標的をサイレンシングすることで、インスリンシグナル伝達を強化し、β細胞機能を維持する可能性が強調されています。代謝調節の本質的な複雑さと、オフターゲット効果なしにsiRNAを組織特異的に送達することの難しさが、臨床応用への道のりをさらに複雑にしています。他の研究では、siRNAを用いたサイレンシングアプローチを用いて、インスリンシグナル伝達におけるGLUT4やGSK3Bなどの重要なタンパク質の役割を研究しています。
siRNA研究の拡大を裏付けるのは、これらの疾患カテゴリー全体で数百の薬剤候補が前臨床および臨床開発段階にあるという事実です(図5を参照)。アテローム性動脈硬化症(Novo Nordisk/Eli Lilly)、ハンチントン病(Ionis Pharmaceuticals/Roche)、筋緊張性筋ジストロフィー(Avidity Biosciences)、および肝炎感染症(Alnylam Pharmaceuticals/Vir Biotech)の4つの薬剤が第III相臨床開発段階にあります。心血管疾患、神経疾患、がんは、開発中の医薬品候補の数が多い上位3つの治療分野です。

siRNA製剤の展望
肝臓は依然としてsiRNA研究の主な対象ですが、現在の取り組みでは、脳、肺、腎臓、固形腫瘍などの他の臓器を標的とする送達システムの設計が進められています。これには、血液脳関門などの生物学的障壁を克服できる新しいリガンドやナノ粒子製剤の開発が含まれます。
がん治療において、siRNA戦略は主要ながん遺伝子を抑制し、薬剤耐性に対抗することを目的としており、初期研究から有望な成果が得られています。脂質ベースのキャリア、ポリマーベクター、エクソソームを用いた送達技術の進展により、組織特異的な標的化の精度と効率が向上すると期待されています。また、化学修飾の高度化に伴い、siRNAの安定性が改善され免疫応答が低減されることで、治療の安全域が拡大しています。
これらの進展は、siRNA治療法のより幅広い承認と、様々な疾患に対する臨床応用につながる可能性があり、精密医療における重要な進歩によって世界中の患者に希望をもたらすでしょう。