Las terapias con ARN pequeño interferente (ARNip) son una clase de fármacos que utilizan la vía de interferencia del ARN (ARNi) para silenciar genes específicos. Este proceso se describió por primera vez en Caenorhabditis elegans en 1998 y condujo al desarrollo de moléculas de ARNip que se dirigen al ARN mensajero (ARNm) para suprimir la producción de proteínas implicadas en diversas enfermedades.
En 2006, los científicos que descubrieron el silenciamiento génico mediado por ARNip recibieron el Premio Nobel de Fisiología o Medicina. El primer fármaco terapéutico de siRNA aprobado, el patisiran, recibió la autorización reglamentaria en 2018 para el tratamiento de la amiloidosis hereditaria mediada por transtiretina. Desde entonces, se han aprobado otros fármacos de ARNip: el givosiran para la porfiria hepática aguda, el lumasiran para la hiperoxaluria primaria tipo 1 y el inclisiran para el tratamiento de la hipercolesterolemia. Entre las autorizaciones más recientes se encuentran las del vutrisiran y el nedosiran, que amplían aún más la aplicación de los tratamientos con ARNip a trastornos metabólicos, cardiovasculares y genéticos.
Estos avances han consolidado el ARNip como un enfoque terapéutico preciso en una amplia gama de áreas clínicas. Afecciones como el cáncer, el alzhéimer o el VIH podrían ser objetivos de las terapias con ARNip y, según Pharmaproject, hay más de 260 fármacos candidatos con ARNip en fase de desarrollo preclínico o clínico.
Esto es prometedor, pero hasta la fecha ha habido importantes retos para el desarrollo coherente y fiable de fármacos con estas terapias. Los siRNA no modificados —los que se administran sin modificaciones químicas ni sistemas de administración especializados— son muy susceptibles a la degradación rápida por las ribonucleasas ubicuas en los fluidos biológicos, lo que reduce drásticamente su vida media efectiva y perjudica su capacidad para llegar a las células diana. Además, su carga negativa inherente y su naturaleza hidrófila dificultan la absorción celular eficiente, lo que les impide atravesar las membranas celulares y alcanzar concentraciones intracelulares adecuadas. Sin modificaciones químicas, también existe un mayor riesgo de provocar respuestas inmunitarias innatas, lo que podría desencadenar vías inflamatorias indeseadas y comprometer la seguridad general.
Los investigadores están descubriendo nuevos avances que podrían superar estos obstáculos persistentes. Las modificaciones químicas y los sistemas avanzados de administración de fármacos están mostrando progresos y, como resultado, las terapias con siRNA están cada vez más cerca de mejorar la medicina de precisión en numerosas enfermedades.
Cómo funcionan las terapias de siRNA
El siRNA media el silenciamiento génico a través de una vía de ARNi conservada y regulada, que facilita la regulación negativa postranscripcional de transcripciones génicas específicas (véase la figura 1).

Los dúplex de ARNip administrados de forma exógena suelen tener una longitud de 21-23 nucleótidos con salientes de 3′-dinucleótidos. Estos se introducen en el citosol, donde son reconocidos por el complejo de silenciamiento inducido por ARN (RISC) multiproteico. Para la activación del RISC es fundamental la endonucleasa Argonaute 2 (AGO2), que retiene selectivamente la cadena guía tras el desenrollamiento independiente del ATP del dúplex y la expulsión concomitante de la cadena pasajera.
El complejo siRNA-RISC maduro y monocatenario se une posteriormente a las transcripciones de ARNm diana complementarias mediante el emparejamiento de bases de Watson-Crick, predominantemente dentro de la región semilla (nucleótidos 2-8). Durante los siguientes pasos del procesamiento del siRNA, AGO2 cataliza la escisión endonucleolítica específica del sitio del ARNm entre los nucleótidos correspondientes a las posiciones 10 y 11 desde el extremo 5′ de la cadena guía. Esta escisión altera la estabilidad del ARNm, lo que provoca su degradación por las exonucleasas citoplasmáticas y anula eficazmente la traducción.
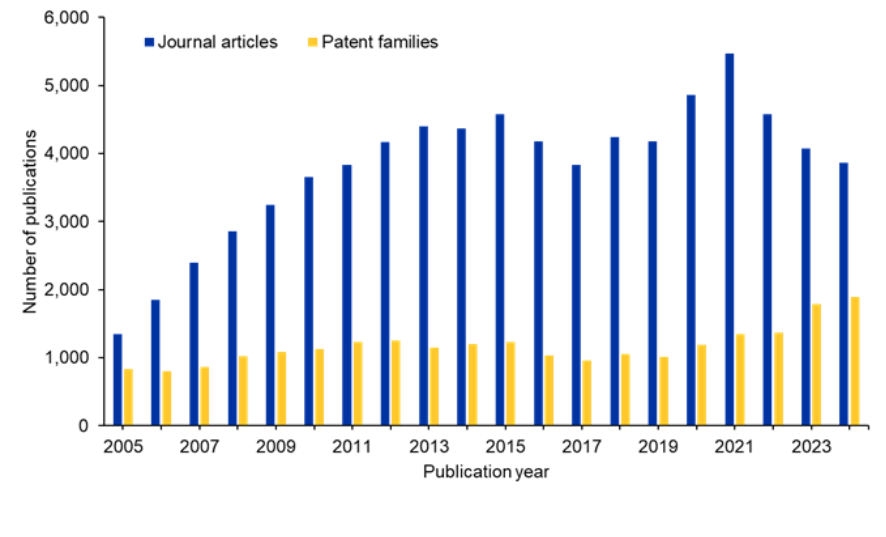
Examinamos la CAS Content CollectionTM, el mayor repositorio de información científica catalogado por humanos, para comprender mejor el panorama de la investigación sobre el ARNip. Hay una tendencia ligeramente oscilante en relación con las publicaciones en revistas durante los últimos diez años. Sin embargo, las publicaciones de patentes siguen aumentando, lo que sugiere un interés comercial sostenido en esta área (véase la figura 2).
Como se ha señalado, las terapias con ARNip han evolucionado rápidamente hasta convertirse en una modalidad prometedora en múltiples áreas terapéuticas, al silenciar con precisión los genes que impulsan la patología. Según nuestro análisis de la CAS Content Collection, el cáncer es el área terapéutica más destacada en la investigación (71 %), seguida de las enfermedades infecciosas (8 %), las afecciones neurológicas (6 %), los trastornos cardiovasculares (5 %) y la diabetes (5 %) (véase la figura 3).

Sin embargo, sin modificaciones químicas o sistemas avanzados de administración de fármacos, estas terapias no pueden alcanzar su potencial para tratar enfermedades de forma eficaz. Los investigadores están logrando avances en estas dos áreas, lo que podría garantizar que los siRNA se administren y se mantengan en niveles terapéuticos.
Por ejemplo, las modificaciones químicas, como la incorporación de grupos 2′-O-metilo, 2′-fluoro y enlaces fosforotioatos, aumentan la resistencia a las nucleasas, mejoran la afinidad de unión y reducen la inmunogenicidad, estabilizando así los siRNA en circulación. Al mismo tiempo, los sistemas de administración avanzados, como las nanopartículas lipídicas (LNP), los transportadores basados en polímeros y los conjugados dirigidos, son fundamentales para superar las barreras físicas a la absorción de los siRNA, ya que facilitan el escape endosomal y permiten una distribución específica en los tejidos. Exploremos estas innovaciones con más detalle:
Modificaciones químicas de los tratamientos con siRNA
Las modificaciones químicas abordan varias limitaciones de los siRNA no modificados, como la susceptibilidad a las nucleasas, el rápido aclaramiento renal y la posible inmunogenicidad, al tiempo que ajustan propiedades como la afinidad de unión y la especificidad de la diana. Estas modificaciones se clasifican generalmente en función del componente estructural de la molécula de ARNip al que afectan: el azúcar (ribosa), la cadena principal de fosfato, las bases nucleicas, los grupos terminales y la conjugación con grupos adicionales.
La selección y combinación de modificaciones químicas viene dictada por varios factores: la preservación de la actividad del ARN de interferencia, la mejora de la estabilidad, la reducción de la inmunogenicidad, la optimización farmacocinética y la rentabilidad. Aunque algunas modificaciones ofrecen ventajas sustanciales, deben sopesarse con el aumento de la complejidad en el diseño y el coste de la síntesis para la producción a gran escala.
Modificaciones del azúcar (ribosa)
Las modificaciones en la posición 2′ de la ribosa se encuentran entre las más utilizadas.
- Los grupos 2′-O-metilo (2′-OMe) mejoran la resistencia a las nucleasas y reducen la estimulación inmunitaria.
- Las modificaciones 2′-O-metoxietilo (2′-MOE) mejoran aún más la estabilidad y reducen la toxicidad.
- Las sustituciones 2′-fluoro (2′-F) mantienen una alta actividad al tiempo que mejoran significativamente la resistencia a la degradación enzimática.
- Las modificaciones 2′-O-alilo se utilizan para ajustar las propiedades farmacocinéticas, lo que ofrece beneficios en la circulación sistémica.
Las modificaciones conformacionales, como el ácido nucleico bloqueado (LNA), con su estructura bicíclica restringida, también confieren una alta afinidad de unión, mientras que el ácido nucleico desbloqueado (UNA) introduce flexibilidad en la cadena principal, lo que puede reducir las interacciones indeseadas. Los ácidos nucleicos puenteados 2′-4′ también se emplean para mejorar la especificidad de la diana mediante una mayor rigidez conformacional.
Modificaciones del esqueleto de fosfato
La cadena principal de fosfato de los siRNA es fundamental para la estabilidad molecular y la absorción celular.
- Las modificaciones con fosforotioato (PS) implican la sustitución de un oxígeno no puenteado por azufre, lo que aumenta significativamente la resistencia a la actividad de la nucleasa.
- Las modificaciones con fosforoditioato, en las que ambos oxígenos no puenteados se sustituyen por azufre, ofrecen un nivel de protección aún mayor.
- Las modificaciones con boranofosfato incorporan un grupo borano, lo que altera las propiedades de la cadena principal, mientras que las modificaciones con metilfosfonato hacen que la cadena principal sea neutra, lo que reduce la inmunogenicidad sin comprometer la entrega celular.
Modificaciones de bases
Las modificaciones de las bases nucleicas están diseñadas para modular el reconocimiento por parte de los sensores inmunitarios y alterar las afinidades de unión sin alterar el emparejamiento de bases de Watson-Crick.
- La incorporación de 5-metilcitosina puede reducir la activación inmunitaria.
- La pseudouridina mejora la estabilidad general del ARN al tiempo que mitiga las respuestas inmunitarias.
- La 2-tiouridina se utiliza para potenciar la unión direccional, y la inosina permite el emparejamiento de bases inestables, lo que puede reducir los efectos indeseados.
Modificaciones terminales y conjugadas
Las modificaciones terminales mejoran aún más el perfil farmacológico de los siRNA. En el extremo 5', se utilizan modificaciones como la eliminación de fosfato o la protección silílica temporal para reducir el reconocimiento inmunitario durante la administración. En el extremo 3', la conjugación de colesterol o la adición de grupos amino facilitan una mejor interacción con la membrana celular y su absorción. Los ligandos de orientación, como el GalNAc para el reconocimiento de hepatocitos, el folato para la orientación hacia células cancerosas y los aptámeros o anticuerpos para la administración específica en tejidos, refinan aún más la biodistribución de los siRNA.
Estabilización y modificaciones basadas en patrones
Otras estrategias consisten en adaptar la estructura mediante modificaciones internas y salientes. Las modificaciones salientes, como la incorporación de nucleótidos dTdT o salientes modificados químicamente, aumentan la resistencia a las nucleasas. Las modificaciones basadas en patrones incluyen modificaciones asimétricas y específicas de posición. Por ejemplo, una modificación intensa en la cadena pasajera frente a una mínima en la cadena guía puede sesgar el mecanismo de ARNi hacia la cadena funcional deseada, y las alteraciones específicas en posiciones críticas para la carga y la actividad del RISC (por ejemplo, regiones terminales, centrales o semilla) pueden refinar aún más la especificidad y la actividad.
Modificaciones avanzadas
Más allá de las modificaciones tradicionales, los análogos avanzados, como el ácido nucleico glicólico (GNA), el ácido nucleico peptídico (PNA), las modificaciones morfolino y el ADN tricíclico, representan enfoques innovadores para alterar por completo la estructura de la cadena principal. Estas modificaciones proporcionan métodos alternativos para mejorar la estabilidad, la especificidad y el comportamiento farmacológico general, introduciendo en ocasiones propiedades completamente nuevas que no se pueden conseguir con las modificaciones clásicas del ARN.
Sistemas de administración para terapias con ARNip
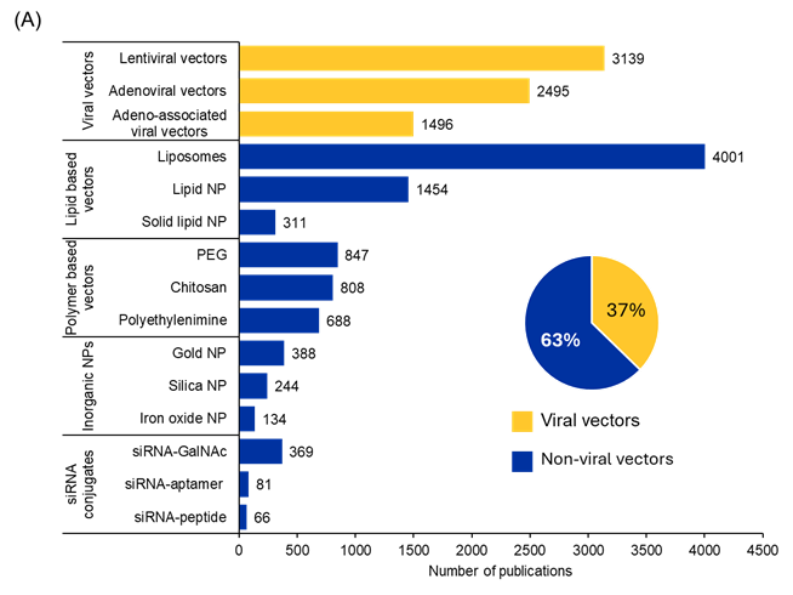
Se han producido avances significativos en la investigación del ARNip para abordar retos de larga data, como la escasa estabilidad, la baja captación celular, la toxicidad y los efectos indeseados. En nuestro análisis de la CAS Content Collection, buscamos los sistemas de administración más utilizados para la administración de ARNip y descubrimos que la mayoría de las publicaciones (63 %) mencionan sistemas de administración no virales, mientras que el 37 % menciona sistemas de administración basados en vectores virales (véase la figura 4A).
Analizamos más a fondo la tendencia en el número de publicaciones de los últimos años para cada uno de estos sistemas (véase la figura 4B). Los vectores basados en lípidos muestran el aumento más destacado en términos de publicaciones en los últimos años, mientras que los conjugados de ARNip también muestran un ligero aumento. Los vectores virales y los vectores basados en polímeros tienen una tendencia similar, mientras que las nanopartículas inorgánicas parecen haberse estabilizado en los últimos años.
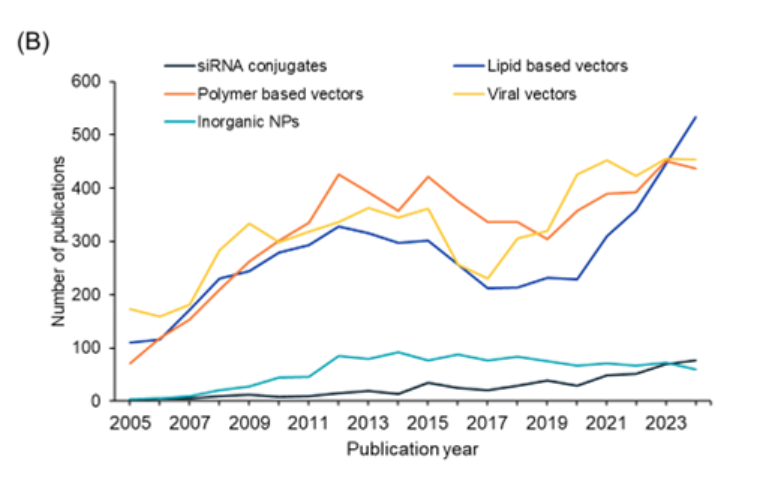
Los vectores virales producen altas eficiencias de transfección debido a sus mecanismos naturales de entrada celular y, en algunos casos, permiten la orientación específica a tejidos mediante modificaciones de la cápside diseñadas. Por ejemplo, los vectores AAV se han explorado en ensayos clínicos para trastornos neurológicos y oculares debido a su baja inmunogenicidad y tropismo tisular definido, mientras que los sistemas lentivirales siguen siendo fundamentales en los estudios preclínicos de silenciamiento génico dirigidos a oncogenes.
Los vectores basados en lípidos siguen siendo la plataforma más avanzada clínicamente. Los LNP, que combinan lípidos ionizables, lípidos auxiliares, lípidos PEGilados y colesterol, son ahora el estándar en la administración de ARNip, como lo demuestra la terapia patisiran, aprobada por la FDA para la amiloidosis hereditaria mediada por transtiretina. Los liposomas, en sus formas catiónicas y neutras con lípidos sensibles al pH añadidos para un mejor escape endosomal, también se encuentran en fase de evaluación clínica y preclínica para numerosas indicaciones, entre ellas el cáncer y los trastornos genéticos. Las nanopartículas lipídicas sólidas (SLN) y los lipoplexos contribuyen aún más a la diversidad de las plataformas basadas en lípidos, ya que ofrecen perfiles de liberación controlada y procesos de producción escalables (ref. ref.).
Los vectores basados en polímeros amplían estas opciones de administración al aprovechar la complejación electrostática del ARNip con polímeros catiónicos, lo que mejora la absorción celular y facilita el escape endosomal. Materiales como la polietilenimina (PEI), la poli-L-lisina (PLL), el quitosano y los dendrímeros PAMAM se han optimizado para su uso en enfermedades inflamatorias, neurológicas y oncológicas. Los investigadores también han diseñado polímeros sintéticos como los poli(β-aminoésteres) y polímeros naturales, incluido el ácido hialurónico, para la administración dirigida, donde las modificaciones permiten la captación mediada por receptores.
Las nanopartículas inorgánicas también han llamado la atención como portadores de ARNip. Las nanopartículas de oro (AuNP) pueden funcionalizarse con polímeros catiónicos para garantizar la unión segura del ARNip y se han evaluado en modelos de cáncer por sus mecanismos de liberación fototérmica. Las nanopartículas de sílice mesoporosa, con sus tamaños de poro ajustables y su funcionalización amino superficial, se han diseñado para la liberación controlada de ARNip en el microambiente tumoral. Las nanopartículas magnéticas, compuestas por óxidos de hierro, ofrecen la doble ventaja de la administración dirigida mediante campos magnéticos externos y la obtención de imágenes en tiempo real mediante resonancia magnética, lo que respalda su uso en diagnósticos y terapias.
Las estrategias de conjugación química directa proporcionan otra vía eficaz para la administración de ARNip. Al unir el ARNip covalentemente a ligandos de orientación como los clústeres GalNAc, los investigadores han logrado una administración específica en los hepatocitos a través del receptor de asialoglicoproteína, que ha demostrado ser fundamental para las enfermedades hepáticas. Otras fracciones conjugadas, como el colesterol, los ácidos grasos, los ácidos biliares y los péptidos penetrantes en las células, mejoran la absorción celular y la farmacocinética, ampliando así las posibles aplicaciones terapéuticas para incluir cánceres y trastornos metabólicos. Es interesante señalar que, de los seis tratamientos con ARNip aprobados por la FDA, cinco contienen modificaciones GalNac.
Están surgiendo otros sistemas de administración avanzados que aprovechan los materiales naturales y biorresponsivos. Los exosomas, vesículas derivadas de las células conocidas por sus funciones de comunicación innatas y su capacidad para atravesar barreras biológicas como la barrera hematoencefálica, se están perfeccionando como transportadores de ARNip en trastornos del SNC. Paralelamente, los materiales biorresponsivos diseñados para liberar ARNip en respuesta a desencadenantes específicos, como cambios de pH, actividad enzimática, condiciones redox o incluso exposición a la luz, están siendo sometidos a evaluación preclínica en modelos de tumores sólidos y cáncer de páncreas. Además, las microesponjas de ARNi ofrecen un enfoque novedoso para la terapia con ARNi al encapsular el ARNip dentro de una estructura porosa similar a una esponja, lo que podría mejorar la eficiencia y la estabilidad de la administración en comparación con los métodos tradicionales de administración de ARNip.
En conjunto, estas diversas plataformas de administración no solo mejoran la estabilidad, la biodistribución y la captación celular de los siRNA, sino que también amplían el abanico de aplicaciones clínicas, desde enfermedades hepáticas y genéticas hasta oncología y trastornos del SNC. La integración de la ciencia de materiales avanzada con estrategias de focalización molecular está allanando el camino para la próxima generación de terapias con siRNA, que ofrecen modalidades de tratamiento más precisas, eficaces y seguras en diversas áreas terapéuticas.
Las terapias con siRNA en la medicina de precisión actual
Los avances en las modificaciones químicas y los sistemas de administración de los tratamientos con ARNip están impulsando una mayor investigación sobre el uso de estos fármacos para tratar diversas enfermedades. Como se observa en la figura 3, los objetivos más explorados son el cáncer y las enfermedades cardiovasculares, pero hay otras áreas de interés:
- Cáncer: Los estudios preclínicos y los ensayos clínicos en fase inicial han explorado dianas como KRAS, VEGF, EGFR, HER2 y c-MYC en diversos tipos de cáncer. Estas dianas son clave para el crecimiento tumoral, la angiogénesis y la evasión inmunitaria. Los primeros resultados sugieren que, cuando se regula a la baja estos factores, se produce un efecto notable en la regresión tumoral y la metástasis. Sin embargo, la naturaleza heterogénea de los tumores y la complejidad del microambiente tumoral siguen siendo retos importantes, lo que requiere el desarrollo de sistemas de administración avanzados, como nanopartículas lipídicas personalizadas o conjugados específicos para receptores, a fin de garantizar que el ARNip llegue a las células deseadas de forma eficaz y segura. Estudios recientes han demostrado su potencial adicional en el tratamiento del cáncer en combinación con fármacos quimioterapéuticos o inhibidores de puntos de control inmunitario.
- Enfermedades cardiovasculares: los enfoques basados en el ARNip ya han alcanzado un hito importante con la autorización de fármacos como el inclisiran, que se dirige al PCSK9 para reducir de forma significativa los niveles de colesterol LDL. Se están investigando otras dianas, como ANGPTL3, APOB y LPA, y los primeros datos clínicos sugieren que la orientación hepática precisa puede modular eficazmente los perfiles lipídicos.
- Afecciones neurológicas y neurodegenerativas: el uso de ARNip para actuar sobre proteínas como APP, BACE1, tau y α-sinucleína ofrece esperanzas para enfermedades como el alzhéimer, el párkinson y la ELA. Sin embargo, la barrera hematoencefálica continúa siendo un obstáculo difícil de superar, lo que ha llevado a la exploración de métodos de administración directa (por ejemplo, inyecciones intratecales) o nuevos transportadores de nanopartículas para mejorar la absorción por el sistema nervioso central.
- Enfermedades infecciosas: se está evaluando la capacidad de los siRNA para silenciar genes virales, como se observa en los candidatos que se dirigen a las transcripciones del VHB o a las proteínas reguladoras del VIH, y para modular factores del hospedador como la ACE2 en el contexto del SARS-CoV-2. Aunque estas estrategias han mostrado reducciones alentadoras de la carga viral en los primeros estudios, la rápida mutación viral y la posible activación de respuestas inmunitarias innatas plantean retos continuos.
- Diabetes: la traducción de las terapias con siRNA a fases clínicas para la diabetes aún está en fase emergente. Sin embargo, varios estudios preclínicos han subrayado el potencial de silenciar dianas como PTP1B, TXNIP y FOXO1 para mejorar la señalización de la insulina y preservar la función de las células beta. La complejidad inherente a la regulación metabólica y la dificultad de lograr la administración específica de los siRNA en los tejidos sin efectos indeseados complican aún más el camino hacia la aplicación clínica. Otros estudios han utilizado enfoques de silenciamiento mediados por ARNip para estudiar el papel de proteínas importantes como GLUT4 y GSK3B en la señalización de la insulina.
El hecho de que cientos de fármacos candidatos se encuentren en fase de desarrollo preclínico y clínico en estas categorías de enfermedades (véase la figura 5) subraya la expansión de la investigación sobre los ARNip. Cuatro fármacos se encuentran en fase III de desarrollo clínico para la aterosclerosis (Novo Nordisk/Eli Lilly), la enfermedad de Huntington (Ionis Pharmaceuticals/Roche), la distrofia muscular miotónica (Avidity Biosciences) y la infección por hepatitis (Alnylam Pharmaceuticals/Vir Biotech). Los trastornos cardiovasculares, los trastornos neurológicos y los cánceres son las tres áreas terapéuticas principales en cuanto al número de fármacos candidatos en desarrollo.

Perspectivas para las terapias con ARNip
Aunque el hígado sigue siendo el objetivo principal de la investigación con ARNip, actualmente se están diseñando sistemas de administración dirigidos a otros órganos, como el cerebro, los pulmones, los riñones y los tumores sólidos. Esto implica el desarrollo de nuevos ligandos y formulaciones de nanopartículas que puedan superar barreras biológicas como la barrera hematoencefálica.
En oncología, las estrategias con ARNip tienen como objetivo suprimir los oncogenes clave y contrarrestar la resistencia a los fármacos, con resultados prometedores en los primeros estudios. Se espera que los avances en los transportadores basados en lípidos, los vectores poliméricos y los métodos de administración de exosomas aumenten la precisión y la eficacia de la orientación a los tejidos. Las modificaciones químicas mejoradas siguen aumentando la estabilidad del ARNip y reduciendo las respuestas inmunitarias, lo que se traduce en una ventana terapéutica más amplia.
Estos avances podrían dar lugar a una mayor autorización y aplicación clínica de las terapias con ARNip en una amplia gama de enfermedades, lo que ofrecería esperanza a los pacientes de todo el mundo con importantes avances en la medicina de precisión.