Os terapêuticos de RNA de interferência pequena (siRNA) são uma classe de medicamentos que utilizam a via de interferência de RNA (RNAi) para silenciar genes específicos. Este processo foi relatado pela primeira vez em Caenorhabditis elegans em 1998, e levou ao desenvolvimento de moléculas de siRNA que têm como alvo o RNA mensageiro (mRNA) para suprimir a produção de proteínas implicadas em várias doenças.
Em 2006, os cientistas que descobriram o silenciamento genético mediado por siRNA receberam o Prêmio Nobel de Fisiologia ou Medicina. A primeira terapia de siRNA aprovada, o patisiran, recebeu autorização regulatório em 2018 para o tratamento da amiloidose hereditária mediada por transtirretina. Desde então, outros medicamentos de siRNA foram aprovados: givosiran para porfiria hepática aguda, lumasiran para hiperoxalúria primária tipo 1 e inclisiran para o controle da hipercolesterolemia. As aprovações mais recentes foram vutrisiran e nedosiran, que ampliam ainda mais a aplicação da terapêutica de siRNA em distúrbios metabólicos, cardiovasculares e genéticos.
Esses avanços estabeleceram o siRNA como uma abordagem terapêutica precisa em uma série de áreas clínicas. Doenças como câncer, Alzheimer e HIV podem ser alvos da terapêutica de siRNA e, de acordo com a Pharmaproject, há mais de 260 candidatos a medicamentos de siRNA em desenvolvimento pré-clínico ou clínico.
Isso é promissor, mas até o momento houve desafios significativos para o desenvolvimento consistente e confiável de medicamentos com essas terapêuticas. Os siRNAs não modificados — aqueles administrados sem modificações químico/químicas ou sistemas de entrega especializados — são altamente suscetíveis à rápida degradação por ribonucleases onipresentes em fluidos biológicos, o que reduz drasticamente sua meia-vida efetiva e prejudica sua capacidade de atingir as células-alvo. Além disso, sua carga negativa inerente e sua natureza hidrofílica dificultam a captação celular eficiente, impedindo-os de atravessar as membranas celulares e atingir concentrações intracelulares adequadas. Sem modificações químicas, há também um risco aumentado de provocar respostas imunes inatas, potencialmente desencadeando vias inflamatórias fora do alvo e comprometendo a segurança geral.
Os pesquisadores estão encontrando novas descobertas importantes que podem superar esses obstáculos persistentes. Modificações químicas e sistemas avançados de administração de medicamentos estão mostrando progresso e consequentemente a terapêutica de siRNA está próxima de aprimorar a medicina de precisão em várias doenças.
Como funcionam os terapêuticos de siRNA
O siRNA atua como mediador do silenciamento de genes por meio de uma via de RNAi conservada e regulada, que facilita a regulação negativa pós-transcricional de transcritos de genes específicos (ver Figura 1).

Os duplexes de siRNA administrados exogenamente geralmente têm de 21 a 23 nucleotídeos de comprimento com saliências de 3′-dinucleotídeos. São introduzidos no citosol, onde são reconhecidos pelo complexo multiproteico de silenciamento induzido por RNA (RISC). Fundamental na ativação do RISC é a endonuclease Argonaute 2 (AGO2), que retém seletivamente a fita-guia após o desenrolamento independente de ATP do duplex e a ejeção concomitante da fita passageira.
O complexo maduro de siRNA-RISC de fita única subsequentemente se liga a transcritos de mRNA alvo complementares por meio do emparelhamento de bases de Watson-Crick, predominantemente dentro da região semente (nucleotídeos 2–8). Durante as etapas seguintes do processamento do siRNA, AGO2 catalisa a clivagem endonucleolítica específica do mRNA entre os nucleotídeos correspondentes às posições 10 e 11 da extremidade 5' da fita-guia. Essa clivagem interrompe a estabilidade do mRNA, levando à sua degradação por exonucleases citoplasmáticas e anulando efetivamente a tradução.
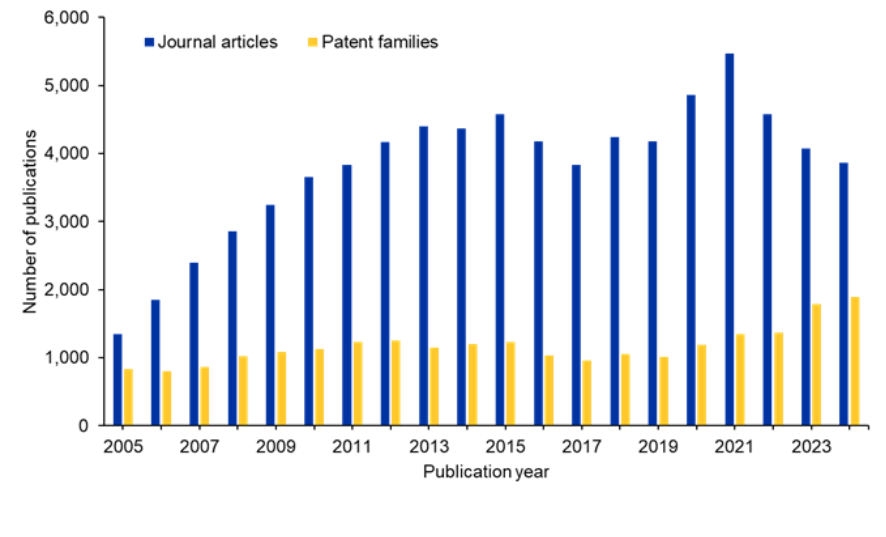
Analisamos o Coleção de conteúdo do CASTM, o maior repositório de informações científicas com curadoria humana, para entender melhor o cenário de pesquisa do siRNA. Há uma tendência ligeiramente oscilante relacionada às publicações em periódicos nos últimos dez anos. No entanto, as publicações de patentes continuam aumentando, sugerindo o interesse comercial sustentado nesta área (veja a Figura 2).
Como observado, as terapias de siRNA evoluíram rapidamente para uma modalidade promissora em várias áreas de doenças, silenciando com precisão os genes que impulsionam a patologia. De acordo com nossa análise da Coleção de Conteúdo do CAS, o câncer é a área terapêutica mais proeminente pesquisada (71%), seguido por doenças infecciosas (8%), condições neurológicas (6%), distúrbios cardiovasculares (5%) e diabetes (5%) (ver Figura 3).

No entanto, sem modificações químicas nem sistemas avançados de administração de medicamentos, esses terapêuticos não podem atingir seu potencial para tratar doenças de maneira eficaz. Os pesquisadores estão avançando nessas duas áreas, o que pode garantir que os siRNAs sejam entregues e mantidos em níveis terapêuticos.
Por exemplo, modificações químicas como a incorporação de grupos 2′-O-metil, 2′-fluoro e ligações de fosforotioato aumentam a resistência à nuclease, melhoram a afinidade de ligação e reduzem a imunogenicidade, estabilizando assim os siRNAs na circulação. Ao mesmo tempo, sistemas avançados de entrega, como nanopartículas lipídicas (LNPs), transportadores à base de polímeros e conjugados direcionados, são essenciais para superar as barreiras físicas à captação de siRNA, facilitando o escape endossômico e permitindo a distribuição específica do tecido. Vamos explorar essas inovações com mais detalhes:
Modificações químico/químicas de terapêuticas de siRNA
As modificações químicas abordam várias limitações dos siRNAs não modificados, incluindo a suscetibilidade a nucleases, a rápida depuração renal e a possível imunogenicidade, além de ajustar propriedades como a afinidade de ligação e a especificidade do alvo. Essas modificações são geralmente categorizadas com base no componente estrutural da molécula de siRNA que elas afetam: o açúcar (ribose), a espinha dorsal do fosfato, as nucleobases, os grupos terminais e a conjugação com outras porções.
A seleção e a combinação de modificações químicas são determinadas por vários fatores: preservação da atividade de RNAi, aumento da estabilidade, redução da imunogenicidade, otimização farmacocinética e custo-benefício. Embora algumas modificações ofereçam benefícios substanciais, elas devem ser equilibradas com o aumento da complexidade no design e no custo da síntese para produção em larga escala.
Modificações de açúcar (ribose)
As modificações na posição 2′ da ribose estão entre as mais frequentemente empregadas.
- Os grupos 2′-O-metil (2′-OMe) melhoram a resistência à nuclease e reduzem a estimulação imunológica.
- As modificações 2′-O-metoxietil (2′-MOE) aumentam ainda mais a estabilidade e reduzem a toxicidade.
- As substituições 2′-fluoro (2′-F) mantêm alta atividade enquanto melhoram consideravelmente a resistência à degradação enzimática.
- As modificações 2′-O-alil são usadas para ajustar as propriedades farmacocinéticas, oferecendo benefícios na circulação sistêmica.
Modificações conformacionais como o Ácido Nucleico Bloqueado (LNA), com sua estrutura bicíclica restrita, também conferem alta afinidade de ligação, enquanto o Ácido Nucleico Desbloqueado (UNA) introduz flexibilidade na estrutura principal, possivelmente reduzindo as interações fora do alvo. Os ácidos nucleicos em ponte 2′-4′ também são empregados para aumentar a especificidade do alvo por meio de maior rigidez conformacional.
Modificações da espinha dorsal de fosfato
A estrutura de fosfato dos siRNAs é fundamental para a estabilidade molecular e a captação celular.
- As modificações de fosforotioato (PS) envolvem a substituição de um oxigênio sem ponte por enxofre, aumentando consideravelmente a resistência à atividade da nuclease.
- As modificações de fosforoditioato, nas quais ambos os oxigênios não ligantes são substituídos por enxofre, oferecem um nível ainda maior de proteção.
- As modificações de boranofosfato incorporam um grupo borano, alterando as propriedades do esqueleto, enquanto as modificações de metilfosfonato tornam o esqueleto neutro, reduzindo a imunogenicidade sem comprometer a entrega celular.
Modificações de base
As modificações de nucleobase são projetadas para modular o reconhecimento por sensores imunológicos e alterar as afinidades de ligação sem interromper o emparelhamento de bases Watson-Crick.
- A incorporação de 5-metilcitosina pode reduzir a ativação imunológica.
- A pseudouridina aumenta a estabilidade geral do RNA enquanto atenua as respostas imunológicas.
- A 2-tiouridina é usada para aumentar a ligação direcional, e a inosina permite o emparelhamento de bases oscilantes, o que pode ajuda a reduzir os efeitos não intencionais fora do alvo.
Modificações terminais e conjugados
As modificações terminais aprimoram ainda mais o perfil farmacológico dos siRNAs. Na extremidade 5′, modificações como a remoção de fosfato ou a proteção temporária de silil são usadas para reduzir o reconhecimento imunológico durante o fornecimento. Na extremidade 3′, a conjugação do colesterol ou a adição de grupos amino facilitam a interação e a captação da membrana celular. Os ligantes de direcionamento, incluindo GalNAc para reconhecimento de hepatócitos, folato para direcionamento de células cancerígenas e aptâmeros ou anticorpos para entrega específica de tecido, refinam ainda mais a biodistribuição de siRNAs.
Estabilização e modificações baseadas em padrões
Estratégias adicionais envolvem a adaptação da estrutura por meio de saliências e modificações internas. Modificações de extensões, como a incorporação de nucleotídeos dTdT ou extensões quimicamente modificadas, aumentam a resistência às nucleases. As modificações baseadas em padrões incluem modificações assimétricas e específicas de posição. Por exemplo, a modificação pesada na fita passageira em comparação com a mínima na fita-guia pode influenciar o mecanismo de RNAi em direção à fita funcional desejada, e as alterações direcionadas em posições críticas para o carregamento e a atividade do RISC (por exemplo, regiões terminais, centrais ou de sementes) podem refinar ainda mais a especificidade e a atividade.
Modificações avançadas
Além das modificações tradicionais, análogos avançados como ácido nucleico de glicol (GNA), ácido nucleico peptídico (PNA), modificações de morfolino e triciclo-DNA, representam abordagens inovadoras para alterar totalmente a estrutura do esqueleto. Essas modificações oferecem métodos alternativos para aumentar a estabilidade, a especificidade e o comportamento farmacológico geral, às vezes introduzindo propriedades totalmente novas que não podem ser obtidas com as modificações clássicas de RNA.
Sistemas de entrega para terapias de siRNA
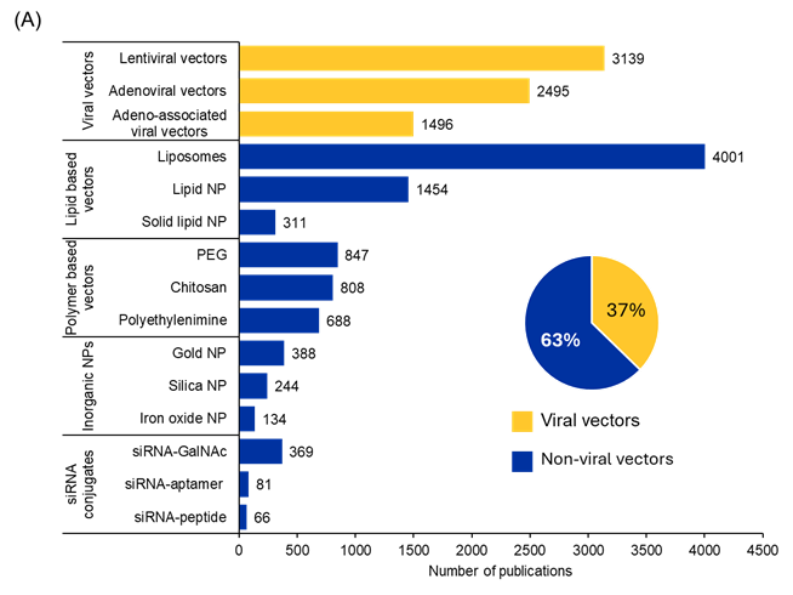
Houve avanços significativos na pesquisa de siRNA para enfrentar desafios de longa data, como baixa estabilidade, baixa absorção celular, toxicidade e efeitos fora do alvo. Em nossa análise da Coleção de Conteúdo do CAS, procuramos os sistemas de entrega comumente usados para administração de siRNA e descobrimos que a maioria das publicações (63%) menciona sistemas de entrega não virais, enquanto 37% mencionam sistemas de entrega baseados em vetores virais (ver Figura 4A).
Analisamos ainda a tendência no número de publicações ao longo dos últimos anos para cada um desses sistemas (ver Figura 4B). Os vetores à base de lipídios apresentam o aumento mais proeminente em termos de publicações nos últimos anos, enquanto os conjugados de siRNA também mostram um aumento sutil. Os vetores virais e os vetores à base de polímeros apresentam tendência semelhante, enquanto as nanopartículas inorgânicas parecem ter se estabilizado nos últimos anos.
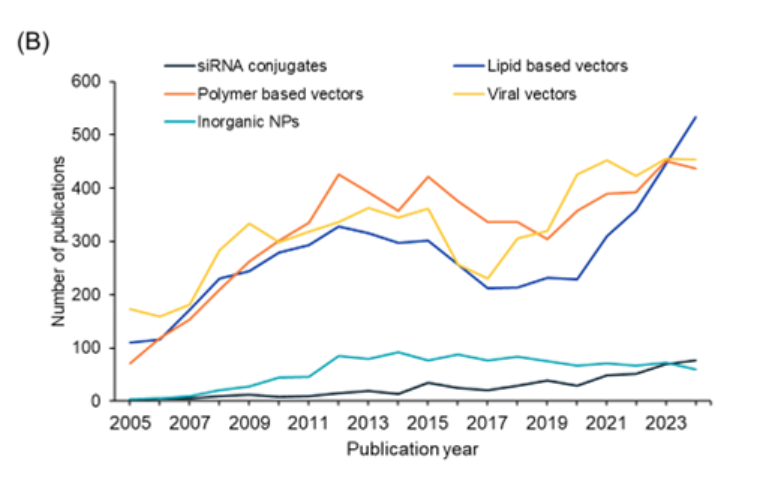
Vetores virais produzem altas eficiências de transfecção devido aos seus mecanismos naturais de entrada celular e, em alguns casos, permitem o direcionamento específico para tecidos por meio de modificações de capsídeo projetadas. Por exemplo, os vetores AAV têm sido explorados em ensaios clínicos para distúrbios neurológicos e oculares devido à sua baixa imunogenicidade e ao tropismo definido do tecido, enquanto os sistemas lentivirais ainda são fundamentais em estudos pré-clínicos de silenciamento de genes visando oncogenes.
Vetores baseados em lipídios ainda são a plataforma mais avançada clinicamente. As LNPs, que combinam lipídios ionizáveis, lipídios auxiliares, lipídios PEGilados e colesterol, agora são padrão na entrega de siRNA, como exemplificado pela terapia patisiran aprovada pela FDA para amiloidose hereditária mediada por transtirretina. Os lipossomas, em suas formas catiônicas e neutras com adição de lipídios sensíveis ao pH para melhor escape endossômico, também estão sob avaliação clínica e pré-clínica para inúmeras indicações, incluindo câncer e doenças genéticas. As nanopartículas lipídicas sólidas (SLNs) e os lipoplexos contribuem ainda mais para a diversidade das plataformas baseadas em lipídios, oferecendo perfis de liberação controlada e processos de produção escaláveis (ref ref).
Os vetores baseados em polímeros estendem essas opções de entrega pelo aproveitamento da complexação eletrostática do siRNA com polímeros catiônicos, aumentando assim a captação celular e facilitando o escape endossômico. Materiais como polietilenimina (PEI), poli-L-lisina (PLL), quitosana e dendrímeros PAMAM foram otimizados para uso em doenças inflamatórias, neurológicas e oncológicas. Os pesquisadores também desenvolveram polímeros sintéticos, como poli(β-aminoésteres) e polímeros naturais, incluindo o ácido hialurônico, para a entrega direcionada, em que as modificações permitem a captação mediada pelo receptor.
Nanopartículas inorgânicas também chamaram a atenção como transportadoras de siRNA. As nanopartículas de ouro (AuNPs) podem ser funcionalizadas com polímeros catiônicos para garantir a ligação segura do siRNA e foram avaliadas em modelos de câncer quanto aos seus mecanismos de liberação fototérmica. Nanopartículas de sílica mesoporosa, com seus poros com tamanhos ajustáveis e funcionalização amino de superfície, foram projetadas para a liberação controlada de siRNA no microambiente tumoral. As nanopartículas magnéticas, compostas por óxidos de ferro, oferecem os benefícios duplos de entrega direcionada por meio de campos magnéticos externos e imagens em tempo real por meio de ressonância magnética, que oferece apoio ao seu uso em diagnósticos e terapêutica.
Estratégias de conjugação químico direta apresentam outra rota eficiente para a entrega de siRNA. Ligando covalentemente o siRNA a ligantes de direcionamento, como os clusters de GalNAc, os pesquisadores conseguiram uma entrega específica para hepatócitos por meio do receptor de asialoglicoproteína, que se mostrou essencial para doenças hepáticas. Outras moléculas conjugadas, incluindo colesterol, ácidos graxos, ácidos biliares e peptídeos de penetração celular, aumentam a absorção celular e melhoram a farmacocinética, ampliando assim as possíveis aplicações terapêuticas para incluir cânceres e distúrbios metabólicos. É interessante observar que, das seis terapias de siRNA aprovadas pela FDA, cinco têm a modificação GalNac.
Outros sistemas avançados de administração estão surgindo que capitalizam materiais naturais e biorresponsivos. Exossomos, as vesículas derivadas de células conhecidas por seus papéis de comunicação inatos e capacidade de atravessar barreiras biológicas como a barreira hematoencefálica, estão sendo refinadas como transportadores de siRNA em distúrbios do SNC. Paralelamente, materiais biorresponsivos projetados para liberar siRNA em resposta a estímulos específicos, como alterações de pH, atividade enzimática, condições redox ou até mesmo exposição à luz, estão sendo submetidos à avaliação pré-clínica em modelos de tumores sólidos e câncer pancreático. Além disso, as microesponjas de RNAi oferecem uma nova abordagem para a terapia de RNAi, encapsulando o siRNA em uma estrutura porosa semelhante a uma esponja, potencialmente melhorando a eficiência e a estabilidade da administração em comparação com os métodos tradicionais de administração de siRNA.
Coletivamente, essas diversas plataformas de entrega não somente melhoram a estabilidade, a biodistribuição e a captação celular dos siRNAs, como também ampliam a gama de aplicações clínicas, desde doenças hepáticas e genéticas até oncologia e distúrbios do SNC. A integração da ciência avançada de materiais com estratégias de direcionamento molecular está pavimentando o caminho para a próxima geração de terapêuticos de siRNA, oferecendo modalidades de tratamento mais precisas, eficazes e seguras em várias áreas de doenças.
Terapêutica com siRNA na medicina de precisão nos dias de hoje
Os desenvolvimentos em modificações químicas e nos sistemas de entrega de terapias de siRNA estão impulsionando o aumento da pesquisa sobre o uso desses medicamentos para tratar várias doenças. Conforme observado na Figura 3, os alvos mais explorados são câncer e doenças cardiovasculares, mas há outras áreas de interesse:
- Câncer: estudos pré-clínicos e ensaios clínicos de fase inicial exploraram alvos como KRAS, VEGF, EGFR, HER2 e c-MYC em vários tipos de câncer. Esses alvos são fundamentais para o crescimento do tumor, angiogênese e evasão imunológica. As primeiras descobertas sugerem que, quando esses drivers são desregulados, há um efeito notável na regressão e metástase do tumor. No entanto, a natureza heterogênea dos tumores e a complexidade do microambiente tumoral continuam sendo desafios significativos, exigindo o desenvolvimento de sistemas avançados de entrega, como nanopartículas lipídicas personalizadas ou conjugados específicos de receptores para garantir que o siRNA atinja as células pretendidas de forma eficaz e segura. Estudos recentes mostraram seu potencial adicional no tratamento do câncer combinado com drogas quimioterápicas ou inibidores de checkpoint imunológico.
- Doença cardiovascular: as abordagens de siRNA já alcançaram um marco importante com a aprovação de medicamentos como o inclisiran, que tem como alvo o PCSK9 para reduzir de forma robusta os níveis de colesterol LDL. Outros alvos, como ANGPTL3, APOB e LPA, estão sendo investigados, com dados clínicos iniciais que sugerem que o direcionamento hepático preciso pode modular com eficácia os perfis lipídicos.
- Condições neurológicas e neurodegenerativas: O uso de siRNAs para atingir proteínas como APP, BACE1, tau e α-sinucleína é promissor para doenças como Alzheimer, Parkinson e ELA. No entanto, a barreira hematoencefálica continua representando um obstáculo difícil, levando à exploração de métodos de entrega direta (por exemplo, injeções intratecais) ou novos transportadores de nanopartículas para melhorar a absorção pelo sistema nervoso central.
- Doenças infecciosas: os siRNAs estão sendo avaliados por sua capacidade de silenciar genes virais, como visto em candidatos que têm como alvo as transcrições do HBV ou proteínas regulatórias do HIV, e de modular fatores do hospedeiro, como o ACE2, no contexto do SARS-CoV-2. Embora essas estratégias tenham apresentado reduções encorajadoras na carga viral em estudos iniciais, a rápida mutação viral e a possível ativação de respostas imunes inatas representam desafios contínuos.
- Diabetes: A tradução das terapias de siRNA para as fases clínicas do diabetes ainda está em desenvolvimento. No entanto, vários estudos pré-clínicos destacaram o potencial do silenciamento de alvos como PTP1B, TXNIP e FOXO1 para melhorar a sinalização da insulina e preservar a função das células beta. A complexidade inerente da regulação metabólica e a dificuldade em alcançar a entrega específica de tecidos dos siRNAs sem efeitos fora do alvo complicam ainda mais a jornada rumo à aplicação clínica. Outros estudos usaram abordagens de silenciamento mediado por siRNA para estudar o papel de proteínas importantes como GLUT4 e GSK3B na sinalização da insulina.
O que ressalta a expansão da pesquisa sobre siRNAs é o fato de que centenas de candidatos a medicamentos estão em desenvolvimento pré-clínico e clínico nessas categorias de doenças (ver Figura 5). Quatro medicamentos estão em fase III de desenvolvimento clínico, para aterosclerose (Novo Nordisk/Eli Lilly), doença de Huntington (Ionis farmacêuticos/Roche), distrofia muscular miotônica (Avidity Biosciences) e infecção por hepatite (Alnylam farmacêuticos/Vir Biotech). Distúrbios cardiovasculares, distúrbios neurológicos e cânceres são as três principais áreas terapêuticas para o número de candidatos a medicamentos em desenvolvimento.

Panorama das terapêuticas de siRNA
Embora o fígado continue sendo o principal alvo da pesquisa de siRNA, os esforços atuais estão projetando sistemas de entrega destinados a outros órgãos, como o cérebro, os pulmões, os rins e os tumores sólidos. Isso envolve o desenvolvimento de novos ligantes e formulações de nanopartículas que possam superar barreiras biológicas, como a barreira hematoencefálica.
Na oncologia, as estratégias de siRNA visam suprimir os principais oncogenes e neutralizar a resistência aos medicamentos, com resultados promissores surgindo de estudos iniciais. Espera-se que os avanços em transportadores baseados em lipídios, vetores de polímeros e métodos de entrega de exossomos aumentem a precisão e a eficiência do direcionamento de tecidos. As modificações químicas aprimoradas continuam a melhorar a estabilidade do siRNA e a reduzir as respostas imunológicas, resultando em uma janela terapêutica maior.
Esses desenvolvimentos podem resultar em uma aprovação mais ampla e na aplicação clínica de terapias de siRNA em uma série de doenças, oferecendo esperança aos pacientes no mundo todo com importantes avanços na medicina de precisão.