もし医師ががんを発見した瞬間から治療を始められたらどうでしょうか?最近のテラノスティクス(「治療」と「診断」の組み合わせ)の進展により、この「見て治療する」アプローチが臨床使用に近づいています。これは核医学に依存しており、複雑な疾患に対する高度に標的を絞った治療を可能にすることで医療を変革しつつあります。
従来は診断能力で知られていた核医学は、現在、同じ分子剤を用いた画像診断と治療の革新を通じて治療分野へと進展しています。この変化により、臨床医ががん、心血管疾患、神経疾患に取り組む方法が再定義され、より個別化された効果的な治療戦略が提供されるようになります。
診断機能と治療機能を併せ持つセラノスティクス剤の開発には、標的化メカニズム、イメージング特性、治療効果の統合的解析が求められます。セラノスティクスプラットフォームに取り組む創薬チームは、CAS BioFinderを活用することで、標的-リガンド相互作用の評価、生体内分布プロファイル、診断・治療複合アプローチの安全性検討を支える相互接続された生物学および化学データにアクセスできます。
詳しくはこちらをご覧ください。核医学の構成要素
核医学療法の中心にあるのは放射性医薬品です。放射性医薬品は、放射性同位体(放射性核種)とキャリア分子を組み合わせた化合物で、画像診断または治療のために標的放射線を届けます。これらの薬剤は、体内での安全かつ効果的な輸送を確保するために、しばしばキレート剤によって安定化されます(図1参照)。
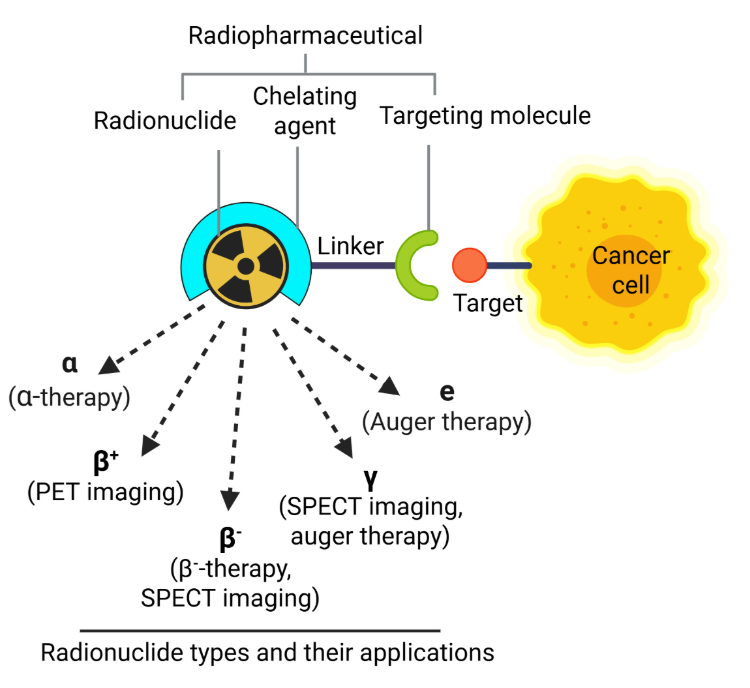
これらの薬剤は、その放出特性に応じて、PETスキャン(陽電子放射断層撮影)やSPECTスキャン(単一光子放射断層撮影)での診断に使用したり、DNA損傷を誘発して疾患細胞を破壊する治療に使用したりできます。この損傷には一本鎖切断(SSB)と二本鎖切断(DSB)が含まれ、その範囲と性質は放出される放射線の種類によって決まります。
アルファ粒子放出体(ラジウム223、アクチニウム225、アスタチン211 など)は、線エネルギー付与(LET)が高く、経路長が短いため、アポトーシスおよびピロプトーシス経路を活性化する高密度の局所的DSBを引き起こします。オージェ電子放出源(ヨウ素125、インジウム111など)も、その短い範囲と高いLETにより、高度に局所化されたDSBを生成します。
対照的に、ベータ線放出核種(例:ルテチウム177、イットリウム90)は線エネルギー付与(LET)が低く、主に活性酸素種(ROS)の生成を通じて間接的なDNA損傷を誘発し、一本鎖切断(SSB)や二本鎖切断(DSB)、および酸化ストレスを引き起こします。これらの損傷は、塩基除去修復(BER)、核酸除去修復(NER)、非相同末端結合(NHEJ)、相同組換え(HR)といったDNA修復機構を活性化させます。
しかし、がん細胞はしばしばDNA修復能力の欠損を示しており、そのため放射性医薬品が誘発する細胞毒性に対して脆弱になります。治療効果を高めるために、放射性医薬品と、ポリ(ADP-リボース)ポリメラーゼ(PARP)阻害剤のようなDNA修復阻害剤とを組み合わせる戦略が積極的に模索されています。
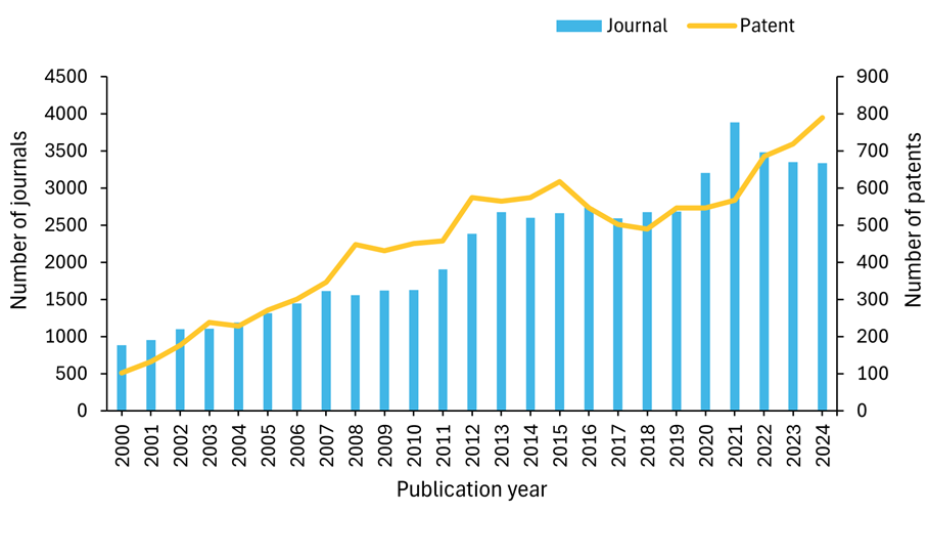
当社は、核医学の研究環境をより深く理解するために、人手によって収集された世界最大規模の科学情報リポジトリであるCASコンテンツコレクションTMを調査しました。その結果、過去20年間で、論文数が指数関数的に増加していることがわかりました。特に、特許活動は2020年以降大幅に増加し、2024年までに特許数は約800件に達し、核医学技術に対する商業的関心と革新の増加を示唆しています(図2参照)。
現在、約 67種類の放射性医薬品 がFDAの承認を受けており、うち54種類が診断薬、13種類が治療薬です。現在承認されているすべての治療用放射性医薬品は、がん治療を目的としています(図3を参照)。
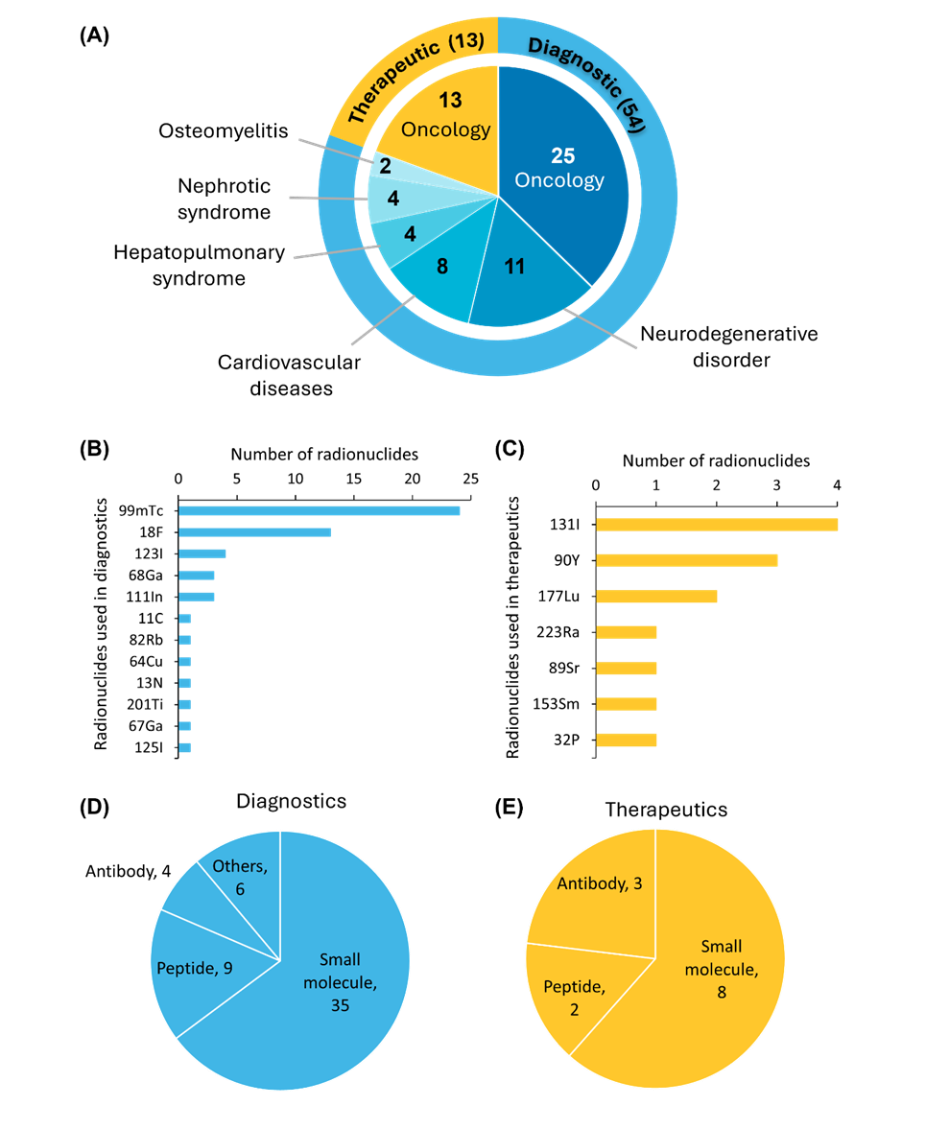
FDAが承認した放射性医薬品の中で、テクネチウム99m(⁹⁹ᵐTc)は画像診断に最も使用されている放射性核種ですが、治療用途ではヨウ素 131 (¹³¹I) が依然として第一の選択肢となっています。標的ベクターに関しては、薬物動態が良好で開発が容易なことから、小分子が最も多く使用されています。
FDAが神経内分泌腫瘍の診断と治療に[68Ga]/[177Lu]Ga-DOTA-TATEを承認したことを受けて、ペプチドベースの薬剤も臨床において極めて重要な意義を持つようになりました。抗体ベースの放射性医薬品も同様に重要な役割を果たしており、高い生体内結合親和性を提供することで、画像診断の精度と治療効果を高めています。さらに、より小規模なグループの承認済み薬剤には、タンパク質や血清アルブミンをベースとした放射性医薬品が含まれています。
核医学における最新の画期的発見
放射性医薬品、画像診断法、分子標的、同位体生産における重要な革新が核医学の進化を推進してきました。例えば、2020年から2024年という短期間に、治験段階にある放射性医薬品の数は約40から170近くへと大幅に増加しました。この急速な拡大は、規制当局による承認や、先駆的な薬剤の商業的成功によって後押しされたものと考えられます。その代表例として、神経内分泌腫瘍を治療するルタテラ®([177Lu]Lu-DOTA-TATE)や、PSMA陽性の転移性前立腺がんを標的とするプルヴィクト®([177Lu]Lu-PSMA-617)が挙げられ、これらはいずれも標的ラジオライガンド療法における新たな基準を打ち立てました。
注目すべき分野は以下の通りです。
- セラノスティクス:このダイナミックな分野において、近年最も重要な画期的進歩の一つとなっているのが、診断と治療に同様の放射性医薬品化合物を用いるセラノスティクス放射性医薬品の開発です。例えば、最近FDAに承認されたガリウム68標識の前立腺特異的膜抗原(PSMA)リガンド(ロカメッツ)は、PET画像診断を通じて前立腺がんを検出するために使用することができます。同じPSMAリガンドにルテチウム-177(プルヴィクト)を標識すると、がん治療のための標的放射線療法が可能になります。このアプローチは精密医療の頂点を極め、臨床医が極めて高い精度で疾患部位を特定し、健康な組織を温存しながら同じ標的に直接放射線療法を施すことを可能にします。
- 標的アルファ線療法: 2つの陽子と2つの中性子で構成されるヘリウム原子核であるアルファ粒子は、高い線エネルギー付与(LET)と限定的な組織透過性(50〜100 μm)を示します。この特性により、周囲の正常組織へのダメージを最小限に抑えつつ、個々のがん細胞に対して致死的な放射線量を届けるのに理想的な手法となっています。この特性は、精密腫瘍学における画期的な進歩である標的アルファ療法(TAT)の有効性を支えています。
当初は塩化ラジウム223(ゾーフィゴ®)によって例証されたTATは、²²⁵Ac-PSMA-617のような薬剤に拡大し、転移性去勢抵抗性前立腺がん(mCRPC)において顕著な臨床成果を示しています。患者の91%が前立腺特異抗原(PSA)レベルの低下を経験し、中央値生存期間は15か月でした。同位体生産技術の進歩により、大規模製造が可能となり、²¹²Pbなどの新規アルファ線放出体の開発が促進されています。臨床試験では、胃腸膵神経内分泌腫瘍を対象としたRayzeBioの第III相RYZ101試験を含む、多様ながん種におけるアルファ線放出療法の探索が進められています。
技術革新はTATの可能性をさらに高めています。これには二重特異性抗体、改良された結合化学、免疫療法やDNA損傷応答阻害剤との併用戦略などが含まれます。これらの開発を総合すると、TATは従来のベータ放射放射線療法に対する耐性を克服できる変革的アプローチとして位置づけられています。
- 次世代のキャリア:核医学における次世代のキャリア分子は、標的特異性、薬物動態、およびマルチモーダル機能を高める高度な送達プラットフォームを指します。最近の研究では、従来のキャリアに代わる有望な代替品として二環式ペプチドに注目が集まっています。二環式ペプチドは抗体のような親和性(ナノモル範囲)があり、優れた組織浸透性と迅速な腎排泄という利点を備えています。その一例として、 EphA2標的のBCY18469が挙げられます。BCY18469は、高い腫瘍集積率(投与1時間後で 19.5±3.5 %ID/g)を示し、投与からわずか5分後という極めて早い段階で優れた造影コントラストを実現しました。
超微小ナノ粒子(<10 nm)は臨床応用を実現しており、コーネルドットは各種悪性腫瘍の二重PET/光学イメージングを目的とした臨床試験段階にあります。この分野は、DARPin(設計アンキリン反復タンパク質)、アフィボディ、ナノボディといった代替足場タンパク質へと進化を遂げています。これらは、高い標的親和性を維持しつつ、過酷な放射性標識条件(最大95°C、pH 3.6〜11.0)下でも優れた安定性を発揮します。同時に、特定の細胞区画へスマートかつ段階的に薬剤を届けることができる、モジュール式のナノトランスポーターの開発も進んでいます。
これらのイノベーションは、オフターゲット毒性の低減、腫瘍への集積を最適化するための血中滞留時間の延長、そして能動的・受動的標的化戦略の組み合わせを可能にすることで、核医学における極めて重要な課題を解決します。また、診断用イメージングと治療的介入を単一のプラットフォームで提供できるセラノスティクス製剤の開発を後押ししており、次世代のキャリアを個別化精密医療のための変革的なツールとして位置づけています。
- 早期疾患に対する早期治療:核医学は近年、臨床面で目覚ましい成長を遂げてきましたが、伝統的には進行がん患者に対する最終手段としての緩和治療に留まってきました。このパラダイムは現在、活発な臨床調査によって劇的に変化しつつあります。例えば、ソマトスタチン受容体2(SSTR2)やPSMAを標的とした放射性医薬品療法は、より早期の疾患において有望な結果を示しています。特に、[¹⁷⁷Lu]Lu-DOTA-TATEは、進行性胃腸膵神経内分泌腫瘍に対する初期治療として使用した場合、無増悪生存期間において統計学的に有意かつ臨床的に意義のある改善を示しました。
同時に、¹⁷⁷Lu標識PSMA標的化合物は、治療歴のない転移性去勢抵抗性がん、転移性ホルモン感受性がん、寡転移性または生化学的再発疾患、局所進行性または高リスク症例を含む、複数の前立腺癌シナリオにおいて広範な臨床試験が進行中です。末期緩和ケアから早期治療介入へのこの拡大は、放射性医薬品が包括的ながん治療戦略に統合される方法における根本的な変革を表しており、疾患がより早期で治療可能な段階にある患者に対し、より効果的な治療成果を提供する可能性を秘めています。
- 個別化放射性医薬品療法におけるAI:AIモデルは、画像の再構成と改良、病変の自動検出、臓器/腫瘍の識別を容易にし、個別化された線量測定計算を可能にします。この統合は、放射性医薬品療法の日常的かつ信頼性の高い個別化を実現し、治療効果と患者の転帰を向上させることを目的としています。
これらの革新的技術が規制プロセスを経て臨床応用へと近づいている様子が確認できます。図4では治験薬を第I相、第II相、第III相に分類し、各セグメントを色分けしてその用途(診断薬、治療薬、セラノスティクス)を示しています。データにより、抗がん剤がすべての段階で優勢であり、特に第I相(32種類の薬剤を含む)で顕著であることが明らかになりました。この傾向は、腫瘍学における標的放射性核種療法とセラノスティクスの重要性の高まりを反映しており、放射性医薬品を使用した個別化治療戦略への移行を強調した最近の文献と一致しています。他の疾患領域も表されていますが、がんに比べるとその割合は少なく、がん以外の領域への応用の拡大を示しています。
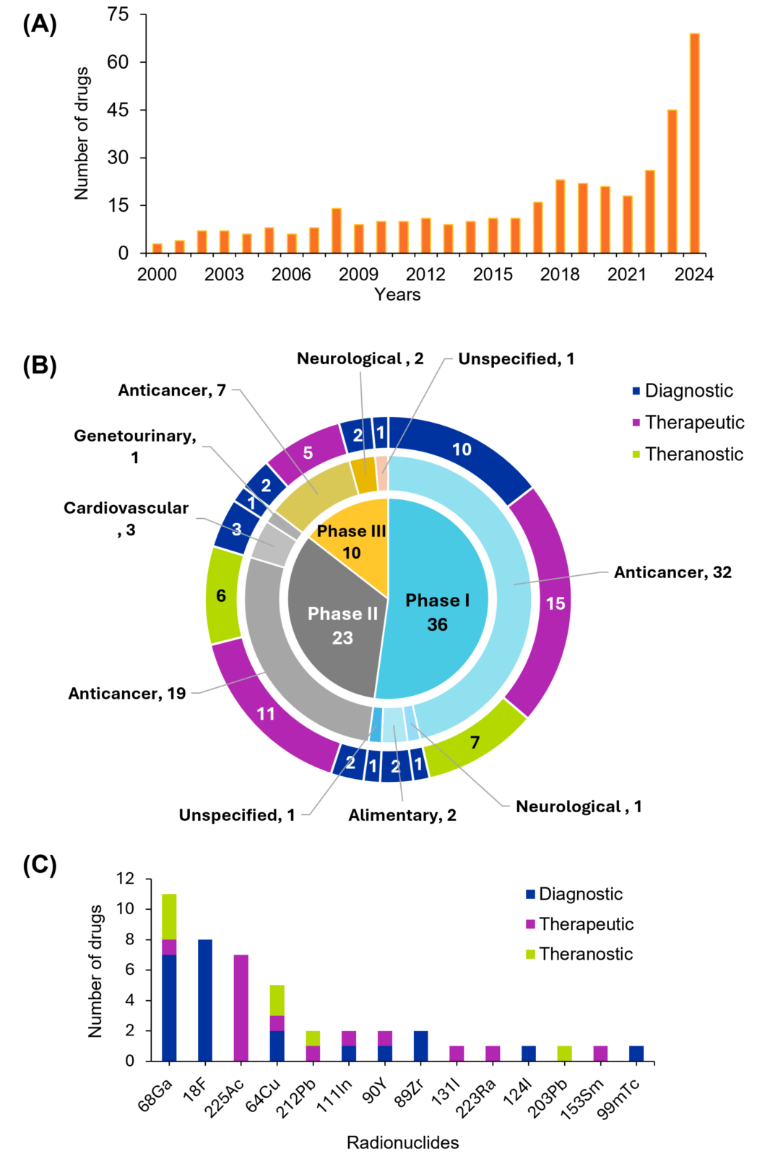
臨床試験の分析により、ガリウム68(⁶⁸Ga)とフッ素18(¹⁸F)が診断用途で優れていることが明らかになりました。これは、良好な半減期と陽電子放出特性により、PETイメージングで広く使用されていることを反映しています。治療用途では、標的放射線治療に理想的なアルファ線放出特性で知られるアクチニウム225(²²⁵Ac)が主導的です銅64(⁶⁴Cu)や鉛212(²¹²Pb)のような放射性核種は二重用途の可能性を示し、イメージングと治療を統合する拡大する治療診断パラダイムを支えています。
核医学を概念から臨床へ
核医学を臨床診療に導入するには、特にコストの高さと医療用同位元素の入手の制限など、いくつかの課題に直面します。また、訓練を受けた核医学専門家や放射性薬剤師が不足しているほか、インフラの制約により高度な画像診断や治療へのアクセスが制限されています。これは特に低所得国で顕著です。
同位元素の備蓄の拡大、労働力の増強、医療へのアクセスの強化はすべて長期的な問題であり、対処するには専用のリソースが必要です。しかし、この分野への投資レベルと予測される成長を考えると、将来は有望である可能性があります。
核医学分野は、資本投資の急増と戦略的統合に牽引され、2024年に目覚ましい成長を遂げました。PitchBookによると、この分野への総投資額は148億6000万ドルに急増し、2023年の投資額の3倍以上に上りました。この勢いは、大手製薬企業が拡大する市場での地位を迅速に強化するため、注目度の高い買収の波によってさらに増幅されました。例えばアストラゼネカは標的型アルファ療法を推進するため、フュージョン・ファーマシューティカルズを24億ドルで買収しました。
セラノスティクスと核医学のより広範な応用には依然として課題が残っていますが、さらなるイノベーションにより、がんやその他の衰弱性疾患を「見て治療する」という目標にさらに近づいています。
関連ケーススタディ:手頃な価格で高品質な医薬品を保護するための新たな機能の構築 - SandozがCASと提携してカスタムR&D機能を構築し、世界中の患者に手頃な価格で高品質な医薬品を届けた方法をご覧ください。
ケーススタディを読む