¿Y si los médicos pudieran empezar a tratar el cáncer en el mismo momento en que lo detectan? Con los recientes avances en teranóstica («terapia» más «diagnóstico»), este enfoque «verlo y tratarlo» se está acercando al uso clínico. Se basa en la medicina nuclear, que está transformando la atención médica al permitir terapias altamente específicas para enfermedades complejas.
Aunque tradicionalmente conocida por sus capacidades de diagnóstico, la medicina nuclear ahora avanza hacia la terapéutica mediante innovaciones en las que el mismo agente molecular se utiliza para la obtención de imágenes y el tratamiento. Este cambio está redefiniendo cómo los profesionales de la salud tratan el cáncer, las afecciones cardiovasculares y neurológicas, para ofrecer estrategias de tratamiento más personalizadas y eficaces.
Desarrollar agentes teranósticos que combinen funciones diagnósticas y terapéuticas requiere un análisis integrado de los mecanismos de direccionamiento, las propiedades de imagen y la eficacia terapéutica. Los equipos de descubrimiento de fármacos que usan plataformas teranósticas pueden utilizar CAS BioFinder™ para acceder a datos interconectados de biología y química que respalden la evaluación de interacciones objetivo-ligando, perfiles de biodistribución y consideraciones de seguridad para los enfoques diagnóstico-terapéuticos combinados.
Descubra más.Los componentes básicos de la medicina nuclear
En el corazón de las terapias de medicina nuclear están los radiofármacos, compuestos que combinan isótopos radiactivos (radionúclidos) con moléculas portadoras para administrar radiación, dirigida tanto para obtener imágenes como para ofrecer terapia. Estos agentes suelen estabilizarse con quelantes para garantizar un transporte seguro y eficaz por el cuerpo (vea la figura 1).
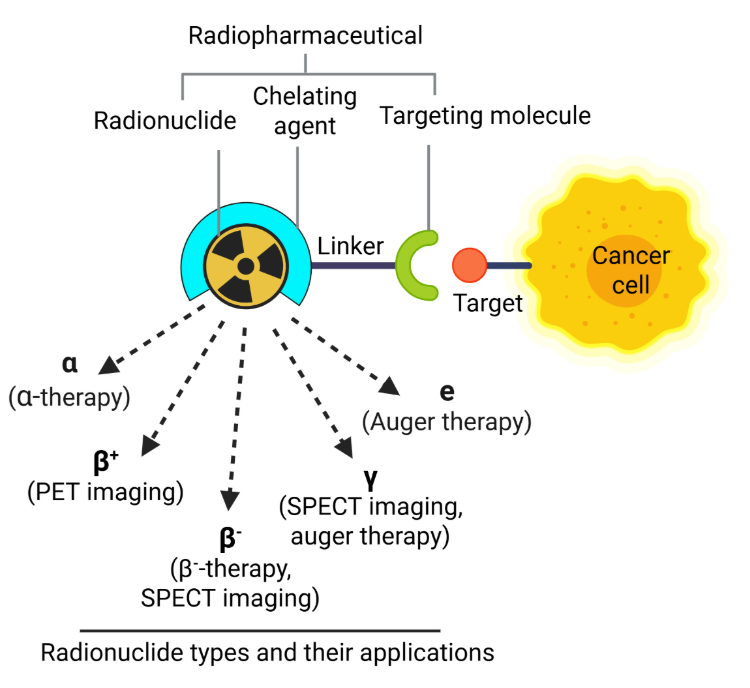
Según sus propiedades de emisión, estos agentes pueden usarse con fines diagnósticos en una tomografía por emisión de positrones (PET) y en una tomografía computarizada por emisión de fotón único (SPECT), o con fines terapéuticos para destruir las células enfermas mediante la inducción de daños en el ADN. Este daño incluye rupturas de cadena única (SSB) y rupturas de doble hebra (DSB), cuyo alcance y naturaleza están determinados por el tipo de radiación emitida.
Los emisores de partículas alfa (por ejemplo, radio-223, actinio-225 o astatina-211) tienen una alta transferencia de energía lineal (LET) y longitudes de recorrido cortas, lo que provoca DSB densos y localizados que activan las vías apoptótica y piroptótica. Los emisores de electrones Auger (por ejemplo, yodo-125 o indio-111) también producen DSB muy localizados debido a su corto alcance y a su alto LET.
Por el contrario, los emisores de partículas beta (por ejemplo, lutecio-177 o itrio-90) tienen LET más bajos e inducen principalmente daños indirectos en el ADN a través de la generación de especies reactivas de oxígeno (ROS), lo que provoca SSB o DSB y estrés oxidativo. Estas lesiones activan los mecanismos de reparación del ADN, como la reparación por escisión de bases (BER), la reparación por escisión de nucleótidos (NER), la unión de extremos no homólogos (NHEJ) y la recombinación homóloga (HR).
Sin embargo, las células cancerosas suelen mostrar una capacidad de reparación del ADN alterada, lo que las hace vulnerables a la citotoxicidad inducida por el radiofármaco. Para mejorar la eficacia terapéutica, se están explorando activamente estrategias combinadas que incluyan radiofármacos e inhibidores de la reparación del ADN, como los inhibidores de la poli (ADP-ribosa) polimerasa (PARP).
Examinamos la Colección de contenidos de CASTM, el mayor repositorio de información científica seleccionada por personas, para comprender mejor el panorama de la investigación en medicina nuclear, y descubrimos un crecimiento exponencial en el volumen de publicaciones en los últimos 20 años. Cabe destacar que la actividad de patentes aumentó significativamente después de 2020, alcanzando casi 800 patentes en 2024, lo que indica un incremento del interés comercial y la innovación en las tecnologías de medicina nuclear (véase la Figura 2).
En la actualidad, unos 67 radiofármacos han recibido la aprobación de la FDA, que comprenden 54 agentes de diagnóstico y 13 compuestos terapéuticos. Todos los radiofármacos terapéuticos actualmente aprobados están destinados al tratamiento del cáncer (véase la Figura 3).
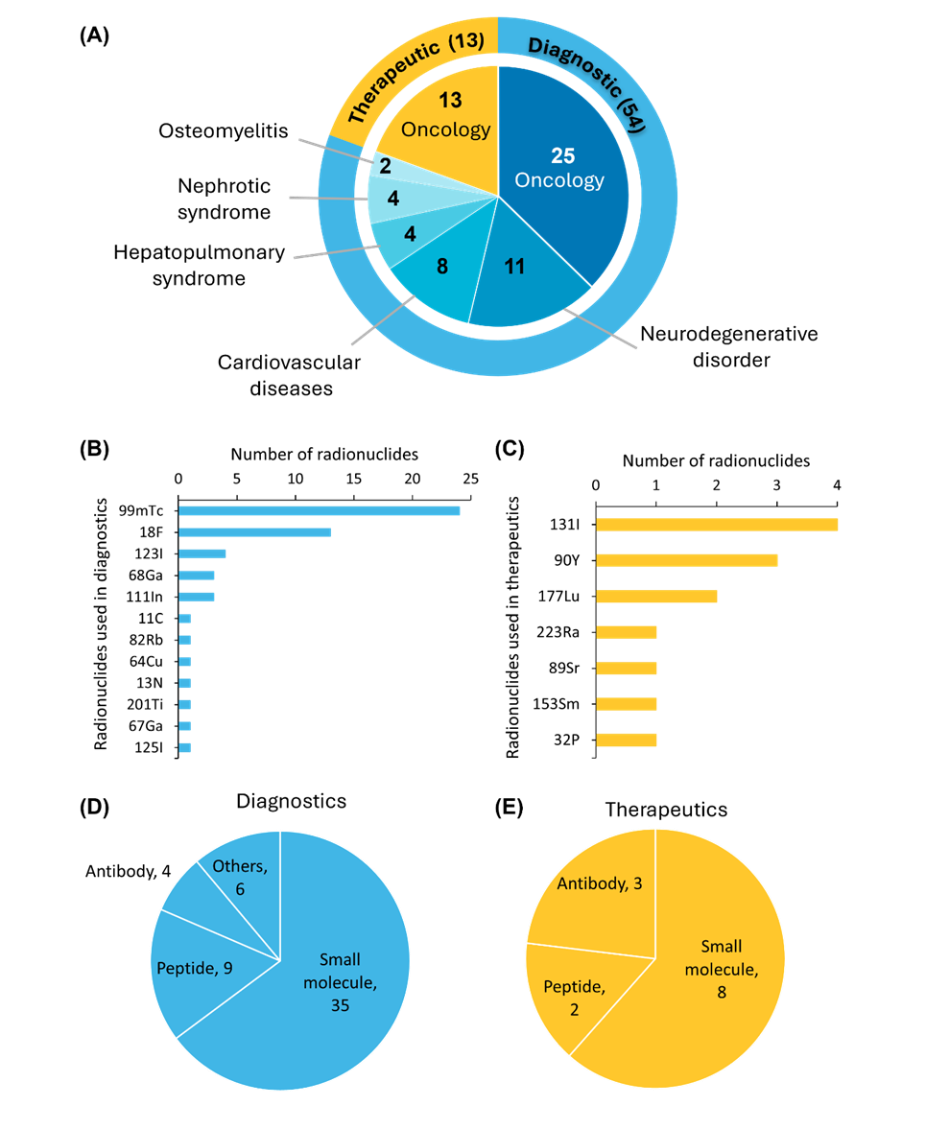
Entre los radiofármacos aprobados por la FDA, el tecnecio-99m (⁹⁹mTc) es el radionúclido más utilizado para la imagen diagnóstica, mientras que el yodo-131 (¹³¹I) sigue siendo la opción principal para aplicaciones terapéuticas. En cuanto a los vectores de direccionamiento, las moléculas pequeñas son las más utilizadas, debido a su farmacocinética favorable y a su facilidad de desarrollo.
Los agentes basados en péptidos también han adquirido una relevancia clínica significativa, tras la aprobación por parte de la FDA de [68Ga]/[177Lu]Ga-DOTA-TATE para el diagnóstico y tratamiento de tumores neuroendocrinos. Los radiofármacos basados en anticuerpos también desempeñan un papel crucial, ya que ofrecen una alta afinidad de unión in vivo que mejora la precisión de las imágenes y la eficacia terapéutica. Asimismo, un grupo más pequeño de agentes aprobados incluye radiofármacos a base de proteínas y albúmina sérica.
Últimos avances en medicina nuclear
Las innovaciones importantes en radiofármacos, modalidades de imagen, segmentación molecular y producción de isótopos han impulsado la evolución de la medicina nuclear. En el breve periodo comprendido entre 2020 y 2024, por ejemplo, el número de radiofármacos en investigación aumentó de forma considerable, pasando de unos 40 a casi 170. Es probable que esta rápida expansión se deba a las aprobaciones regulatorias y el éxito comercial de agentes pioneros como Lutathera ® ([177Lu ]Lu-DOTA-TATE), para el tratamiento de los tumores neuroendocrinos, y Pluvicto ® ([177Lu ]Lu-PSMA-617), para el cáncer de próstata metastásico positivo para PSMA, los cuales han establecido nuevos estándares en la terapia con radioligandos dirigidos.
Algunos de los principales campos son:
- Teranóstica: en este campo dinámico, uno de los avances más importantes de los últimos años ha sido el desarrollo de los radiofármacos teranósticos, que son compuestos radiofarmacéuticos similares utilizados para el diagnóstico y el tratamiento. Por ejemplo, los ligandos del antígeno de membrana prostática específico (PSMA) aprobados recientemente por la FDA y marcados con galio-68 (Locametz) se pueden utilizar para detectar el cáncer de próstata mediante imágenes de PET. Los mismos ligandos del PSMA, cuando se etiquetan con lutecio-177 (Pluvicto), pueden administrar radioterapia dirigida para tratar el cáncer. Este método representa la cúspide de la medicina de precisión, ya que permite a los profesionales de la salud identificar las ubicaciones de la enfermedad con una precisión excepcional y luego administrar radioterapia directamente a esos mismos objetivos, preservando los tejidos sanos.
- Terapia alfa dirigida: las partículas alfa, núcleos de helio compuestos de dos protones y dos neutrones, muestran una alta LET y una penetración limitada en el tejido (50–100 μm), lo que las hace ideales para administrar dosis letales de radiación a células cancerosas individuales mientras se minimiza el daño al tejido sano circundante. Esta propiedad sustenta la eficacia de la terapia alfa dirigida (TAT), un avance en la oncología de precisión.
Inicialmente ejemplificado por ²²³Ra-dicloruro (Xofigo®), la TAT se ha expandido para incluir agentes como ²²⁵Ac-PSMA-617, que ha mostrado resultados clínicos notables en el cáncer de próstata metastásico resistente a la castración (mCRPC), con el 91 % de los pacientes experimentando una disminución en los niveles de antígeno prostático específico (PSA) y una supervivencia media de 15 meses. Los avances en la producción de isótopos ahora facilitan la fabricación a gran escala y el desarrollo de nuevos emisores alfa como ²¹²Pb. Los ensayos clínicos están explorando una gama de tratamientos emisores de alfa para varios tipos de cáncer, incluido el ensayo RYZ101 de fase III de RayzeBio para los tumores neuroendocrinos gastroenteropancreáticos.
Las innovaciones tecnológicas están aumentando aún más el potencial de la TAT. Estos incluyen anticuerpos biespecíficos, mejoras químicas de conjugación y estrategias combinadas con inmunoterapias e inhibidores de la respuesta al daño del ADN. En conjunto, estos avances posicionan a la TAT como un método transformador capaz de superar la resistencia a las radioterapias tradicionales emisoras de partículas beta.
- Portadores de próxima generación: las moléculas portadoras de próxima generación en medicina nuclear se refieren a las plataformas avanzadas de entrega que mejoran la especificidad de objetivos, la farmacocinética y la funcionalidad multimodal. La investigación reciente se ha centrado en los péptidos bicíclicos como alternativas prometedoras a los portadores tradicionales, ya que ofrecen afinidades similares a los anticuerpos (rango nanomolar) con una penetración superior en los tejidos y una rápida eliminación renal, ejemplificado por el BCY18469 dirigido a EphA2, que demostró una alta captación tumoral (19,5 ± 3,5 %ID/g a 1 h) y un excelente contraste de imagen ya cinco minutos después de la inyección.
Las nanopartículas ultrapequeñas (<10 nm) han alcanzado la traducción clínica, con puntos de Cornell en ensayos clínicos para la obtención de imágenes duales PET/ópticas de diferentes neoplasias malignas. El campo avanza hacia las proteínas alternativas de andamiaje, como DARPins (proteínas repetidas de anquirina diseñadas), afibodies y nanocuerpos que ofrecen mayor estabilidad bajo condiciones de radiomarcado severas (hasta 95 °C, pH 3,6-11,0) mientras se mantiene una alta afinidad con el objetivo, junto con nanotransportadores modulares capaces de una entrega inteligente y gradual a compartimentos celulares específicos.
Estas innovaciones tienen en cuenta retos clave de la medicina nuclear al reducir la toxicidad fuera del objetivo, ampliar el tiempo de circulación para una acumulación óptima del tumor y permitir la combinación de estrategias de segmentación activa-pasiva. También facilitan el desarrollo de agentes teranósticos que puedan proporcionar imágenes diagnósticas e intervención terapéutica en una única plataforma, lo que convierte a los portadores de próxima generación en herramientas transformadoras para la medicina de precisión personalizada.
- Terapia de primera línea para la enfermedad en fase inicial: aunque la medicina nuclear ha experimentado un importante crecimiento clínico en los últimos años, tradicionalmente se ha reservado como tratamiento paliativo de último recurso para los pacientes con cáncer avanzado. Este paradigma ahora está cambiando drásticamente con las investigaciones clínicas activas. Por ejemplo, el receptor de somatostatina 2 (SSTR2) y las terapias radiofarmacéuticas dirigidas a PSMA muestran potencial en enfermedades en estadios más tempranos. Debemos resaltar que [¹⁷⁷Lu]Lu-DOTA-TATE demostró mejoras estadísticamente significativas y clínicamente relevantes en la supervivencia sin progresión cuando se utilizó como terapia inicial para tumores neuroendocrinos gastroenteropancreáticos avanzados.
Al mismo tiempo, los compuestos dirigidos al PSMA marcados con LU se están sometiendo a exhaustivos ensayos clínicos en varios escenarios de cáncer de próstata, incluida la enfermedad metastásica resistente a la castración sin tratamiento previo, el cáncer metastásico sensible a las hormonas, la enfermedad oligometastásica o bioquímicamente recurrente y los casos locorregionales avanzados o de alto riesgo. Esta expansión desde los cuidados paliativos en fase terminal hasta la intervención terapéutica de línea temprana representa una transformación fundamental en cómo los radiofármacos se integran en las estrategias integrales de tratamiento del cáncer, ofreciendo potencialmente a los pacientes resultados más efectivos cuando su enfermedad aún está en fases más tempranas y tratables.
- La IA en las terapias radiofarmacéuticas personalizadas: los modelos de IA facilitan la reconstrucción y el refinamiento de las imágenes, la detección automatizada de lesiones y la identificación de órganos y tumores, lo que permite realizar cálculos dosimétricos personalizados. Esta integración tiene como objetivo hacer realidad la personalización rutinaria y fiable de las terapias radiofarmacéuticas, lo que mejora la eficacia del tratamiento y los resultados de los pacientes.
Podemos observar cómo estas innovaciones se están abriendo paso en el proceso regulatorio y se acercan a su aplicación clínica. La Figura 4 clasifica los fármacos en investigación en Fase I, II y III, con cada segmento codificado por colores para representar su uso previsto: diagnóstico, terapéutico o teranóstico. Los datos revelan que los agentes anticancerígenos son los más numerosos en todas las fases, especialmente en la fase I, que incluye 32 fármacos. Esta tendencia refleja el creciente énfasis en la terapia dirigida con radionúclidos y la teranóstica en oncología, en línea con la bibliografía reciente que destaca el cambio hacia estrategias de tratamiento personalizadas mediante radiofármacos. También están representadas otras áreas de enfermedad, aunque en menor medida, lo que indica una expansión de aplicaciones más allá del cáncer.
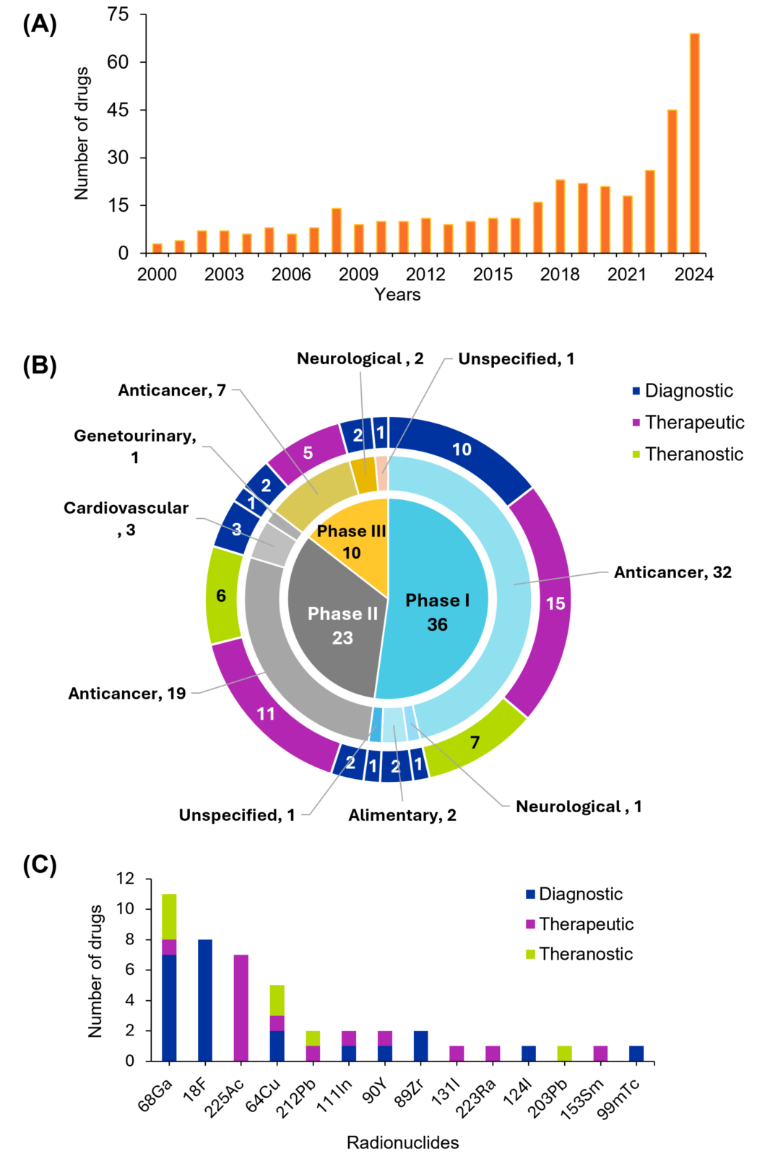
Un análisis de los ensayos clínicos subraya la prominencia del galio-68 (⁶⁸Ga) y el flúor-18 (¹⁸F) en las aplicaciones diagnósticas, lo que refleja su uso generalizado en la obtención de imágenes por PET debido a sus semividas favorables y a sus propiedades de emisión de positrones. En aplicaciones terapéuticas, el actinio-225 (²²⁵Ac) es el líder, conocido por sus propiedades emisoras alfa, ideal para la radioterapia dirigida. Los radionúclidos como el cobre-64 (⁶⁴Cu) y el plomo-212 (²¹²Pb) muestran un potencial de doble uso, apoyando el creciente paradigma teranóstico que integra la imagen y la terapia.
Trasladar la medicina nuclear del concepto a la práctica clínica
Incorporar la medicina nuclear a la práctica clínica implica varios desafíos, especialmente su alto coste y la limitada disponibilidad de isótopos médicos. También hay una escasez de profesionales formados en medicina nuclear y radiofarmacéuticos, así como limitaciones de infraestructura que restringen el acceso a imágenes y terapias avanzadas. Esto es más pronunciado en los países con ingresos bajos.
La ampliación de las reservas de isótopos, el aumento de la mano de obra y la mejora del acceso a la atención sanitaria son cuestiones a largo plazo que requerirán recursos específicos para su resolución. Sin embargo, el futuro podría ser prometedor, dado el nivel de inversión y el crecimiento previsto en este campo.
El sector de la medicina nuclear experimentó un crecimiento notable en 2024, impulsado por un auge en la inversión de capital y la consolidación estratégica. Según PitchBook, la inversión total en este campo se disparó hasta alcanzar los 14 860 millones de dólares, más del triple de la inversión de 2023. Este impulso se vio aún más amplificado por una ola de adquisiciones de alto perfil a medida que las principales empresas farmacéuticas se movilizaron rápidamente para fortalecer sus posiciones en este mercado en expansión, como la adquisición de Fusion Pharmaceuticals por parte de AstraZeneca por 2400 millones de dólares para trabajar con las terapias alfa dirigidas.
Aún quedan obstáculos para una aplicación más amplia de la teranóstica y la medicina nuclear, pero cada vez hay más innovaciones que nos acercan más al método «verlo y tratarlo» en el caso del cáncer y otras enfermedades debilitantes.
Caso práctico relacionado: el desarrollo de nuevas capacidades para proteger los medicamentos asequibles y de calidad - Vea cómo Sandoz se asoció con CAS para desarrollar capacidades personalizadas de investigación y desarrollo que proporcionen medicamentos asequibles y de alta calidad para los pacientes de todo el mundo.
Lea el caso práctico.