如果医生能够在发现癌症的那一刻就开始治疗会怎么样?随着诊疗一体化(“治疗”加上“诊断”)的最新发展,“发现并治疗”的方法正在逐步接近临床使用。它依赖于核医学,而核医学正在通过对复杂疾病进行高度靶向治疗来改变医疗保健。
核医学在过去以其诊断能力著称,但现在它正通过创新将相同的分子制剂用于成像和治疗,向治疗领域迈进。这一转变正在重新定义临床医生处理癌症、心血管和神经系统疾病的方式,提供更个性化和更有效的治疗策略。
开发结合诊断和治疗功能的诊疗一体化制剂需要对靶向机制、成像属性和治疗效果进行综合分析。药物发现团队在研究诊疗一体化平台时,可以使用 CAS BioFinder 访问互联的生物学和化学数据,这些数据支持评估靶点-配体相互作用、生物分布特征以及诊断-治疗联合方法的安全性考虑。
了解更多。核医学的基础构成
核医学治疗的核心是放射性药物——这些化合物结合放射性同位素(放射性核素)和载体分子,以提供成像或治疗的靶向辐射。这些药物通常用螯合剂稳定,以确保在体内安全有效地运输(见图 1)。
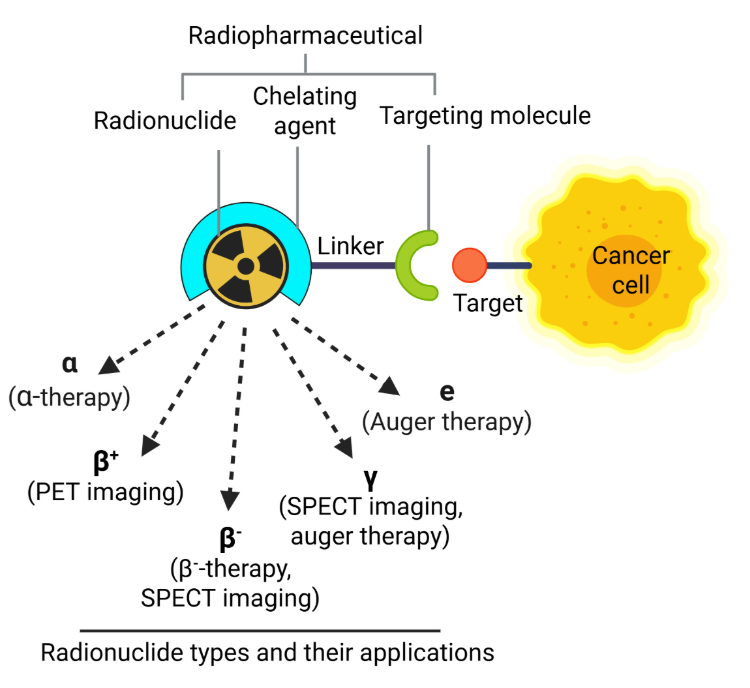
根据这些制剂的发射性质,它们可以在 PET 扫描(正电子发射断层扫描)和 SPECT 扫描(单光子发射计算机断层扫描)中用于诊断,或用于通过诱导 DNA 损伤来破坏病变细胞的治疗。这种损伤包括单链断裂 (SSBs) 和双链断裂 (DSBs),其程度和性质由所发射辐射的类型决定。
α 粒子发射体(如镭-223、锕-225、砹-211)具有高线性能量转移 (LET) 和短路径长度的特点,可造成密集的局部双链断裂,从而激活细胞凋亡和焦亡途径。俄歇电子发射体(如碘-125、铟-111)也会因其短程和高线性能量转移而产生高度局部化的双链断裂。
相比之下,β 粒子发射体(如镥-177、钇-90)的线性能量转移较低,主要通过产生活性氧 (ROS) 间接诱导 DNA 损伤,导致单链断裂或双链断裂以及氧化应激。这些病变可激活 DNA 修复机制,如碱基切除修复 (BER)、核苷酸切除修复 (NER)、非同源末端连接 (NHEJ) 和同源重组 (HR)。
然而,癌细胞的 DNA 修复能力通常会受损,因此很容易受到放射性药物诱导的细胞毒性的影响。为了提高治疗效果,研究人员正在积极探索涉及放射性药物和 DNA 修复抑制剂(如 Poly(ADP-ribose) polymerase (PARP) 抑制剂)的组合策略。
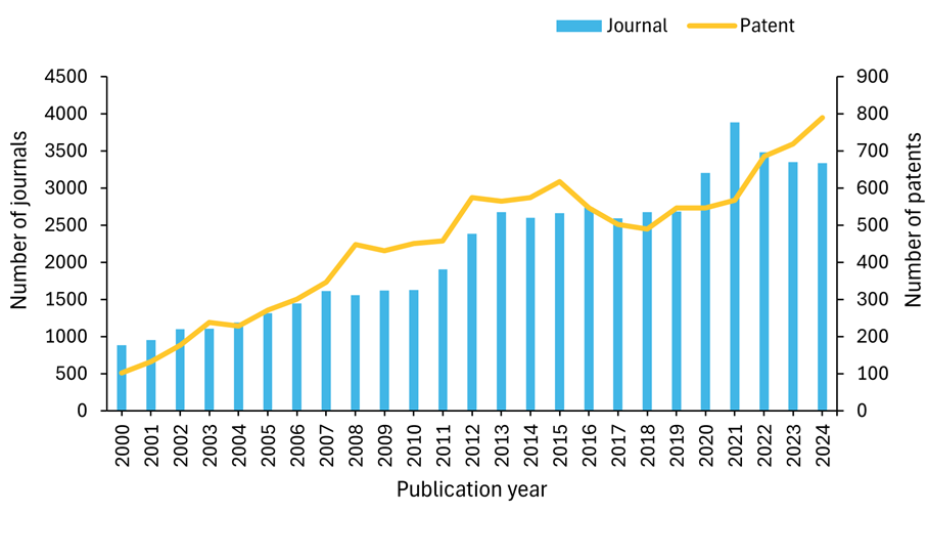
我们研究了全球最大的人工收录科学信息库 CAS 内容合集TM,以更好地了解核医学领域的研究布局。我们发现过去 20 年间出版物数量呈指数级增长。值得注意的是,2020 年之后专利活动显著增加,到 2024 年专利数量达到近 800 项,这表明核医学技术领域的商业兴趣和创新均有增长(见图 2)。
目前,约有 67 种放射性药物获得了 FDA 批准,其中包括 54 种诊断药物和 13 种治疗药物。目前批准的所有治疗性放射性药物都用于癌症治疗(见图 3)。
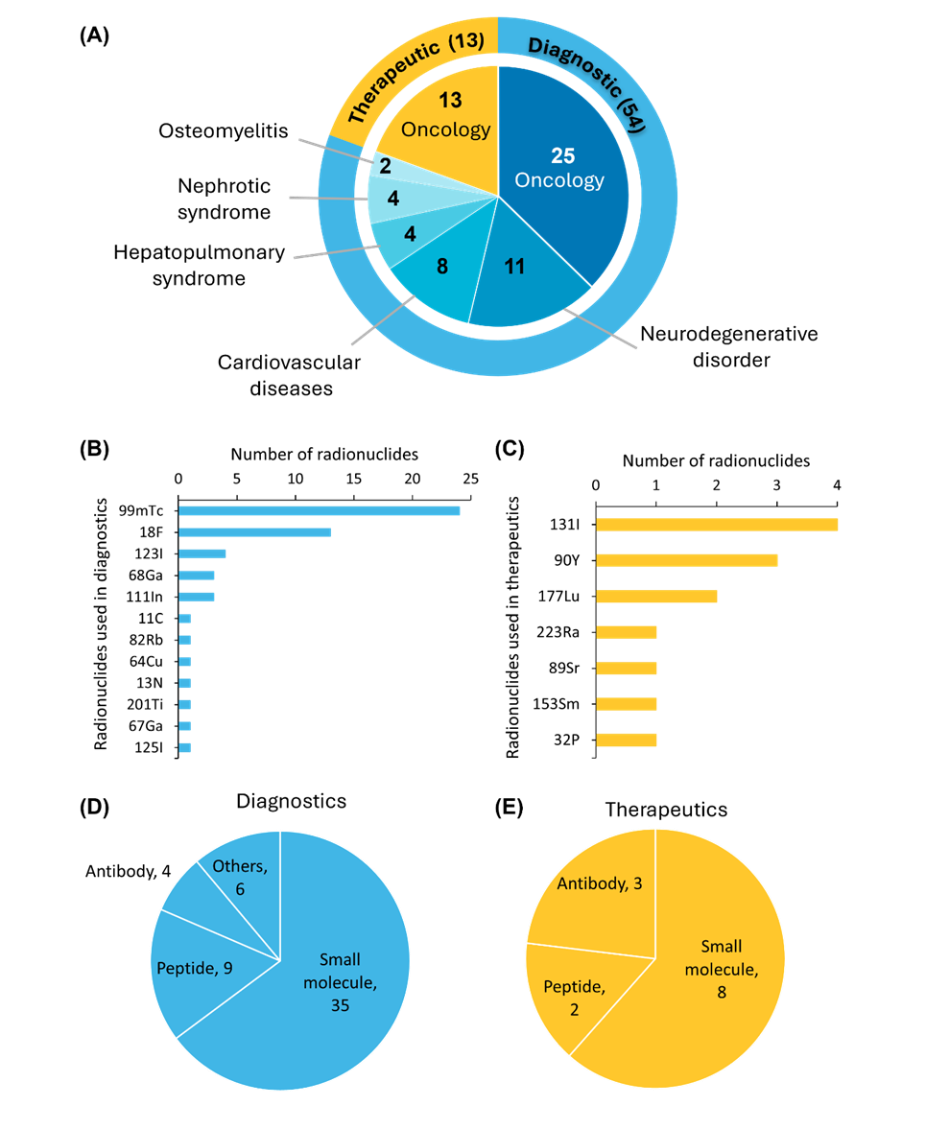
在 FDA 批准的放射性药物中,锝-99m (⁹⁹ᵐTc) 是诊断成像中最常用的放射性核素,而碘-131 (¹³¹I) 仍然是治疗应用的首选。在靶向载体方面,小分子因具有良好的药代动力学特性和易于开发而最为常用。
在 FDA 批准 [68Ga]/[177Lu]Ga-DOTA-TATE 用于诊断和治疗神经内分泌肿瘤后,肽类药物也获得了重要的临床意义。基于抗体的放射性药物也发挥着至关重要的作用,它们具有很高的体内结合亲和力,可以提高成像精度和治疗效果。此外,一小类获批药物包括基于蛋白质和血清白蛋白的放射性药物。
核医学最新突破
放射性药物、成像模态、分子靶向和同位素生产等领域的重大创新推动了核医学的发展。例如,在 2020 年至 2024 年这一短暂时期,试验性放射性药物数量显著增加,从约 40 种增加到了近 170 种。这种快速增长很可能是由监管批准和开创性药物取得的商业成功所驱动的,例如 Lutathera® ([177Lu]Lu-DOTA-TATE) 用于治疗神经内分泌肿瘤和 Pluvicto® ([177Lu]Lu-PSMA-617) 用于治疗 PSMA 阳性转移性前列腺癌,这两种药物都在靶向放射性配体治疗方面树立了新的标准。
值得注意的领域包括:
- 诊疗一体化:在这个充满活力的领域中,近年来最重大的突破之一是诊疗一体化放射性药物的开发,这些药物是用于诊断和治疗的类似放射性药物化合物。例如,最近经 FDA 批准的用镓-68 (Locametz) 标记的前列腺特异性膜抗原 (PSMA) 配体可以通过 PET 成像来检测前列腺癌。同样的 PSMA 配体在用镥-177 (Pluvicto) 标记后,可以提供治疗癌症的靶向放射治疗。这种方法代表了精准医疗的巅峰,使临床医生能够以极高的准确度识别病灶部位,然后将放射治疗直接应用于这些靶点,同时保护健康组织。
- 靶向 α 疗法:α 粒子(即由两个质子和两个中子组成的氦核)具有高线性能量转移和有限的组织穿透力(50–100 微米),非常适合向单个癌细胞投放致命辐射剂量,同时最大限度地减少对周围健康组织的损伤。这一性质是靶向 α 治疗 (TAT) 有效性的基础,也是精准肿瘤学领域的一项突破。
TAT最初以 ²²³Ra-dichloride (Xofigo®) 为例,现在已扩展到 ²²⁵Ac-PSMA-617 等药物,这种药物在转移性抗阉割前列腺癌 (mCRPC) 中显示出显著的临床疗效,91% 的患者前列腺特异性抗原 (PSA) 水平下降,中位生存期为 15 个月。同位素生产技术的进步现在支持大规模生产和开发新型 α 发射体,如 ²¹²Pb。临床试验正在探索多种 α-发射疗法,涵盖多种癌症类型,包括 RayzeBio 公司针对胃肠胰神经内分泌肿瘤的 III 期 RYZ101 试验。
技术创新正在进一步提升 TAT 的潜力。其中包括双特异性抗体、改进的共轭化学物质,以及与免疫疗法和 DNA 损伤反应抑制剂的组合策略。这些发展共同将 TAT 定位为一种变革性方法,能够克服传统 β 射线放射性治疗的耐药性。
- 下一代载体:核医学中的下一代载体分子指高级的递送平台,这些平台能够增强靶向特异性、药代动力学和多模式功能。最近的研究重点是双环肽,它们是前景广阔的传统载体替代品,具有类似抗体的亲和力(纳摩尔范围)、卓越的组织穿透性和快速的肾脏清除能力,以 EphA2 靶向药物 BCY18469 为例,该药物在注射后 5 分钟就显示出很高的肿瘤摄取率(1 小时后为 19.5 ± 3.5%ID/g)和出色的成像对比度。
超小型纳米粒子 (<10 nm) 已实现临床转化,康奈尔点正在进行不同恶性肿瘤的 PET/光学双重成像临床试验。该领域正朝着替代支架蛋白的方向发展,包括 DARPins (设计的 ankyrin 重复蛋白)、亲和体和纳米抗体,它们在苛刻的放射性标记条件下(高达 95°C,pH 值 3.6-11.0)具有更高的稳定性,同时保持高靶向亲和力,此外模块化纳米转运体还能智能和有节奏地递送到特定细胞区。
这些创新降低了脱靶毒性,延长了循环时间以获得最佳的肿瘤积累效果,并实现了主动-被动靶向策略的结合,从而解决了核医学中的关键难题。它们还有助于开发可在单一平台上提供诊断成像和治疗干预的诊疗一体化制剂,使下一代载体成为个性化精准医疗的变革性工具。
- 早期疾病的早期治疗:虽然核医学近年来在临床上取得了长足的发展,但传统上它一直是晚期癌症患者最后的姑息治疗手段。随着临床研究的积极开展,这种模式正在发生巨大变化。例如,生长抑素受体 2 (SSTR2) 和 PSMA 靶向放射性药物治疗在早期疾病中显示出前景。值得注意的是,[¹⁷⁷Lu]Lu-DOTA-TATE 在用作晚期胃肠胰神经内分泌肿瘤的初始疗法时,对无进展生存期的改善具有显著的统计学意义和临床意义。
与此同时,¹⁷⁷Lu 标记的 PSMA 靶向化合物正在多种前列腺癌情境下进行广泛的临床测试,包括未治疗的转移性去势抵抗性疾病、转移性激素敏感性癌症、少转移性或生化复发性疾病,以及局部晚期或高风险病例。从晚期姑息治疗到早期治疗干预的扩展,标志着放射性药物融入癌症综合治疗策略的根本性转变,这有可能在患者的疾病仍处于更早、更可治疗的阶段时,为他们提供更有效的治疗结果。
- 人工智能在个性化放射性药物治疗中的应用:人工智能模型有助于图像重建和完善、病变自动检测以及器官/肿瘤识别,从而实现个性化剂量学计算。这种整合旨在实现常规和可靠的放射性药物个性化治疗,提高治疗效果和患者预后。
我们可以看到这些创新是如何一步步通过监管程序并逐渐走向临床应用的。图 4 将研究药物分为 I 期、II 期和 III 期,每个阶段采用不同的颜色编码来表示其预期用途:诊断、治疗或诊疗一体。数据显示,抗癌药物在所有阶段都占主导地位,尤其是在 I 期,其中包括 32 种药物。这一趋势反映了肿瘤学中对靶向放射性核素治疗和诊疗一体化的日益重视,与近期文献中强调的使用放射性药物进行个性化治疗策略的转变相一致。其他疾病领域也有所体现,但程度较轻,这表明癌症以外的应用也在不断扩大。
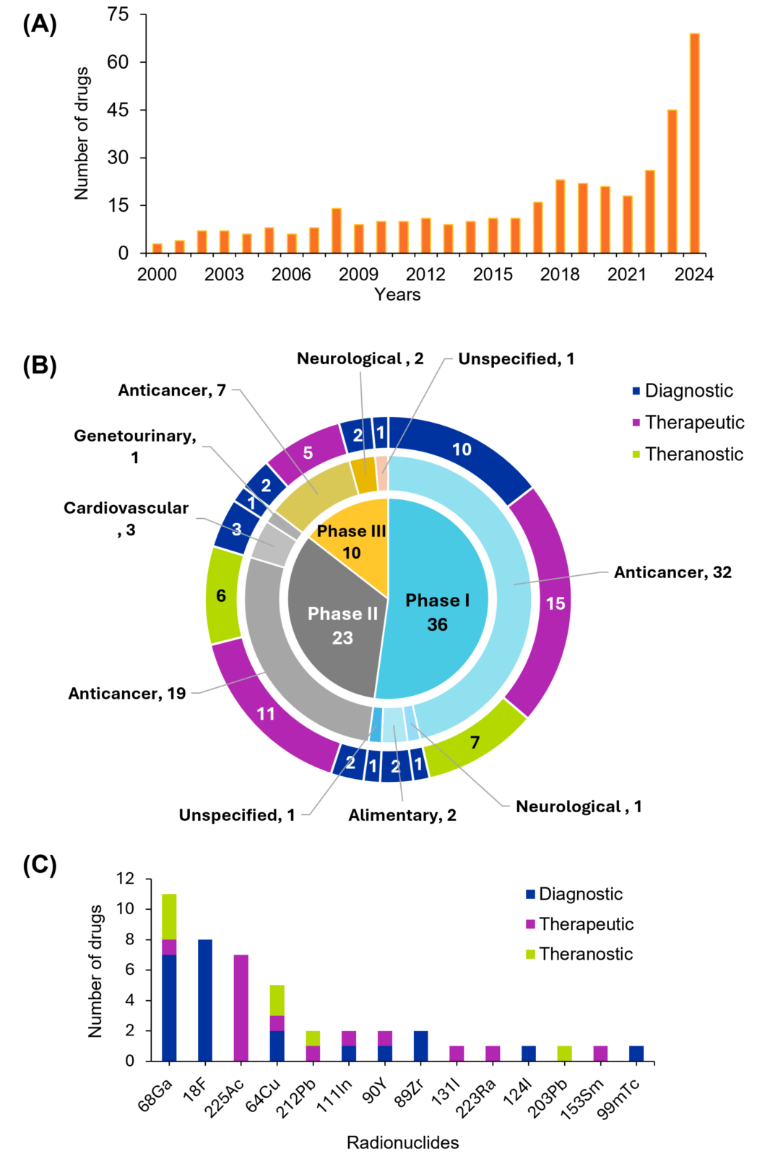
对临床试验的分析强调了镓-68(⁶⁸Ga)和氟-18(¹⁸F)在诊断应用中的突出地位,这反映了它们因良好的半衰期和正电子发射特性而在 PET 成像中得到了广泛应用。在治疗应用中,锕-225 (²²⁵Ac) 因其 α 发射特性而闻名,是靶向放射治疗的理想选择。铜-64 (⁶⁴Cu) 和铅-212 (²¹²Pb) 等放射性核素展现出双重用途潜力,为日益增长的整合成像和治疗的诊疗一体化模式提供了支持。
将核医学从概念推向临床
将核医学引入临床实践面临诸多挑战,特别是其成本高昂和医用同位素供应有限。此外,训练有素的核医学专业人员和放射药剂师的短缺,以及基础设施的限制也制约了先进影像和治疗技术的普及。这种情况在低收入国家尤为明显。
扩充同位素储备、壮大人员队伍、提高医疗服务的可及性,这些都是需要专门资源才能解决的长期问题。不过,鉴于该领域的投资水平和预期增长,未来的前景还是很乐观的。
在资本投资激增和战略整合的推动下,核医学领域在 2024 年实现了显著增长。根据 PitchBook 的数据,该领域的总投资额飙升至 148.6 亿美元,是 2023 年投资额的三倍多。这一势头因一系列引人注目的收购而进一步增强,各大制药公司迅速采取行动,巩固其在不断扩大的市场中的地位,例如 AstraZeneca 斥资 24 亿美元收购 Fusion Pharmaceuticals,以推进靶向 α 治疗。
诊疗一体化和核医学的更广泛应用仍存在障碍,但更多的创新正使我们越来越接近于实现“发现并治疗”,以应对癌症和其他衰弱性疾病。
相关案例研究:构建新能力,确保药品价格合理、质量上乘——了解 Sandoz 如何与 CAS 合作构建定制化的研发能力,为全球患者提供价格合理、质量上乘的药品。
阅读案例研究。