E se os médicos pudessem começar a tratar o câncer no mesmo instante em que o detectassem? Com os recentes avanços em teranóstica (a combinação de "terapia" e "diagnóstico"), essa abordagem de "ver e tratar" está se aproximando do uso clínico. Baseia-se na medicina nuclear, que está transformando a área da saúde ao possibilitar terapias altamente direcionadas para doenças complexas.
Embora tradicionalmente conhecida por suas capacidades de diagnóstico, a medicina nuclear está agora avançando para a área terapêutica por meio de inovações nas quais o mesmo agente molecular é utilizado para imagem e tratamento. Essa mudança está redefinindo a forma como os médicos abordam o câncer, as doenças cardiovasculares e neurológicas, oferecendo estratégias de tratamento mais personalizadas e eficazes.
O desenvolvimento de agentes teranósticos que combinem funções diagnósticas e terapêuticas exige uma análise integrada dos mecanismos de direcionamento, das propriedades de imagem e da eficácia terapêutica. As equipes de descoberta de fármacos que trabalham em plataformas teranósticas podem usar o CAS BioFinder™ para acessar dados interconectados de biologia e química que auxiliam na avaliação de interações alvo-ligante, perfis de biodistribuição e considerações de segurança para abordagens combinadas de diagnóstico e terapêutica.
Descubra mais.Os elementos básicos da medicina nuclear
No cerne das terapias de medicina nuclear estão os radiofármacos — compostos que combinam isótopos radioativos (radionuclídeos) com moléculas transportadoras para fornecer radiação direcionada para imagem ou terapia. Esses agentes são frequentemente estabilizados por quelantes para garantir um transporte seguro e eficaz dentro do corpo (ver Figura 1).
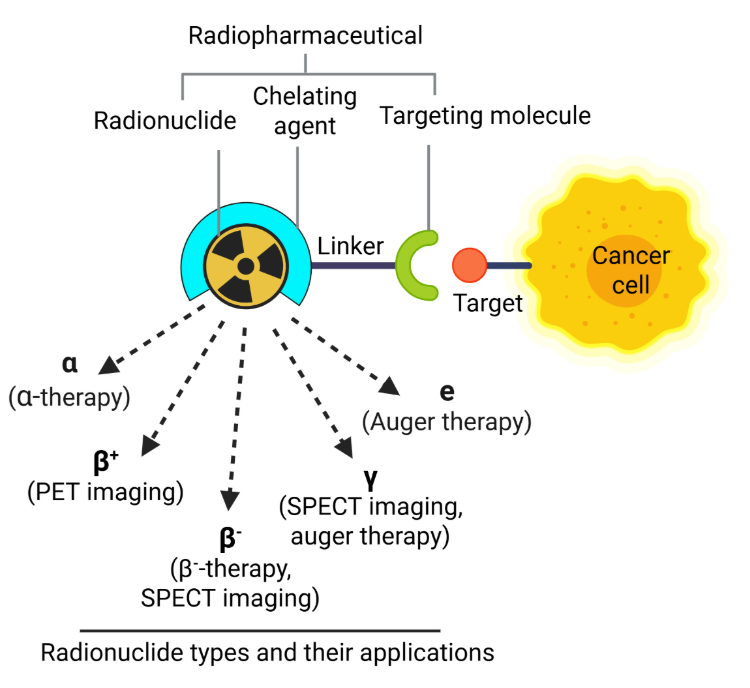
Dependendo de suas propriedades de emissão, esses agentes podem ser usados para diagnóstico em um PET scan (tomografia por emissão de pósitrons) e em um SPECT scan (tomografia computadorizada por emissão de fóton único) ou terapeuticamente para destruir células doentes induzindo danos ao DNA. Esse dano inclui quebras de fita única (SSBs) e quebras de fita dupla (DSBs), com a extensão e a natureza determinadas pelo tipo de radiação emitida.
Emissores de partículas alfa (por exemplo, rádio-223, actínio-225, astato-211) possuem alta transferência linear de energia (LET) e comprimentos de caminho curtos, causando quebras de fita dupla (DSBs) densas e localizadas que ativam vias apoptóticas e piroptóticas. Emissores de elétrons Auger (por exemplo, iodo-125, índio-111) também produzem quebras de fita dupla (DSBs) altamente localizadas devido ao seu curto alcance e alto LET.
Ao contrário, emissores de partículas beta (por exemplo, lutécio-177, ítio-90) apresentam menor LET e induzem principalmente danos indiretos ao DNA por meio da geração de espécies reativas de oxigênio (ROS), levando a SSBs ou DSBs e estresse oxidativo. Essas lesões ativam mecanismos de reparo de DNA, como reparo por excisão de base (BER), reparo por excisão de nucleotídeos (NER), união de extremidades não homólogas (NHEJ) e recombinação homóloga (HR).
No entanto, as células cancerígenas frequentemente apresentam capacidades prejudicadas de reparo do DNA, tornando-as vulneráveis à citotoxicidade induzida por radiofármacos. Para aumentar a eficácia terapêutica, estratégias combinadas envolvendo radiofármacos e inibidores de reparo de DNA, como os inibidores da poli(ADP-ribose) polimerase (PARP), estão sendo exploradas ativamente.
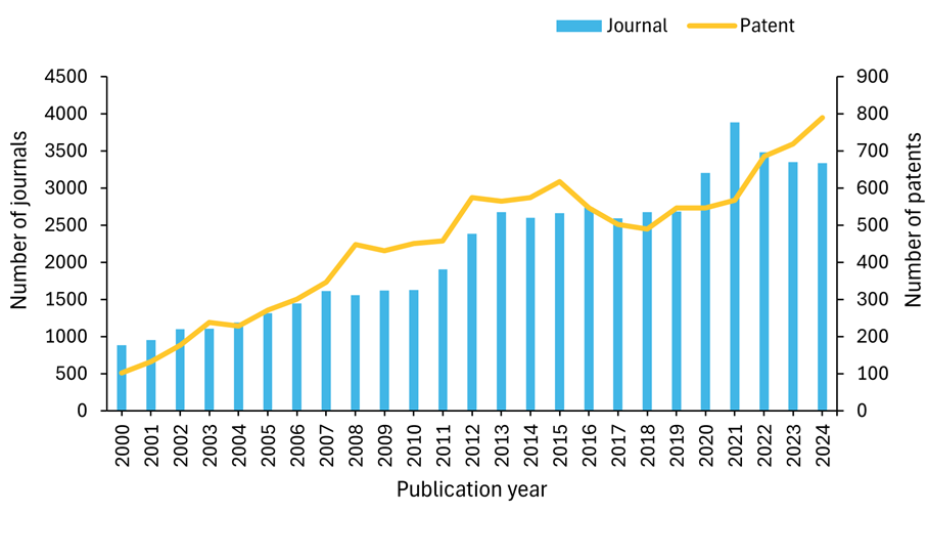
Examinamos a Coleção de Conteúdo do CASTM, o maior repositório de informações científicas com curadoria humana, para entender melhor o cenário de pesquisa em medicina nuclear, e constatamos um crescimento exponencial no volume de publicações nos últimos 20 anos. Notavelmente, a atividade de patentes aumentou significativamente após 2020, chegando a quase 800 patentes em 2024, sugerindo maior interesse comercial e inovação em tecnologias de medicina nuclear (ver Figura 2).
Atualmente, cerca de 67 radiofármacos receberam aprovação da FDA, compreendendo 54 agentes diagnósticos e 13 agentes terapêuticos. Todos os radiofármacos terapêuticos atualmente aprovados destinam-se ao tratamento do câncer (ver Figura 3).
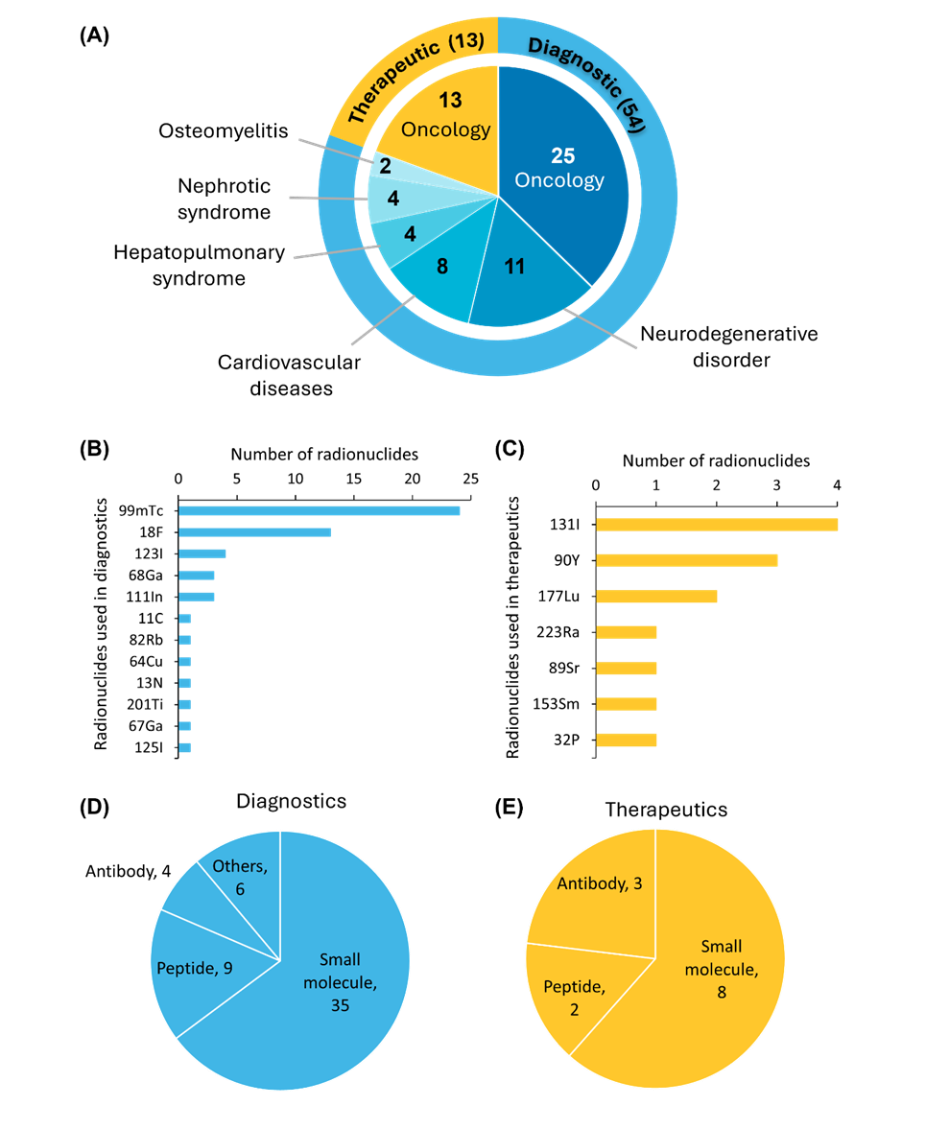
Entre os radiofármacos aprovados pela FDA, o tecnécio-99m (⁹⁹ᵐTc) é o radionuclídeo mais utilizado para imagem diagnóstica, enquanto o iodo-131 (¹³¹I) permanece a principal escolha para aplicações terapêuticas. Em termos de vetores de direcionamento, as pequenas moléculas são as mais utilizadas, devido à sua farmacocinética favorável e facilidade de desenvolvimento.
Os agentes à base de peptídeos também ganharam relevância clínica significativa, após a aprovação pela FDA do [68Ga]/[177Lu]Ga-DOTA-TATE para o diagnóstico e tratamento de tumores neuroendócrinos. Os radiofármacos à base de anticorpos também desempenham um papel crucial, oferecendo alta afinidade de ligação in vivo, o que aumenta a precisão das imagens e a eficácia terapêutica. Além disso, um grupo menor de agentes aprovados inclui radiofármacos à base de proteínas e albumina sérica.
Últimas descobertas importantes na medicina nuclear
Inovações significativas em radiofármacos, modalidades de imagem, direcionamento molecular e produção de isótopos impulsionaram a evolução da medicina nuclear. No breve período entre 2020 e 2024, por exemplo, o número de radiofármacos em fase de investigação aumentou significativamente, de cerca de 40 para quase 170. Essa rápida expansão provavelmente é impulsionada pelas aprovações regulatórias e pelo sucesso comercial de agentes pioneiros como o Lutathera® ([177Lu]Lu-DOTA-TATE) para o tratamento de tumores neuroendócrinos e o Pluvicto® ([177Lu]Lu-PSMA-617) para o câncer de próstata metastático positivo para PSMA, ambos estabelecendo novos padrões na terapia direcionada com radioligantes.
Campos de destaque incluem:
- Teranóstica: dentro deste campo dinâmico, uma das descobertas importantes dos últimos anos foi o desenvolvimento de radiofármacos teranósticos, que são compostos radiofarmacêuticos semelhantes usados para diagnóstico e tratamento. Por exemplo, ligantes de antígeno de membrana específico da próstata (PSMA) marcados com gálio-68 (Locametz) recentemente aprovados pela FDA podem ser usados para detectar câncer de próstata por meio de imagens por PET. Os mesmos ligantes PSMA, quando marcados com lutécio-177 (Pluvicto), podem fornecer radioterapia direcionada para tratar o câncer. Essa abordagem representa o auge da medicina de precisão, permitindo que os médicos identifiquem locais de doença com precisão excepcional e, depois, administrem radioterapia diretamente nesses mesmos alvos, poupando tecidos saudáveis.
- Terapia alfa direcionada: as partículas alfa, núcleos de hélio compostos por dois prótons e dois nêutrons, apresentam alta LET e penetração tecidual limitada (50 a 100 μm), tornando-as ideais para administrar doses letais de radiação a células cancerígenas individuais, minimizando os danos ao tecido saudável circundante. Essa propriedade é fundamental para a eficácia da terapia alfa direcionada (TAT), um avanço na oncologia de precisão.
Inicialmente exemplificado pelo ²²³Ra dicloreto (Xofigo®), a TAT se expandiu para incluir agentes como o ²²⁵Ac-PSMA-617, que apresentou resultados clínicos notáveis no câncer de próstata resistente à castração metastática (mCRPC), com 91% dos pacientes apresentando declínio nos níveis de antígeno específico da próstata (PSA) e sobrevivência mediana de 15 meses. Os avanços na produção de isótopos agora permitem a fabricação em larga escala e o desenvolvimento de novos emissores alfa, como o ²¹²Pb. Ensaios clínicos estão explorando uma gama de terapias emissoras de partículas alfa para diversos tipos de câncer, incluindo o ensaio clínico de Fase III da RayzeBio com o RYZ101 para tumores neuroendócrinos gastroenteropancreáticos.
As inovações tecnológicas estão reforçando ainda mais o potencial da TAT. Elas incluem anticorpos biespecíficos, químicas de conjugação aprimoradas e estratégias de combinação com imunoterapias e inibidores da resposta a danos no DNA. Em conjunto, esses avanços posicionam a TAT como uma abordagem transformadora capaz de superar a resistência às radioterapias tradicionais que emitem partículas beta.
- Transportadores de próxima geração: as moléculas transportadoras de próxima geração em medicina nuclear referem-se a plataformas de administração avançadas que melhoram a especificidade do alvo, a farmacocinética e a funcionalidade multimodal. Pesquisas recentes têm se concentrado em peptídeos bicíclicos como alternativas promissoras aos transportadores tradicionais, oferecendo afinidades semelhantes às de anticorpos (na faixa nanomolar) com penetração tecidual superior e rápida eliminação renal, exemplificada pelo BCY18469, que tem como alvo o EphA2 e demonstrou alta captação tumoral (19,5 ± 3,5 %ID/g em 1 h) e excelente contraste de imagens já cinco minutos após a injeção.
Nanopartículas ultrapequenas (<10 nm) alcançaram aplicação clínica, com os pontos de Cornell em ensaios clínicos para imagens duplas de PET/ópticas de diferentes tipos de câncer. O campo está avançando para proteínas alternativas de andaimes, incluindo DARPins (proteínas repetidas de anquirina projetadas), aficorpos e nanocorpos que oferecem maior estabilidade sob condições severas de radiomarcação (até 95 °C, pH de 3,6 a 11,0), mantendo alta afinidade com o alvo, juntamente com nanotransportadores modulares capazes de entrega inteligente e controlada a compartimentos celulares específicos.
Essas inovações enfrentam desafios críticos na medicina nuclear ao reduzir a toxicidade fora do alvo, prolongar o tempo de circulação para o acúmulo ideal em tumores e possibilitar a combinação de estratégias de direcionamento ativo-passivo. Elas também apoiam o desenvolvimento de agentes teranósticos, que podem fornecer imagens diagnósticas e intervenções terapêuticas em uma única plataforma, posicionando os transportadores de próxima geração como ferramentas transformadoras para a medicina de precisão personalizada.
- Terapia de primeira linha para doenças em estágio inicial: embora a medicina nuclear tenha experimentado um crescimento clínico significativo nos últimos anos, tradicionalmente ela tem sido reservada como um tratamento paliativo de último recurso para pacientes com câncer avançado. Esse paradigma está mudando drasticamente com as investigações clínicas em andamento. Por exemplo, as terapias radiofarmacêuticas direcionadas ao receptor de somatostatina 2 (SSTR2) e ao PSMA estão se mostrando promissoras em estágios iniciais da doença. Notavelmente, o [¹⁷⁷Lu]Lu-DOTA-TATE demonstrou melhorias estatisticamente significativas e clinicamente significativas na sobrevivência livre de progressão quando usado como terapia inicial para tumores neuroendócrinos gastroenteropancreáticos avançados.
Concomitantemente, compostos marcados com o ¹⁷⁷Lu direcionados ao PSMA estão passando por extensos testes clínicos em diversos cenários de câncer de próstata, incluindo doença metastática resistente à castração não tratada, câncer metastático sensível a hormônios, doença oligometastática ou bioquimicamente recorrente e casos avançados ou de alto risco localmente. Essa expansão do tratamento paliativo em estágio terminal para a intervenção terapêutica em linhas iniciais representa uma transformação fundamental na forma como os radiofármacos estão sendo integrados nas estratégias abrangentes de tratamento do câncer, podendo oferecer aos pacientes resultados mais eficazes quando sua doença ainda está em estágios mais precoces e tratáveis.
- IA em terapias radiofarmacêuticas personalizadas: os modelos de IA facilitam a reconstrução e o aprimoramento de imagens, a detecção automatizada de lesões e a identificação de órgãos/tumores, permitindo cálculos de dosimetria personalizados. Essa integração visa tornar a personalização rotineira e confiável de terapias radiofarmacêuticas uma realidade, aprimorando a eficácia do tratamento e os resultados para os pacientes.
Podemos ver como essas inovações estão avançando pelo processo regulatório e se aproximando da aplicação clínica. A Figura 4 categoriza os medicamentos experimentais nas Fases I, II e III, com cada segmento codificado por cores para representar o uso pretendido: diagnóstico, terapêutico ou teranóstico. Os dados revelam que os agentes anticâncer dominam todas as fases, particularmente na Fase I, que inclui 32 medicamentos. Essa tendência reflete a crescente ênfase na terapia direcionada com radionuclídeos e na teranóstica em oncologia, alinhando-se com a literatura recente que destaca a mudança em direção a estratégias de tratamento personalizadas usando radiofármacos. Outras áreas de doenças também estão representadas, embora em menor grau, indicando a expansão de aplicações além do câncer.
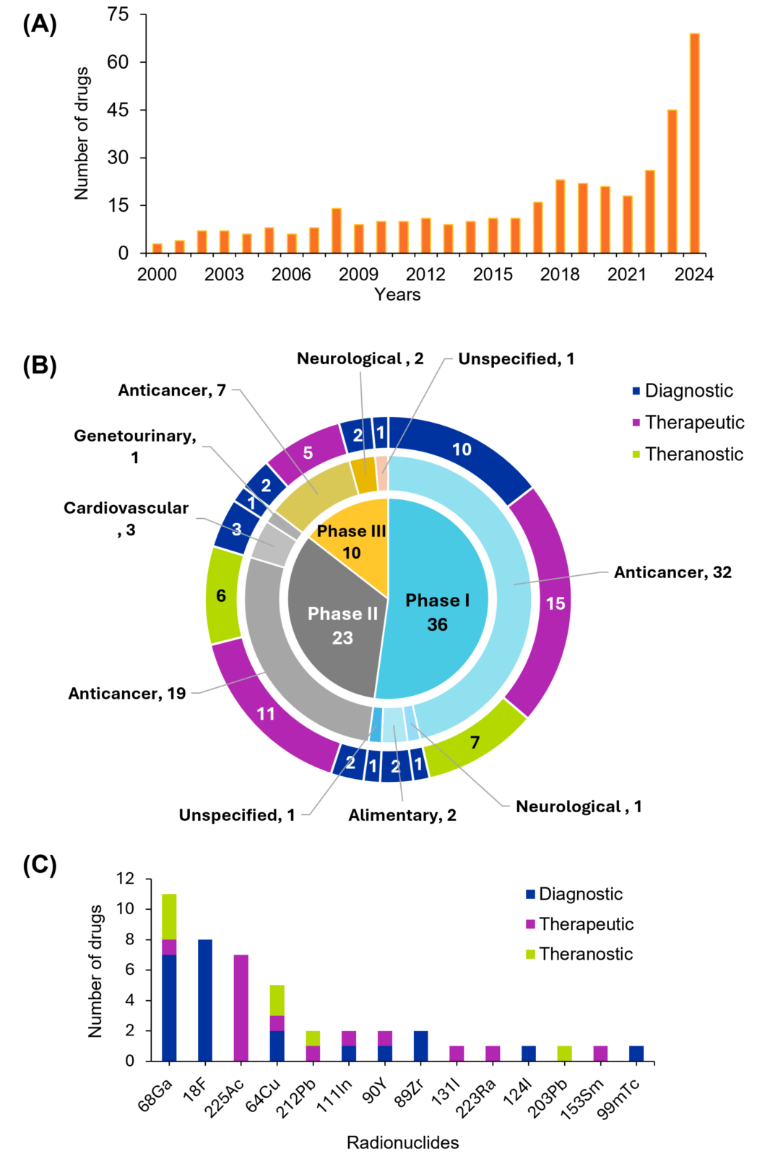
Uma análise dos ensaios clínicos destaca a proeminência do gálio-68 (⁶⁸Ga) e do flúor-18 (¹⁸F) em aplicações diagnósticas, refletindo seu uso generalizado em PET devido às meias-vidas favoráveis e propriedades de emissão de pósitrons. Em aplicações terapêuticas, o actínio-225 (²²⁵Ac) lidera, conhecido por suas propriedades de emissão alfa, sendo ideal para radioterapia direcionada. Radionuclídeos como o cobre-64 (⁶⁴Cu) e o chumbo-212 (²¹²Pb) apresentam potencial de uso duplo, apoiando o crescente paradigma teranóstico que integra imagem e terapia.
Levar a medicina nuclear do conceito à prática clínica
A introdução da medicina nuclear na prática clínica enfrenta vários desafios, particularmente seu alto custo e a disponibilidade limitada de isótopos médicos. Há também uma falta de profissionais treinados em medicina nuclear e radiofarmacêuticos, bem como limitações de infraestrutura que restringem o acesso a imagens e terapias avançadas. Isso é mais pronunciado em países de baixa renda.
Aumentar os estoques de isótopos, expandir a força de trabalho e melhorar o acesso aos cuidados de saúde são questões de longo prazo que exigirão recursos específicos para serem resolvidas. No entanto, o futuro pode ser promissor, dado o nível de investimento e o crescimento projetado nessa área.
O setor de medicina nuclear apresentou um crescimento notável em 2024, impulsionado por um aumento nos investimentos de capital e pela consolidação estratégica. Segundo a PitchBook, o investimento total no campo disparou para US$ 14,86 bilhões, mais que triplicando o valor investido em 2023. Esse impulso foi ainda mais amplificado por uma onda de aquisições de alta visibilidade, à medida que as principais empresas farmacêuticas agiram rapidamente para fortalecer suas posições no mercado em expansão, como a aquisição da Fusion Pharmaceuticals pela AstraZeneca por US$ 2,4 bilhões para avançar nas terapias alfa direcionadas.
Ainda há obstáculos para a aplicação mais ampla da teranóstica e da medicina nuclear, mas mais inovações estão nos aproximando cada vez mais do "ver e tratar" o câncer e outras doenças debilitantes.
Estudo de caso relacionado: desenvolvimento de novas capacidades para proteger medicamentos acessíveis e de qualidade - Veja como a Sandoz fez parceria com o CAS para desenvolver capacidades personalizadas de P&D que entregam medicamentos acessíveis e de alta qualidade para pacientes no mundo todo.
Leia o estudo de caso.