免疫療法は、患者自身の免疫システムを個別化されたがんと闘う武器へと巧妙に変換することで、がん治療における医学の最も有望なフロンティアのひとつです。正常な組織を温存しながら悪性細胞を除去することで、このタイプの治療は、効果と精度というがん治療成功の二本の柱を実現します。
免疫療法の初期の波はすでに腫瘍学に革命をもたらしましたが、現在、注目すべき革新、すなわち二重特異性T細胞エンゲージャー(Bi-TCE)が登場しています。これらの人工タンパク質は、おそらくこれまでで最も洗練された解決策です。がん細胞と免疫細胞を物理的に強制的に結合させる分子橋であり、がん細胞が逃れられない致命的な遭遇を作り出します。
構造的には、Bi-TCEは、柔軟なリンカーで接続された2つの単一鎖可変フラグメント(scFv)で構成されています。1つのscFVは腫瘍関連抗原(TAA)に結合し、もう1つはT細胞受容体複合体の主要構成要素であるCD3を標的とします。この二重特異性により、Bi-TCEはペプチド-MHC認識の必要性を回避し、あらゆるCD3発現T細胞を癌細胞と物理的に結合できるようになります。結合すると、Bi-TCEは強力な免疫学的カスケードを誘発し、T細胞を活性化して増殖を促進し、腫瘍細胞溶解を媒介するパーフォリンとグランザイムの放出を誘導します(図1参照)。この作用機序は血液悪性腫瘍に有効であることが証明されており、Bi-TCEは癌免疫療法の有望な最先端領域として位置づけられています。
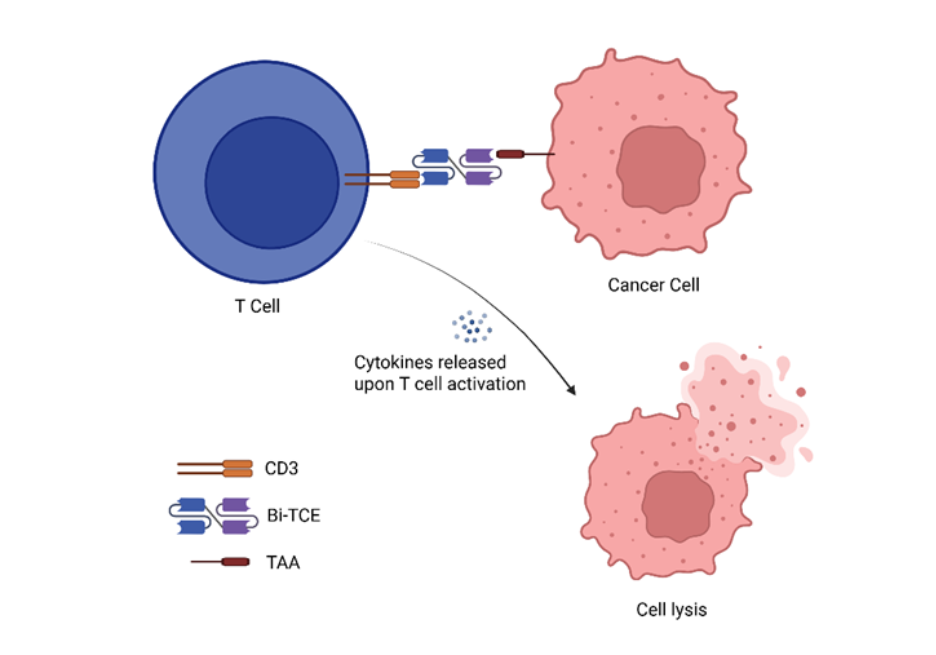
がん免疫療法における二重特異性T細胞エンゲージャー
Bi-TCEは、主流のがん免疫療法である CAR-Tと比べてどうでしょうか?主な違いの1つは、その製造方法です。CAR-T療法は患者自身のT細胞を遺伝子操作して開発されますが、Bi-TCEは哺乳類細胞株の抗体に含まれるタンパク質を操作して作られます。これにより、Bi-TCEは、個別のCAR-T療法よりも製造が容易な「既成」タイプの薬剤になります。
他にも重要な比較項目があり、表1にまとめています。
| 特長 | CAR-T細胞 | Bi-TCEs |
|---|---|---|
| 化学構造 | 的抗原結合ドメイン(scFv)、ヒンジ領域、膜貫通ドメイン、細胞内シグナル伝達ドメインを含む合成受容体を導入した患者由来T細胞 | 2つのscFv領域が連結された組換え抗体。一方のscFvはTAAを、もう一方のscFvはT細胞のTCR複合体の一部であるCD3を標的とする |
| T細胞の動員 | 能動的:改変されたT細胞を誘導し腫瘍細胞を殺傷させる | 受動的:内因性T細胞に依存し、それらを誘導して腫瘍細胞を殺傷させる |
| 細胞傷害作用の機序 | CAR T細胞からのパーフォリンおよびグランザイムBの放出 | Bi-TCEによって活性化された内因性T細胞からのパーフォリンおよびグランザイムBの放出 |
| 治療前のリンパ球除去治療 | 必須(フルダラビンやシクロホスファミドなどの薬剤) | 不要 |
| 半減期 | 長期(数週間から数か月) | 短期(数時間) - 繰り返しの注入が必要 |
| production | 患者のT細胞の体外での遺伝子操作 | 哺乳類細胞株由来の抗体のタンパク質工学 |
| 供給状況 | 患者ごとに個別に製造されるプロセス | 比較的単純な製造プロセスの「市販」薬 |
| 適応症 | 主に血液悪性腫瘍、固形腫瘍については早期臨床段階の開発が進行中 | 主に血液悪性腫瘍、固形腫瘍における初期結果から、CAR-Tと比較してBi-TCEが固形腫瘍において若干の優位性を持つ可能性が示唆されている |
出版動向はがん研究とそれ以外の分野での機会の増加を示している
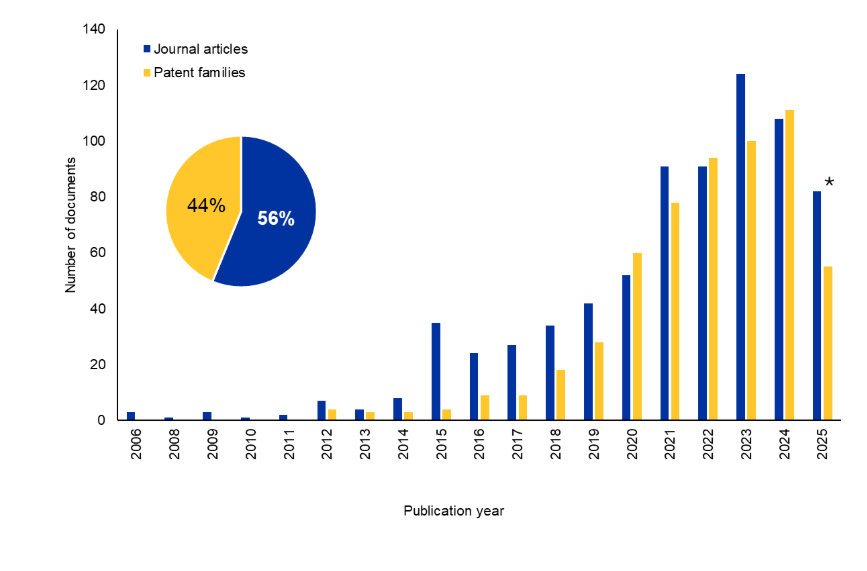
当社は、Bi-TCEの研究環境をより深く理解するために、人間ががキュレーションした世界最大規模の科学情報のリポジトリであるCASコンテンツコレクションTMを調査しました。過去10年間で、ジャーナルおよび特許文献の数は大幅に増加しました。興味深いことに、特許は文書総数の44%を占めており、この分野への商業的関心が持続していることを示唆しています(図2を参照)。
特許データを分析し、商業特許の主要譲受先トップ10を特定しました(図3参照)。アムジェンは血液学領域で世界的に承認された初のBi-TCE分子を開発し、独自のBiTE®技術によりこの分野のリーダー的地位を維持しています。
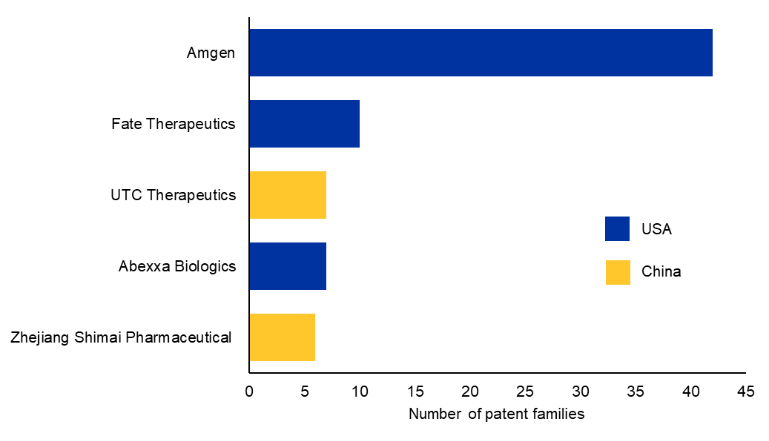
また、CAS STNext®を通じてアクセス可能なCASインデックスの概念を用いて、Bi-TCEの文脈における主要な治療領域を調査しました。当社のランドスケープ分析によれば、Bi-TCEの開発は主に固形腫瘍に集中しており、肺がん、乳がん、膵臓がん、前立腺がん、卵巣がんに関する文献が最も多くなっています。血液悪性腫瘍が第二の主要な重点領域であり、これは主に多発性骨髄腫および急性白血病を対象としたプログラムによって牽引されています(図4参照)。
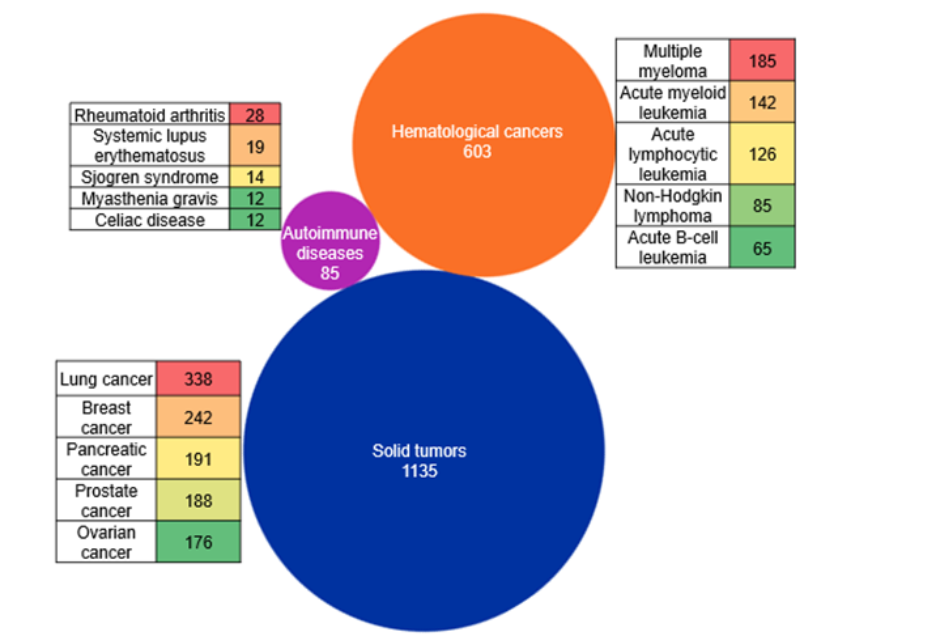
対照的に、自己免疫疾患はより小規模な新興研究領域であり、関節リウマチ、全身性エリテマトーデス、シェーグレン症候群などの疾患に研究関心が広がっています。特筆すべきは、これまでにFDA承認されたBi-TCEの大半が血液疾患の適応症向けである点です。しかし、私たちの分析では、固形腫瘍に関する文書の数が最も多いことがわかりました。これはおそらく、固形腫瘍の適応症に対してBi-TCEを効率的に利用するための継続的な取り組みが増加しているためと考えられます。
FDAに最初に承認されたBi-TCE、ブリナツモマブは2014年に承認されました。CD19とCD3を標的とし、再発または難治性のB細胞性急性リンパ芽球性白血病に適用されます。その後、固形腫瘍の2つの適応症を含む様々な癌種に対し、さらに多くのBi-TCE治療薬がFDAから迅速承認を取得しています。詳細は以下の表2にまとめています:
| Bi-TCE名 | 承認年 | 対象疾患 | 腫瘍細胞上の標的 |
|---|---|---|---|
| ブリナツモマブ(ビーリンサイト) | 2014年 | 急性リンパ芽球性白血病 | B細胞上のCD19 |
| モスネツズマブ(ルンスミオ) | 2022年 | R/R濾胞性リンパ腫 | B細胞上のCD20 |
| テベンタフスプ(キムトラック) | 2022年 | 切除不能または転移性のぶどう膜悪性黒色腫 | ぶどう膜悪性黒色腫細胞上のgp100ペプチド-HLA-A |
| テクリスタマブ(テクヴァイリ) | 2022年 | R/R多発性骨髄腫 | 骨髄腫細胞上のBCMA |
| エルラナタマブ(エルレクスフィオ) | 2023年 | R/R多発性骨髄腫 | 骨髄腫細胞上のBCMA |
| エプコリタマブ(エプキンリ) | 2023年 | R/Rびまん性大細胞型B細胞リンパ腫 | B細胞上のCD20 |
| グロフィタマブ(コルムビ) | 2023年 | 再発・難治性びまん性大細胞型B細胞リンパ腫、その他分類されないもの; びまん性大細胞型B細胞リンパ腫 | B細胞上のCD20 |
| タルケタマブ(タービー) | 2023年 | R/R多発性骨髄腫 | 骨髄腫細胞上のGPRC5D |
| タルラタマブ(イムデトラ) | 2024年 | 小細胞肺がん(SCLC) | SCLC細胞上のDLL3 |
表2:FDAによって承認されたBi-TCEの概要(2025年11月現在、加速承認を含む)。CD:分化クラスター、gp100、糖タンパク質100、HLA-A、ヒト白血球抗原A、BCMA:B細胞成熟抗原、GPRC5D:Gタンパク質共役受容体ファミリーCグループ5メンバーD、DLL3:デルタ様リガンド3、R/R:再発または難治性。出典:米国食品医薬品局
がん治療薬としてのBi-TCEの限界
Bi-TCEは血液がんにおいて変革をもたらすと考えられていますが、依然としていくつかの制限があります。従来のBi-TCE(例、ブリナツモマブのようなBiTE)は、Fcドメインを欠いた小さな抗体断片(約55 kDa)です。これは腎臓による濾過で速やかに除去されることを意味し、血漿中の半減期はわずか数時間となります。治療濃度を維持するためには持続的な静脈内注入が必要であり、患者と医療資源への負担が増加します。
Bi-TCEは、CD3と腫瘍抗原を架橋することによりポリクローナルT細胞活性化を誘導し、その結果としてIL-6、IFN-γ、TNF-αなどの大量のサイトカイン分泌を引き起こし、いわゆるサイトカイン放出症候群(CRS)を生じさせます。CRSは発熱、低血圧、多臓器機能障害として現れます。また、Bi-TCEは神経毒性、とりわけ免疫エフェクター細胞関連神経毒性症候群(ICANS)のリスクとも関連しています。これらの毒性は生命を脅かすことがあり、入院管理、副腎皮質ステロイド、さらにはトシリズマブなどによるIL-6受容体阻害を要する場合があります。
Bi-TCEは血液系腫瘍では強い活性を示しますが、固形腫瘍では限られた臨床的成功しか示していません。障壁には腫瘍浸透、抗原不均一性、免疫抑制的微小環境が含まれます。Bi-TCEのもう一つの重大な制限は、標的通りだが腫瘍外(on-target/off-tumor)の毒性現象です。多くの腫瘍関連抗原(CD19、BCMA、EPCamなど)は正常組織上でも低レベルで発現しています。その結果、Bi-TCEはT細胞を正常細胞攻撃へ誤誘導し、付随的な組織損傷を引き起こすとともに抗原選択を制限します。
Bi-TCEsを用いたがん研究の最近の進展
Bi-TCEの最近の進歩は、上記の課題に対処し、これらの治療法による臨床的効果を高めるための共同の取り組みを反映しています。継続的な革新により、精度、安全性、耐久性が向上し、Bi TCEは急速に発展する免疫療法のクラスとして位置付けられ、さまざまな種類のがんにわたって可能性が広がっています。特に注目すべきアプローチには以下のようなものがあります。
半減期延長型Bi-TCEs(HLE Bi-TCEs):
標準的なBi-TCE分子は、Fcドメインがないため、半減期が2~4時間と短く、継続的な静脈内注入が必要です。この課題を解決するため、Bi-TCEをFcドメインに融合したHLE Bi-TCEが開発中です。これによりFcRnによる再利用と循環時間の延長が可能になります。前臨床および初期臨床試験では、HLE Bi-TCEがCD19およびBCMAに対する活性を維持し、最大210時間の半減期を達成していることが示されており、週1回投与を支持する結果となっています。
CD3チューニングと2:1フォーマット:
Bi-TCEにおけるCD3チューニングは、T細胞の活性化を制御するためにCD3結合アームの親和性を調整することを含みます。低親和性のCD3結合は過剰なサイトカイン放出を抑えつつ、効果的な腫瘍細胞の殺傷を可能にし、それによって安全性を向上させます。2:1フォーマットでは、腫瘍抗原に対する2つの結合ドメインとCD3に対する1つの結合ドメインを配置し、T細胞を活性化させる前にがん細胞との結合を強化するすことにより、腫瘍特異性と効力を向上させます。CD3チューニングと2:1フォーマットの組み合わせは、次世代Bi-TCE療法において有効性と忍容性のバランスをとるための重要なエンジニアリング戦略です。
二重標的型および三重特異性エンゲージャー:
抗原の異質性および抗原逃避に対処するため、研究者らは二重標的型または三特重異性性エンゲージジャーの開発を進めています。これらは2つの腫瘍抗原を同時に標的とすることで特異性と有効範囲を向上させるほか、共刺激アームを付加することで、免疫抑制的な環境下におけるT細胞の適応性を高めるよう設計されています。二重特異性T細胞エンゲージャーには2つの結合部位があります。1つはT細胞上のCD3用、もう1つは腫瘍関連抗原用で、免疫シナプスの形成と細胞毒性を強制します。三重特異性エンゲージャー(TriTE)は、この設計を3番目の結合部位で拡張し、2番目の腫瘍抗原を標的にして逃避を阻止したり、CD28などの共刺激受容体に結合してT細胞の活性化を促進したりできます。この追加されたドメインにより選択性と効力が向上し、T細胞が関与する前に腫瘍をより強力に認識できるようになります。二重腫瘍抗原標的化を活用する「ANDゲート」アプローチは、Bi-TCEの標的通りだが腫瘍外(on-target/off-tumor)の毒性を軽減するのに役立ちます。
新しい送達システム:
Bi-TCEの新しい送達システムは、短い半減期と連続注入の制限を克服することを目的としています。AAVベースの遺伝子治療により、Bi-TCEの生体内での発現が可能になり、患者自身の細胞からの持続的な生産が可能になり、単回投与の治療をサポートできる可能性があります。さらに、局所的な免疫活性化を高めるためにBi-TCEを腫瘍微小環境に直接送達するための細胞外小胞などの他のアプローチも研究されています。
その他の戦略としては、新規腫瘍抗原を標的とすることで、固形腫瘍におけるその有効性を拡大することが挙げられます。Bi-TCEの中には、微小環境を介した活性化を利用し、腫瘍特異的な条件下でのみ結合し、標的外毒性を軽減するものもあります。アルブミン結合ドメインをBi-TCEに付加することで、天然のアルブミン再利用機構を活用し、半減期を延長し薬物動態を改善しています。Bi-TCEは、免疫活性化を高め、耐性メカニズムを克服するために、チェックポイント阻害剤、サイトカイン、または細胞治療と組み合わせて使用されることもあります。
臨床試験が示唆するBi-TCE療法の将来の方向性
この分野における臨床試験の現状を把握するために、 Clinicaltrials.govのデータを分析しました。図5に示すように、状態が「Active, recruiting(試験は現在進行中であり、新しい被験者を募集中)」のほとんどの試験は、確立されたFDA承認の候補薬に関するもので、これらは血液がん領域で多くを占めています(196件の試験)より小規模ながら意義ある割合が固形腫瘍(33試験)に向けられており、自己免疫疾患、アミロイド軽鎖アミロイドーシス(ALアミロイドーシス)、腎疾患への取り組みは限定的です。
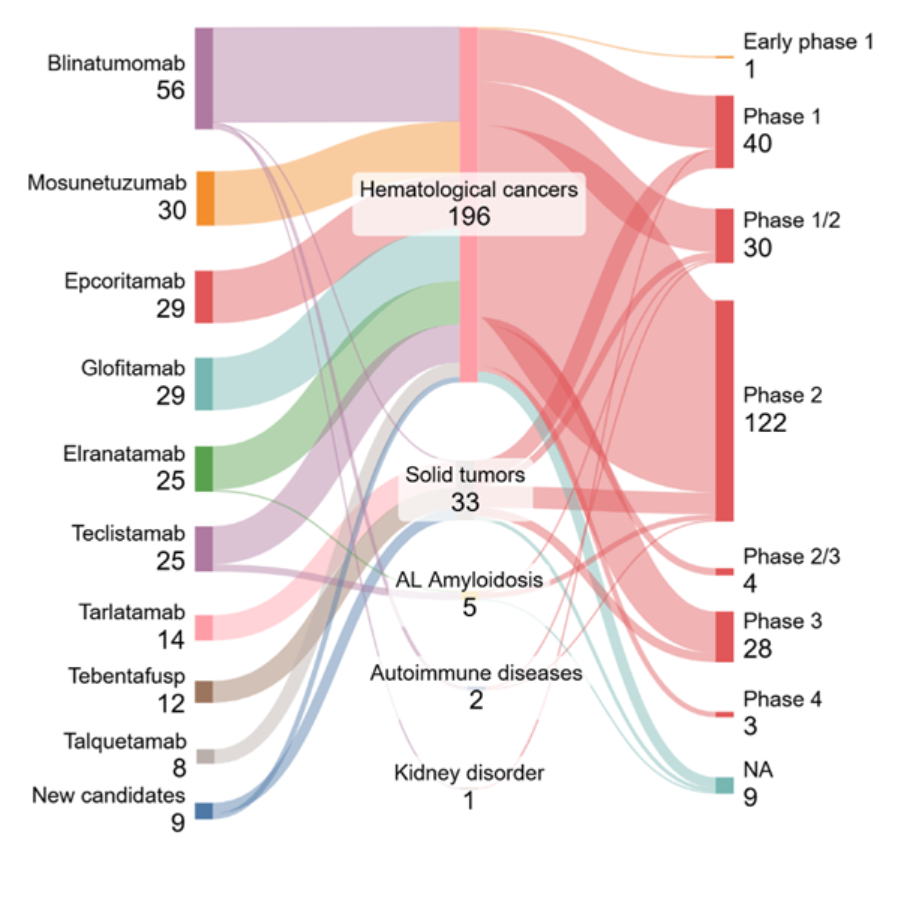
適応症全体で見ると、試験の最大の集中は第2相(122件)で、続いて第1相(40件)と第1/2相(30件)となっており、成熟しつつあるが、依然として初期から中期の活動に焦点を当てた臨床パイプラインを示しています。第3相に到達した候補はごくわずか(28件の試験)であり、血液学的環境を超えてT細胞リダイレクト療法を翻訳する際の課題を反映しています。
私たちの分析では、B細胞悪性腫瘍の強力な臨床的進展と、固形腫瘍および非腫瘍性疾患へのBi-TCEの段階的な拡大という2つの大きな傾向が浮き彫りになっています。固形腫瘍を対象とした第III相臨床試験の一部では、承認済み薬剤を他の化学療法剤や免疫チェックポイント阻害剤(例:テベンタフスプ+ペムブロリズマブ)と組み合わせて使用しています。
FDAがまだ承認していない新しい候補とその詳細を表3にまとめまています。
| Bi-TCE候補(会社) | 適応症 | 腫瘍細胞上の標的 | 臨床試験ID、フェーズ | イノベーションのハイライト |
|---|---|---|---|---|
| AZD0486(アストラゼネカ) | B細胞悪性腫瘍 | CD19 | NCT06564038、フェーズ1/2 | 低親和性CD3によるCRSの低減 |
| XmAb541 (Xencor, Inc.) | 卵巣がん、子宮内膜がん、胚細胞腫瘍 | CLDN6 | NCT06276491、フェーズ1 | 選択性のための2+1フォーマット |
| BI764532 (Boehringer Ingelheim) | 小細胞肺癌、神経内分泌腫瘍 | DLL3 | NCT05882058、フェーズ2 | DLL3を標的とした固形腫瘍Bi-TCE |
| BA3182 (BioAtla, Inc.) | 進行腺がん | EpCAM | NCT05808634、フェーズ1 | 条件付き活性結合、腫瘍微小環境においてのみ |
| CLN-049 (Cullinan Therapeutics Inc.) | R/R AML、MDS | FLT3 | NCT05143996、フェーズ1 | 新規腫瘍抗原(FLT3) |
| AMG 509 (Amgen) | 前立腺がん | STEAP1 | NCT04221542、第1相 | 2+1フォーマット、新規固形がん抗原(STEAP1) |
| AMF 305 (Amgen) | 進行固形腫瘍 | CDH3/MSLN | NCT05800964、フェーズ1 | デュアルターゲティングBi-TCE |
| VNX-202 (Vironexis Biotherapeutics Inc.) | HER2発現固形腫瘍 | HER2 | NCT07192432、フェーズ1/2 | 生体内Bi-TCE送達のためのAAV遺伝子治療 |
| VNX-101(Vironexis Biotherapeutics Inc.) | B細胞悪性腫瘍 | CD19 | NCT06533579、フェーズ1/2 | 生体内Bi-TCE送達のためのAAV遺伝子治療 |
表3:臨床開発中の注目すべきBi-TCE候補の概要。略語:R/R:再発性・難治性、AML:急性骨髄性白血病、MDS:骨髄異形成症候群、EpCAM:上皮細胞接着分子、CLDN6:クローディン6、FLT3:fms様チロシンキナーゼ3、STEAP1:六回膜貫通型前立腺上皮抗原1、CDH3:カドヘリン3、MSLN:メソセリン、HER2:ヒト上皮成長因子受容体2、AAV:アデノ随伴ウイルス。
これらの新しいBi-TCEは、初期の臨床研究において大きな可能性と好ましい結果を示しました。これは、この分野が急速に進化しており、次世代Bi-TCEの開発では安全性プロファイルを改善しながら有効性を高めることを目指していることを示しています。
Bi-TCEは腫瘍治療において重要な地位を確立しつつあり、患者の治療成績向上に貢献する態勢が整っています。また、がん以外の疾患治療においても重要な役割を果たす可能性があります。研究が拡大するにつれて、すぐに新たなブレークスルーが生まれ、世界中の患者に希望が持てるようになるかもしれません。
表1参考文献:
Slaney CY, Wang P, Darcy PK, Kershaw MH. CARs versus BiTEs: A Comparison between T Cell-Redirection Strategies for Cancer Treatment. Cancer Discov. 2018 Aug;8(8):924-934. doi: 10.1158/2159-8290.CD-18-0297. Epub 2018 Jul 16. PMID: 30012854.
Edeline, J., Houot, R., Marabelle, A. et al. CAR-T cells and BiTEs in solid tumors: challenges and perspectives. J Hematol Oncol 14, 65 (2021). https://doi.org/10.1186/s13045-021-01067-5
Dalal PJ, Patel NP, Feinstein MJ, Akhter N. Adverse Cardiac Effects of CAR T-Cell Therapy: Characteristics, Surveillance, Management, and Future Research Directions. Technology in Cancer Research & Treatment. 2022;21. doi:10.1177/15330338221132927