A imunoterapia é uma das fronteiras mais promissoras da medicina no tratamento do câncer, transformando de forma engenhosa o próprio sistema imunológico dos pacientes em um arsenal personalizado de combate ao câncer. Ao eliminar as células malignas e preservar os tecidos saudáveis, esse tipo de tratamento alcança potência e precisão — os dois pilares fundamentais para o sucesso no tratamento do câncer.
Embora a onda inicial de imunoterapias já tenha revolucionado a oncologia, uma inovação notável está surgindo agora: engajadores biespecíficos de células T (Bi-TCEs). Essas proteínas engenheiradas representam talvez a solução mais elegante até agora, pontes moleculares que forçam fisicamente células cancerígenas e células imunes a se unirem, criando um encontro mortal inevitável do qual as células cancerígenas não conseguem escapar.
Do ponto de vista estrutural, os Bi-TCEs consistem em dois fragmentos variáveis de cadeia única (scFvs) conectados por um linker flexível. Um scFv se liga a um antígeno associado ao tumor (TAA), enquanto o outro tem como alvo o CD3, um componente importante do complexo receptor de células T. Essa dupla especificidade permite que os Bi-TCEs vinculem fisicamente qualquer célula T que expresse CD3 com células cancerígenas, ignorando a necessidade de reconhecimento de peptídeo-MHC. Ao serem acionados, os Bi-TCEs desencadeiam uma cascata imunológica potente que ativa as células T, promovendo sua proliferação e induzindo a liberação de perforina e granzimas que medeiam a lise das células tumorais (Ver a Figura 1). Esse mecanismo de ação se mostrou eficaz em malignidades hematológicas, posicionando os Bi-TCEs como uma fronteira promissora na imunoterapia do câncer.
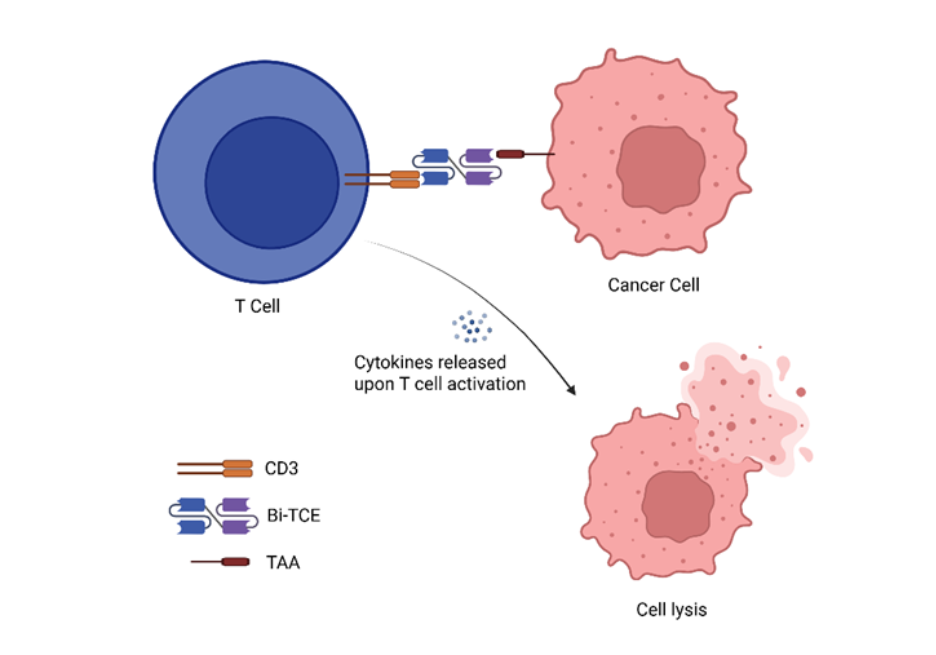
Engajadores de células T biespecíficos no cenário da imunoterapia do câncer
Como os Bi-TCEs se comparam à abordagem predominante de imunoterapia contra o câncer, o CAR-T? Uma diferença fundamental é o método de produção, as terapias CAR-T são desenvolvidas por engenharia genética das próprias células T do paciente, enquanto as Bi-TCEs são produzidas pela engenharia de proteínas em anticorpos de linhagens celulares de mamíferos. Isso faz dos Bi-TCEs um tipo de medicamento "pronto para uso", mais simples de produzir do que as terapias CAR-T individualizadas.
Existem outras comparações importantes, resumidas abaixo na Tabela 1:
| Recursos | Células CAR-T | Bi-TCEs |
|---|---|---|
| Estrutura | Estrutura Células T do paciente engenheiradas com um receptor sintético, incluindo um domínio de ligação ao antígeno-alvo (scFv), uma região de dobradiça, um domínio transmembrana e um domínio de sinalização intracelular | Um anticorpo recombinante com duas regiões scFv conectadas; uma tendo como alvo um TAA e outra tendo como alvo CD3, parte do complexo TCR em células T |
| Recrutamento de células T | Células T geneticamente modificadas e ativas redirecionam suas ações para destruir células tumorais. | Passivo, dependente de células T endógenas e que as redireciona para matar células tumorais. |
| Mecanismo de citotoxicidade | Liberação de perforina e granzima B das células CAR-T | Liberação de perforina e granzima B por células T endógenas ativadas pelo Bi-TCE |
| Tratamento de linfodepleção antes da terapia | Necessário (medicamentos como fludarabina e ciclofosfamida) | Não necessário |
| Meia-vida | Longo (semanas a meses) | Curto período (horas) – requer infusões repetidas |
| Produção | Engenharia genética de células T do paciente in vitro | Engenharia de proteínas de anticorpos a partir de linhagens celulares de mamíferos |
| Disponibilidade | Processo de produção individual para cada paciente | Medicamentos "prontos para uso" com processos de produção relativamente simples. |
| Indicações | Principalmente neoplasias hematológicas, com desenvolvimento clínico inicial em andamento para tumores sólidos. | Principalmente malignidades hematológicas; resultados iniciais em tumores sólidos sugerem que, em comparação a CAR-T, Bi-TCEs podem ter pequenas vantagens em tumores sólidos |
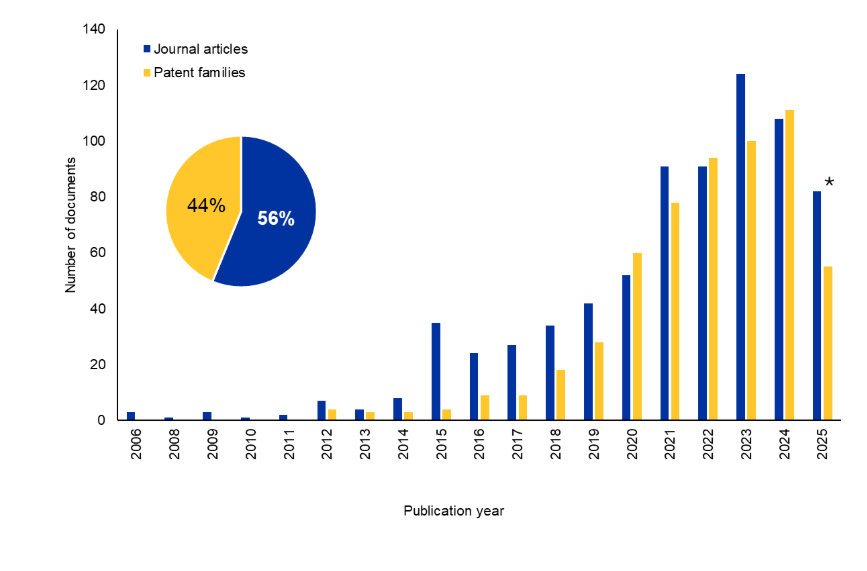
As tendências de publicação mostram oportunidades crescentes em pesquisa sobre o câncer e além
Analisamos a Coleção de conteúdo do CASTM, o maior repositório de informações científicas com curadoria humana, para entender melhor o cenário de pesquisa dos Bi-TCEs. Houve um aumento significativo no número de periódicos e documentos de patentes nos últimos 10 anos. Curiosamente, as patentes representam 44% do total de documentos, sugerindo um interesse comercial sustentado nesta área (veja a Figura 2).
Analisamos os dados de patentes para encontrar os 10 principais cessionários de patentes comerciais (ver Figura 3). A Amgen foi a primeira a desenvolver uma molécula de Bi-TCE aprovada globalmente em hematologia e continua sendo líder nesse campo com sua tecnologia proprietária BiTE®.
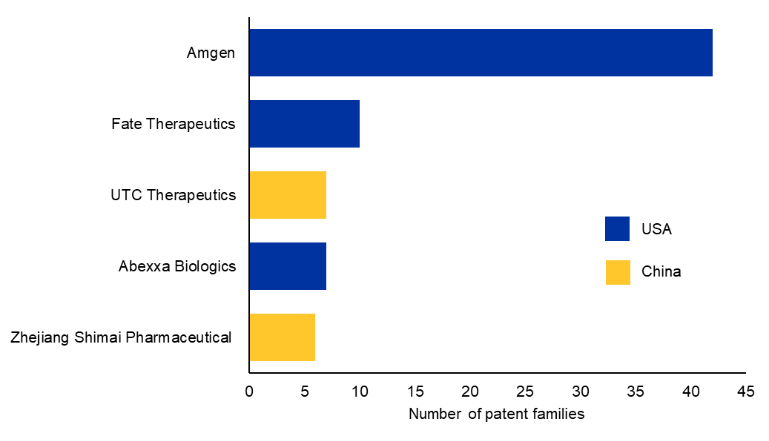
Também exploramos as principais áreas terapêuticas no contexto dos Bi-TCEs usando os conceitos indexados em CAS acessados pelo CAS STNext®. Nossa análise de cenário mostra que o desenvolvimento de Bi-TCEs está concentrado predominantemente em tumores sólidos, com o maior número de documentos em cânceres de pulmão, mama, pâncreas, próstata e ovário. Malignidades hematológicas formam a segunda grande área de foco, impulsionada em grande parte por programas voltados para mieloma múltiplo e leucemias agudas (consulte a Figura 4).
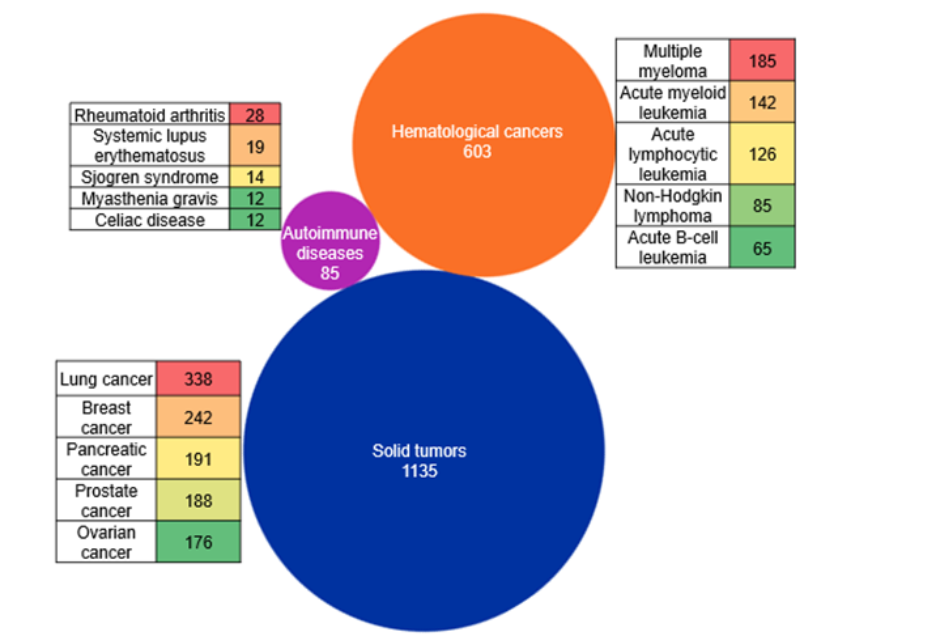
Em contraste, doenças autoimunes representam uma área emergente menor de exploração, com interesse distribuído em condições como artrite reumatoide, lúpus eritematoso sistêmico e síndrome de Sjörgen. Vale notar que a maioria dos Bi-TCEs aprovados pela FDA até agora é para indicações hematológicas. No entanto, em nossa análise, vemos que o número de documentos é maior para tumores sólidos. Isso provavelmente se deve ao aumento dos esforços em andamento para utilizar Bi-TCEs de forma eficiente em indicações de tumores sólidos.
O primeiro Bi-TCE aprovado pela FDA, blinatumomab, foi aprovado em 2014. Tem como alvo CD19 e CD3 e é indicado para leucemia linfoblástica aguda de células B recidivante ou refratária. Desde então, muitos outros terapêuticos Bi-TCE obtiveram aprovação acelerada da FDA para vários tipos de câncer, incluindo duas indicações de tumores sólidos. Os detalhes estão resumidos na Tabela 2 abaixo:
| Nome Bi-TCE | Ano de aprovação | Indicação de doença | Alvo nas células tumorais |
|---|---|---|---|
| Blinatumomabe (Blincyto) | 2014 | Leucemia linfoblástica aguda | CD19 em células B |
| Mosunetuzumab (Lunsumio) | 2022 | Linfoma folicular recidivado/refratário | CD20 em células B |
| Tebentafusp (Kimmtrak) | 2022 | Melanoma uveal irressecável ou metastático | peptídeo gp100-HLA-A em células de melanoma uveal |
| Teclistamab (Tecvayli) | 2022 | R/R mieloma múltiplo | BCMA em células de mieloma |
| Elranatamab (Elrexfio) | 2023 | R/R mieloma múltiplo | BCMA em células de mieloma |
| Epcoritamab (Epkinly) | 2023 | Linfoma difuso de grandes células B R/R | CD20 em células B |
| Glofitamab (Columvi) | 2023 | Linfoma difuso de grandes células B recidivado/refratário, não especificado de outra forma; linfoma de grandes células B | CD20 em células B |
| Talquetamab (Talvey) | 2023 | R/R mieloma múltiplo | GPRC5D em células de mieloma |
| Tarlatamab (Imdelltra) | 2024 | Câncer de pulmão de pequenas células (SCLC) | DLL3 em células de SCLC |
Tabela 2:Visão geral dos Bi-TCEs aprovados pelo FDA (incluindo aprovações aceleradas, até novembro de 2025). CD: cluster de diferenciação; gp100: glicoproteína 100; HLA-A: antígeno leucocitário humano A; BCMA: antígeno de maturação de células B; GPRC5D: membro D do grupo 5 da família C do receptor acoplado à proteína G; DLL3: ligante 3 semelhante a Delta; R/R: recidivado ou refratário. Fonte: Food and Drug Administration (FDA) dos EUA.
Limitações dos Bi-TCEs como cura para o câncer
Bi-TCEs são considerados transformadores em cânceres hematológicos, mas ainda enfrentam várias limitações. Bi-TCEs clássicos (por exemplo, BiTEs como blinatumomab) são pequenos fragmentos de anticorpos (~55 kDa) sem um domínio Fc. Isso significa que eles são rapidamente depurados por filtração renal, resultando em meia-vida plasmática de apenas algumas horas. A infusão intravenosa contínua é necessária para manter as concentrações terapêuticas, o que aumenta o ônus para os pacientes e os recursos de saúde.
Bi-TCEs induzem ativação policlonal das células T ao cruzar CD3 com antígenos tumorais, levando à secreção massiva de citocinas (IL 6, IFN γ, TNF α), conhecida como síndrome de liberação de citocinas (CRS). A síndrome de liberação de citocinas (CRS) manifesta-se por febre, hipotensão e disfunção multiorgânica. Os Bi-TCEs também estão associados a um risco de neurotoxicidade, especificamente a síndrome de neurotoxicidade associada a células efetoras imunes (ICANS). Essas toxicidades podem ser fatais e exigir hospitalização, corticosteroides ou bloqueio do receptor IL 6 (por exemplo, tocilizumabe).
Os Bi-TCEs exibem forte atividade em neoplasias hematológicas, mas têm demonstrado sucesso clínico limitado em tumores sólidos. As barreiras incluem a penetração tumoral, a heterogeneidade antigênica e o microambiente imunossupressor. Outra limitação crítica dos Bi-TCEs é o fenômeno de toxicidade alvo e fora do tumor. Muitos antígenos associados a tumores (por exemplo, CD19, BCMA, EpCAM) também são expressos em baixos níveis em tecidos normais. Consequentemente, os Bi-TCEs podem redirecionar as células T para atacar células saudáveis, levando a danos colaterais nos tecidos e limitando a seleção de antígenos.
Desenvolvimentos recentes na pesquisa do câncer com o Bi-TCES
Avanços recentes em Bi-TCEs refletem um esforço coordenado para lidar com os desafios mencionados acima e gerar maior impacto clínico com esses tratamentos. Inovações em andamento estão aprimorando a precisão, a segurança e a durabilidade, posicionando Bi TCEs como uma classe de imunoterapias em rápida evolução, com potencial em expansão em diversos tipos de câncer. Algumas das abordagens mais notáveis incluem: Algumas das abordagens mais notáveis incluem:
Bi-TCEs com meia-vida estendida (HLE Bi-TCEs):
Moléculas Bi-TCE canônicas têm meia-vida curta, de duas a quatro horas, devido à ausência de um domínio Fc, o que exige infusão intravenosa contínua. Para lidar com isso, Bi-TCEs HLE estão sendo desenvolvidos, que fundem o Bi-TCE a um domínio Fc, viabilizando reciclagem por FcRn e circulação prolongada. Estudos pré-clínicos e clínicos iniciais demonstram que os HLE Bi-TCEs mantêm a atividade com os HLE Bi-TCEs CD19 e BCMA, atingindo meias-vidas de até 210 horas, o que favorece a dosagem uma vez por semana.
Sintonia CD3 e formatos 2:1:
A modulação do CD3 em Bi-TCEs envolve o ajuste da afinidade do braço de ligação ao CD3 para controlar a ativação das células T. A ligação de menor afinidade ao CD3 reduz a liberação excessiva de citocinas, ao mesmo tempo que permite a destruição eficaz das células tumorais, melhorando assim a segurança. O formato 2:1 posiciona dois domínios de ligação para o antígeno tumoral e um para CD3, aumentando a seletividade tumoral e a potência ao assegurar um engajamento mais forte com as células cancerígenas antes da ativação das células T. Em conjunto, o ajuste do CD3 e o formato 2:1 são estratégias de engenharia essenciais para equilibrar a eficácia com a tolerabilidade nas terapias Bi-TCE de próxima geração.
Engajadores de dupla segmentação e tripla especificidade:
Para lidar com a heterogeneidade de antígenos e os mecanismos de escape, pesquisadores estão avançando no desenvolvimento de engajadores duais e trisspecíficos que co-direcionam dois antígenos tumorais para aumentar a especificidade e a cobertura, ou adicionam um braço coestimulatório para reforçar a aptidão das células T em ambientes imunossupressores. Engajadores de células T de dupla especificidade têm dois locais de ligação: um para CD3 nas células T e outro para um antígeno associado ao tumor, forçando a formação de sinapse imunológica e citotoxicidade. Os engajadores triespecíficos (TriTEs) expandem esse design com um terceiro sítio de ligação, que pode ter como alvo um segundo antígeno tumoral para impedir a evasão ou engajar um receptor coestimulatório, como o CD28, para aumentar a ativação das células T. Esse domínio adicional aumenta a seletividade e a potência, garantindo um reconhecimento tumoral mais robusto antes do engajamento das células T. Abordagens do tipo “AND-gate” que exploram o direcionamento dual de antígenos tumorais ajudam a reduzir a toxicidade no alvo fora do tumor dos Bi-TCEs.
Novos sistemas de entrega:
Os novos sistemas de administração de Bi-TCEs visam superar as limitações da meia-vida curta e da infusão contínua. A terapia genética baseada em AAV possibilita a expressão in vivo dos Bi-TCEs, possibilitando a produção sustentada a partir das próprias células do paciente e potencialmente apoiando o tratamento em dose única. Além disso, outras abordagens, como as vesículas extracelulares, estão sendo exploradas para fornecer Bi-TCEs diretamente no microambiente do tumor para aumentar a ativação imunológica local.
Outras estratégias incluem o direcionamento a novos antígenos tumorais para ampliar sua eficácia em tumores sólidos. Alguns Bi-TCEs utilizam ativação mediada pelo microambiente, ligando-se apenas sob condições específicas do tumor para reduzir a toxicidade fora do alvo. Domínios de ligação à albumina estão sendo adicionados aos Bi-TCEs para prolongar a meia-vida e melhorar a farmacocinética, aproveitando a reciclagem natural da albumina. Bi-TCEs também estão sendo combinados com inibidores de checkpoint, citocinas ou terapias celulares para potencializar a ativação imune e superar mecanismos de resistência.
Ensaios clínicos sugerem direções futuras para terapias Bi-TCE
Analisamos dados de Clinicaltrials.gov para obter insights sobre o cenário atual dos ensaios clínicos nessa área. Como visto na Figura 5, a maioria dos ensaios com status “Active, recruiting” é de candidatos bem estabelecidos e aprovados pela FDA, que dominam o domínio de cânceres hematológicos (196 ensaios). Uma proporção menor, porém relevante, é direcionada a tumores sólidos (33 ensaios), com esforços limitados em doenças autoimunes, amiloidose por cadeia leve de amiloide (amiloidose AL) e distúrbios renais.
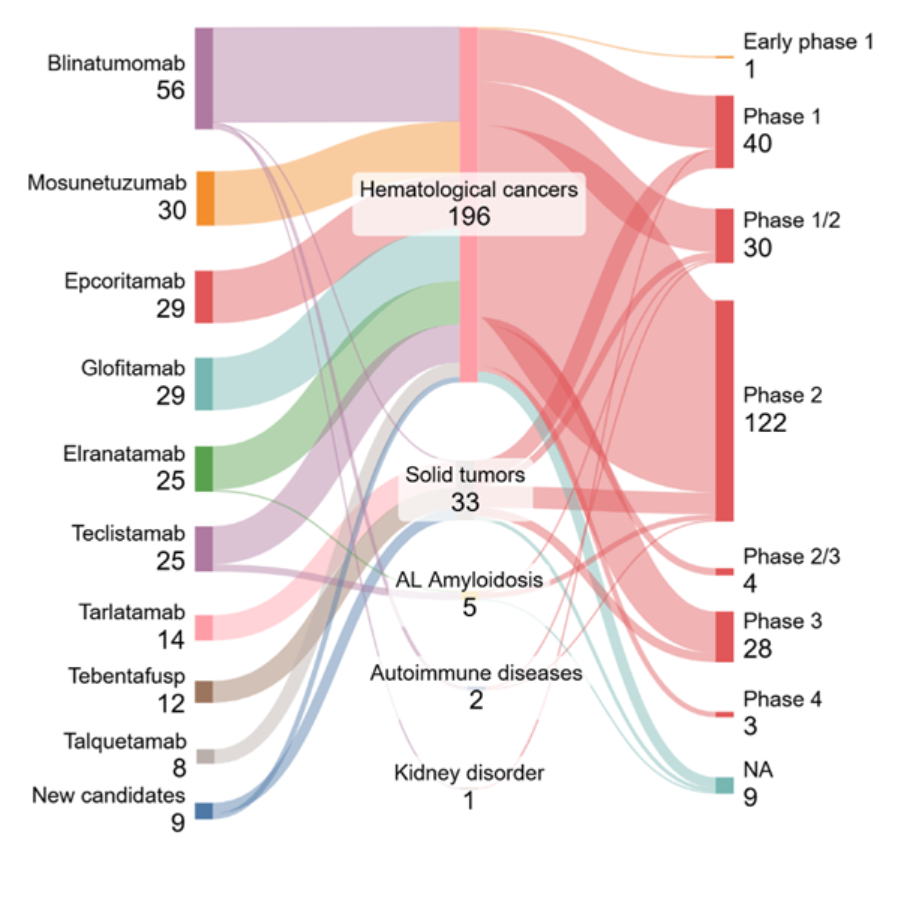
Em todas as indicações, a maior concentração de ensaios está na fase 2 (122), seguida pela fase 1 (40) e fase 1/2 (30), indicando um pipeline clínico que está amadurecendo, mas ainda focado em atividades de estágio inicial a intermediário. Apenas alguns candidatos chegaram à fase 3 (28 ensaios), refletindo os desafios de levar terapias de redirecionamento de células T além dos contextos hematológicos.
Nossa análise destaca duas tendências principais, forte impulso clínico em malignidades de células B e uma expansão gradual de Bi-TCEs para tumores sólidos e doenças não oncológicas. Alguns ensaios clínicos de fase 3 para tumores sólidos envolvem medicamentos aprovados em combinação com outras quimioterapias ou inibidores de checkpoint imune (por exemplo, Tebentafusp + Pembrolizumab).
Os candidatos mais novos, que a FDA ainda não aprovou, e seus detalhes estão resumidos na Tabela 3:
| Candidato Bi-TCE (Empresa) | Indicação | Alvo nas células tumorais | ID do ensaio clínico, Fase | Destaque de Inovação |
|---|---|---|---|---|
| AZD0486 (AstraZeneca) | Malignidades de células B | CD19 | NCT06564038, Fase 1/2 | CD3 de baixa afinidade para redução da CRS |
| XMab541 (Xencor, Inc.) | Câncer de ovário, câncer endometrial, tumor de células germinativas | CLDN6 | NCT06276491, Fase 1 | Formato 2+1 para seletividade |
| BI764532 (Boehringer Ingelheim) | Carcinoma pulmonar de células pequenas, tumores neuroendócrinos | DLL3 | NCT05882058, Fase 2 | Bi-TCE de tumor sólido com direcionamento de DLL3 |
| BA3182 (BioAtla, Inc.) | Adenocarcinoma avançado | EpCAM | NCT05808634, Fase 1 | Ligação condicionalmente ativa, apenas no microambiente tumoral. |
| CLN-049 (Cullinan Therapeutics Inc.) | R/R AML, MDS | FLT3 | NCT05143996, Fase 1 | Novo antígeno tumoral (FLT3) |
| AMG 509 (Amgen) | Câncer de próstata | STEAP1 | NCT04221542, Fase 1 | Formato 2+1, novo antígeno de tumor sólido (STEAP1) |
| AMF 305 (Amgen) | Tumores sólidos avançados | CDH3/MSLN | NCT05800964, Fase 1 | Bi-TCE de Alvo Duplo |
| VNX-202 (Vironexis Biotherapeutics Inc.) | Tumores sólidos com expressão de HER2 | HER2 | NCT07192432, Fase 1/2 | Terapia gênica com AAV para entrega in vivo de Bi-TCE |
| VNX-101 (Vironexis Biotherapeutics Inc.) | Malignidades de células B | CD19 | NCT06533579, Fase 1/2 | Terapia gênica com AAV para entrega in vivo de Bi-TCE |
Tabela 3: Resumo de candidatos Bi-TCE notáveis em desenvolvimento clínico. Abreviações: R/R: recidivado/refratário; AML: leucemia mieloide aguda; MDS: síndrome mielodisplásica; EpCAM: molécula de adesão celular epitelial; CLDN6: claudina-6; FLT3: fms like tyrosine kinase 3; STEAP1: antígeno epitelial da próstata com seis domínios transmembrana 1; CDH3: caderina-3; MSLN: mesotelina; HER2: receptor 2 do fator de crescimento epidérmico humano; AAV: vírus adenoassociado.
Esses novos Bi-TCEs demonstraram potencial considerável e resultados favoráveis em estudos clínicos iniciais. Eles demonstram que a área está evoluindo rapidamente e que o desenvolvimento de Bi-TCEs de próxima geração visa aumentar a eficácia e, ao mesmo tempo, melhorar os perfis de segurança.
Bi-TCEs estão construindo um nicho crucial no tratamento oncológico e estão prontos para oferecer melhores resultados para pacientes. Eles também podem desempenhar um papel importante no tratamento de condições além do câncer. À medida que a pesquisa se expande, eles podem em breve impulsionar novas descobertas importantes e mais esperança para pacientes em todos os lugares.
Tabela 1 Referências:
Slaney CY, Wang P, Darcy PK, Kershaw MH. CARs versus BiTEs: Uma comparação entre estratégias de redirecionamento de células T para o tratamento do câncer. Cancer Discov. 2018 Ago;8(8):924-934. doi: 10.1158/2159-8290.CD-18-0297. Epub 16 de jul. 2018. PMID: 30012854.
Edeline, J., Houot, R., Marabelle, A. et al. Células CAR-T e BiTEs em tumores sólidos: desafios e perspectivas. J Hematol Oncol 14, 65 (2021). https://doi.org/10.1186/s13045-021-01067-5
Dalal PJ, Patel NP, Feinstein MJ, Akhter N. Adverse Cardiac Effects of CAR T-Cell Therapy: Characteristics, Surveillance, Management, and Future Research Directions. Tecnologia in Cancer pesquisa & Treatment. 2022;21. doi:10.1177/15330338221132927