면역치료는 환자 자신의 면역계를 정교하게 전환해 개인 맞춤형 암 대응 체계로 활용함으로써, 암 치료에서 가장 유망한 의학적 전선 중 하나로 자리하고 있습니다. 이러한 유형의 치료는 정상 조직을 보존하면서 악성 세포를 제거함으로써 성공적인 암 치료의 두 축인 강력함과 정밀함을 동시에 달성합니다.
초기 면역치료 물결이 이미 종양학의 지형을 바꾸어 놓은 가운데, 주목할 만한 혁신이 새롭게 부상하고 있습니다. 바로 이중특이적 T 세포 인게이저(Bi-specific T cell engagers, Bi-TCE)입니다. 공학적으로 설계된 이러한 단백질은 현재까지 나온 솔루션 중 가장 정교한 방법일 것입니다. 암세포와 면역세포를 물리적으로 연결하는 분자적 가교로 작동해, 암세포가 회피할 수 없는 치명적인 상호작용을 유도합니다.
구조적으로 Bi-TCE는 유연한 링커로 연결된 두 개의 단일사슬 가변 영역(scFv)으로 구성됩니다. 한 scFv는 종양 관련 항원(TAA)에 결합하고, 다른 하나는 T 세포 수용체 복합체의 핵심 구성 요소인 CD3를 표적으로 합니다. 이러한 이중 특이성은 Bi-TCE가 펩타이드-MHC 인식이 필요 없는 방식으로 CD3를 발현하는 T 세포와 암세포를 물리적으로 연결할 수 있도록 합니다. 결합이 이루어지면 Bi-TCE는 T 세포를 활성화하고 증식을 촉진하며, 종양 세포 용해를 매개하는 퍼포린과 그랜자임의 방출을 유도하는 강력한 면역 연쇄 반응을 촉발합니다(그림 1 참조). 이 작용 기전은 혈액암에서 효과가 입증되어 Bi-TCE는 암 면역치료의 유망한 전선으로 자리매김했습니다.
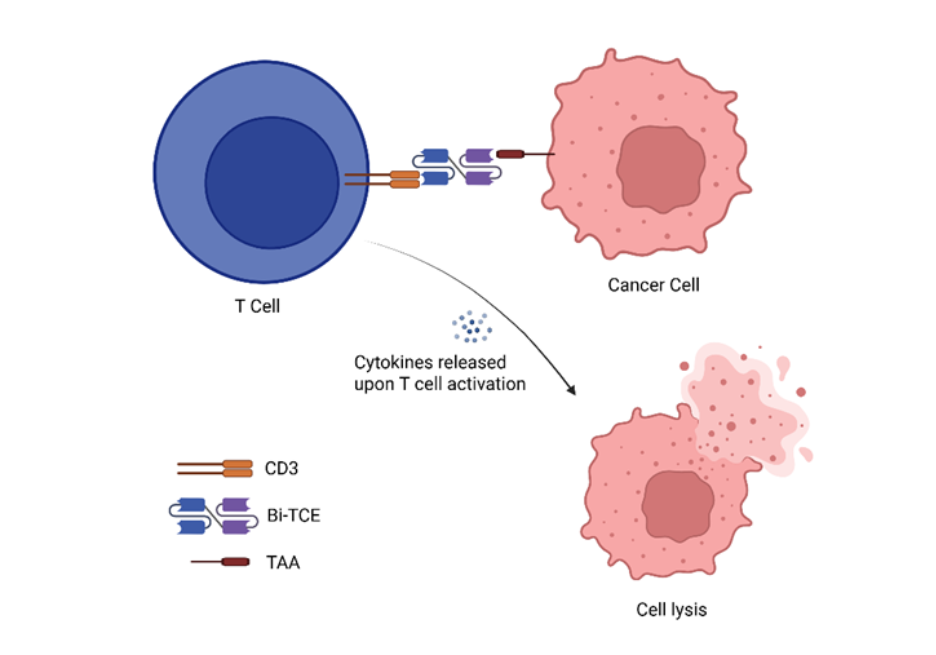
암 면역치료 환경에서의 이중특이적 T 세포 인게이저
Bi-TCE는 현재 암 면역치료의 주된 접근법인 CAR-T와 어떻게 다를까요? 핵심적인 차이 중 하나는 생산 방식입니다. CAR-T 치료제는 환자 자신의 T 세포를 유전적으로 조작해 개발되는 반면, Bi-TCE는 포유류 세포주에서 항체 단백질을 공학적으로 설계해 생산됩니다. 이러한 차이로 인해 Bi-TCE는 개별 환자 맞춤형으로 제작되는 CAR-T 치료제보다 생산이 단순한 '기성품' 유형의 약물로 분류됩니다.
그 밖의 중요한 비교 사항은 아래 표 1에 요약되어 있습니다.
| 특징 | CAR-T 세포 | Bi-TCEs |
|---|---|---|
| 구조 | 표적 항원 결합 도메인(scFv), 힌지 영역, 막관통 도메인, 세포내 신호 전달 도메인을 포함한 합성 수용체를 발현하도록 조작된 환자 T 세포 | 두 개의 scFv 영역이 연결된 재조합 항체로, 하나는 TAA를, 다른 하나는 T 세포의 TCR 복합체 구성 요소인 CD3를 표적 |
| T 세포 모집 | 능동적 방식으로, 공학적으로 조작된 T 세포를 종양 세포 살상으로 유도 | 수동적 방식으로, 체내 고유 T 세포에 의존해 이를 종양 세포 살상으로 유도 |
| 세포독성 기전 | CAR-T 세포에서 퍼포린과 그랜자임 B 방출 | Bi-TCE에 의해 활성화된 체내 T 세포에서 퍼포린과 그랜자임 B 방출 |
| 치료 전 림프구 제거 요법 | 필요함(플루다라빈, 사이클로포스파미드 등 약물 사용) | 필요하지 않음 |
| 반감기 | 김(수 주에서 수 개월) | 짧음(수 시간) - 반복 주입 필요 |
| 생산 방식 | 환자 T 세포의 시험관 내 유전적 조작 | 포유류 세포주에서 유래한 항체의 단백질 공학 |
| 가용성 | 환자별 개별 생산 공정 | 비교적 단순한 생산 공정을 갖는 기성품 약물 |
| 적응증 | 주로 혈액암. 고형종양은 초기 임상 단계 개발 진행 중 | 주로 혈액암. 고형종양에서는 초기 결과 기준으로 CAR-T 대비 Bi-TCEs가 소폭의 이점이 있을 가능성 시사 |
암 연구를 넘어선 기회 확대를 시사하는 출판 동향
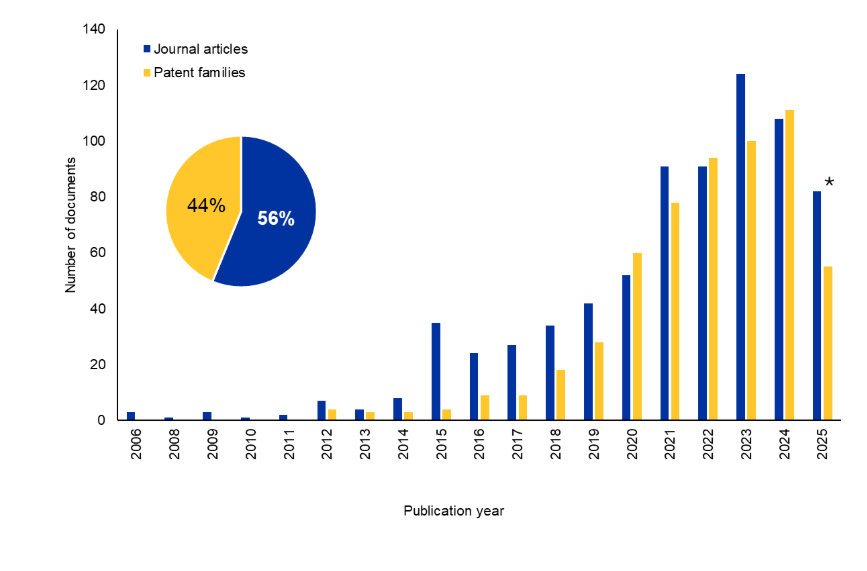
Bi-TCE 연구 환경을 더 잘 이해하기 위해, 사람이 엄선한 최대 규모의 과학 정보 저장소인 CAS Content CollectionTM을 분석했습니다. 지난 10년 동안 학술지 및 특허 문서 수는 유의미하게 증가했습니다. 특히 특허 문서는 전체 문서의 44%를 차지해, 이 분야에 대한 지속적인 상업적 관심을 시사합니다(그림 2 참조).
특허 데이터를 분석해 상위 10개 상업적 특허 양수인을 도출했습니다(그림 3 참조). Amgen은 혈액학 분야에서 세계적으로 승인된 최초의 Bi-TCE 분자를 개발했으며, 독자적인 BiTE® 기술을 통해 이 분야의 선도적 위치를 유지하고 있습니다.
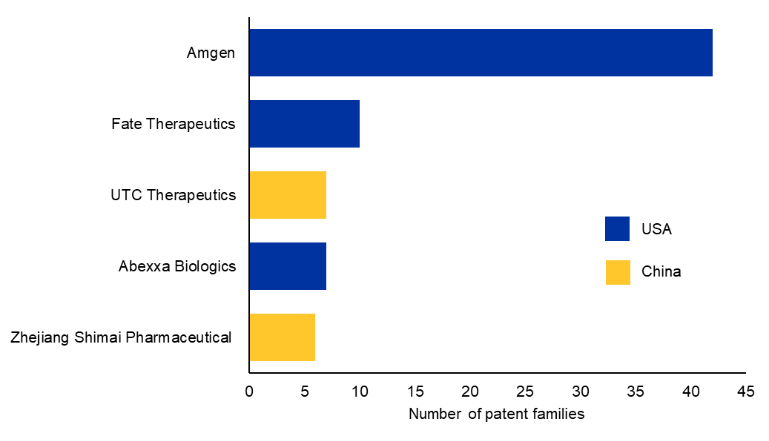
또한 CAS STNext®를 통해 접근한 CAS 색인 개념을 활용해 Bi-TCE의 주요 치료 영역을 분석했습니다. 분석 결과, Bi-TCE 개발은 고형종양에 주로 집중되어 있으며, 폐암, 유방암, 췌장암, 전립선암, 난소암에서 문서 수가 가장 많았습니다. 혈액암은 두 번째 주요 중점 영역으로, 다발골수종과 급성 백혈병을 표적하는 프로그램이 이를 주도하고 있습니다(그림 4 참조).
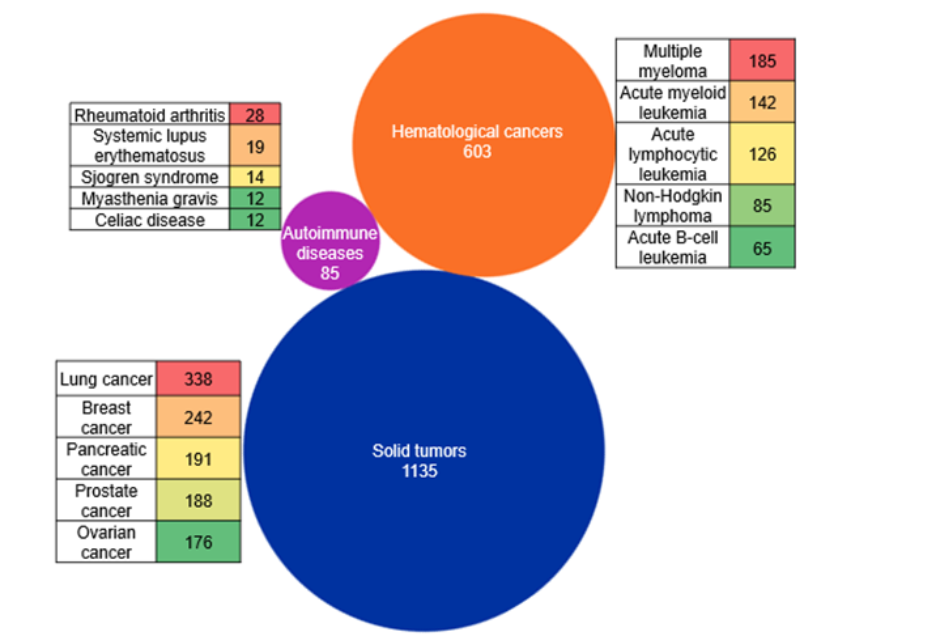
반면, 자가면역질환은 상대적으로 규모가 작은 신흥 탐색 영역으로 나타났으며, 류마티스 관절염, 전신홍반루푸스, 쇼그렌 증후군 등 다양한 질환에 걸쳐 관심이 분산되어 있습니다. 주목할 점은 현재까지 FDA 승인 Bi-TCE의 대부분이 혈액학적 적응증이라는 사실입니다. 그럼에도 불구하고 본 분석에서는 고형종양에서 문서 수가 가장 많았는데, 이는 고형종양 적응증에서 Bi-TCE를 효율적으로 활용하려는 지속적인 연구 노력이 반영된 결과로 보입니다.
최초의 FDA 승인을 받은 Bi-TCE인 blinatumomab는 2014년에 승인되었습니다. 이 약물은 CD19 및 CD3를 표적으로 하며 재발성 또는 불응성 B세포 급성 림프구성 백혈병에 적응증을 가집니다. 이후 다양한 암 유형을 대상으로 더 많은 Bi-TCE 치료제가 FDA의 신속 승인을 획득했으며, 이 가운데 두 건은 고형종양 적응증을 포함합니다. 관련 세부 내용은 아래 표 2에 요약되어 있습니다.
| Bi-TCE 명 | 승인 연도 | 질환 적응증 | 종양 세포 표적 |
|---|---|---|---|
| Blinatumomab(Blincyto) | 2014 | 급성 림프구성 백혈병 | B 세포의 CD19 |
| Mosunetuzumab(Lunsumio) | 2022 | R/R 여포성 림프종 | B 세포의 CD20 |
| Tebentafusp(Kimmtrak) | 2022 | 절제 불가능 또는 전이성 포도막 흑색종 | 포도막 흑색종 세포의 gp100 펩타이드-HLA-A |
| Teclistamab(Tecvayli) | 2022 | R/R 다발성 골수종 | 골수종 세포의 BCMA |
| Elranatamab(Elrexfio) | 2023 | R/R 다발성 골수종 | 골수종 세포의 BCMA |
| Epcoritamab(Epkinly) | 2023 | R/R 미만성 거대 B세포 림프종 | B 세포의 CD20 |
| Glofitamab(Columvi) | 2023 | R/R 미만성 거대 B세포 림프종, 기타 명시되지 않은 대형 B세포 림프종 | B 세포의 CD20 |
| Talquetamab(Talvey) | 2023 | R/R 다발성 골수종 | 골수종 세포의 GPRC5D |
| Tarlatamab (Imdelltra) | 2024년 | 소세포폐암(SCLC) | SCLC 세포의 DLL3 |
표 2:FDA 승인 Bi-TCE 개요(신속 승인 포함, 2025년 11월 기준). CD는 분화군(cluster of differentiation), gp100은 당단백질 100, HLA-A는 인간 백혈구 항원 A, BCMA는 B세포 성숙 항원, GPRC5D는 G 단백질 결합 수용체 패밀리 C 그룹 5 멤버 D, DLL3는 Delta-like ligand 3, R/R은 재발성 또는 불응성을 의미합니다. 출처: 미국 식품의약국(U.S. Food and Drug Administration)
암 치료제로서 Bi-TCE의 한계
Bi-TCE는 혈액암에서 혁신적인 치료 옵션으로 평가되지만, 여전히 여러 한계를 안고 있습니다. 고전적 Bi-TCE(예: blinatumomab과 같은 BiTE)는 Fc 도메인이 없는 소형 항체 단편(약 55 kDa)으로 구성되어 있습니다. 이로 인해 신장 여과를 통해 빠르게 제거되며, 혈장 반감기는 수 시간에 불과합니다. 치료 농도를 유지하려면 지속적인 정맥 주입이 필요해 환자와 의료 자원에 대한 부담이 증가합니다.
Bi-TCE는 CD3와 종양 항원을 교차 결합해 다클론성 T 세포 활성화를 유도하며, 그 결과 IL-6, IFN-γ, TNF-α와 같은 사이토카인이 대량 분비되는 사이토카인 방출 증후군(CRS)이 발생할 수 있습니다. CRS는 발열, 저혈압, 다발성 장기 기능 장애로 나타납니다. 또한 Bi-TCE는 면역효과세포 연관 신경독성 증후군(ICANS)으로 불리는 신경독성 위험과도 관련이 있습니다. 이러한 독성은 생명을 위협할 수 있으며, 입원 치료와 코르티코스테로이드 투여 또는 IL-6 수용체 차단(예: tocilizumab)이 필요할 수 있습니다.
Bi-TCE는 혈액암에서 강력한 활성을 보이지만, 고형종양에서는 임상적 성공이 제한적으로 보고되었습니다. 주요 장벽으로는 종양 침투의 어려움, 항원 이질성, 면역억제적 종양 미세환경이 포함됩니다. Bi-TCE의 또 다른 중요한 한계는 의도된 표적·비종양 독성입니다. CD19, BCMA, EpCAM과 같은 다수의 종양 관련 항원은 정상 조직에도 낮은 수준으로 발현됩니다. 그 결과 Bi-TCE는 T 세포를 정상 세포로 재유도해 부수적 조직 손상을 유발할 수 있으며, 항원 선택을 제한하는 요인으로 작용합니다.
Bi-TCE를 활용한 암 연구의 최근 진전
Bi-TCE의 최근 발전은 앞서 언급한 과제들을 해결하고 이러한 치료의 임상적 효과를 확대하려는 집중적인 연구 노력을 반영합니다. 현재 진행 중인 혁신은 정밀도, 안전성, 지속성을 향상시키고 있으며, Bi-TCE를 다양한 암 유형 전반으로 잠재력이 확장되는 빠르게 진화하는 면역치료 계열로 자리매김하게 합니다. 주목할 만한 접근법은 다음과 같습니다.
반감기가 연장된 Bi-TCEs (HLE Bi-TCEs):
정형 Bi-TCE 분자는 Fc 도메인이 없어 반감기가 2~4시간으로 짧아, 지속적인 정맥 주입이 필요합니다. 이를 해결하기 위해 Bi-TCE를 Fc 도메인에 융합하여 FcRn 재순환을 가능하게 하고 체내 순환 시간을 연장하는 HLE Bi-TCE가 개발되고 있습니다. 전임상 및 초기 임상 연구에 따르면 HLE Bi-TCE는 활성을 유지하며, CD19 및 BCMA 표적 HLE Bi-TCE는 최대 210시간의 반감기를 달성하여 주 1회 투여가 가능함을 시사합니다.
CD3 조율 및 2:1 포맷
Bi-TCE에서의 CD3 조율(CD3 tuning)은 CD3 결합 팔의 친화도를 조정해 T 세포 활성화를 제어하는 접근법입니다. CD3 결합 친화도가 낮으면 과도한 사이토카인 방출을 줄이면서도 효과적인 종양 세포 사멸을 가능하게 하여 안전성을 향상시킬 수 있습니다. 2:1 포맷은 종양 항원에 대한 결합 도메인 2개와 CD3에 대한 결합 도메인 1개를 배치하여 T 세포를 활성화하기 전에 암세포와의 결합을 강화함으로써 종양 선택성과 효능을 높입니다. CD3 조율과 2:1 포맷은 차세대 Bi-TCE 치료에서 효능과 내약성의 균형을 달성하기 위한 핵심 엔지니어링 전략입니다.
이중 표적화 및 삼중 특이적 인게이저
항원 이질성과 회피를 해결하기 위해, 연구자들은 이중 표적화 및 삼중 특이적 인게이저를 개발하고 있습니다. 이 접근법은 두 가지 종양 항원을 동시에 표적해 특이성과 적용 범위를 높이거나, 면역억제 환경에서 T 세포의 기능을 강화하기 위한 공동자극 팔을 추가하는 데 초점을 둡니다. 이중 특이적 T 세포 인게이저는 두 개의 결합 부위를 가지고 있습니다. 하나는 T 세포의 CD3에, 다른 하나는 종양 관련 항원에 결합해 면역 시냅스 형성과 세포독성을 유도합니다. 삼중 특이적 인게이저(TriTE)는 여기에 세 번째 결합 부위를 추가한 설계로, 회피를 방지하기 위해 두 번째 종양 항원을 표적하거나 CD28과 같은 공동자극 수용체를 결합해 T 세포 활성화를 강화할 수 있습니다. 이러한 추가 도메인은 T 세포가 관여하기 전에 종양 인식을 강화함으로써 선택성과 효능을 높입니다. 두 종양 항원을 동시에 표적하는 'AND-게이트' 접근법은 Bi-TCE의 의도된 표적·비종양 독성을 감소시키는 데 사용됩니다.
새로운 전달 시스템
Bi-TCE의 짧은 반감기와 지속 주입 필요성의 한계를 극복하기 위해 새로운 전달 시스템이 개발되고 있습니다. AAV 기반 유전자 치료는 체내에서 Bi-TCE를 발현하게 해 환자 자신의 세포에서 지속적인 생산을 가능하게 하며, 단회 투여 치료를 잠재적으로 지원합니다. 이와 함께 세포외 소포와 같은 다른 접근법도 종양 미세환경으로 Bi-TCE를 직접 전달해 국소 면역 활성화를 강화하는 방안으로 탐색되고 있습니다.
그 밖의 전략으로는 신규 종양 항원 표적화를 통해 고형종양에서의 효능을 확장하는 접근이 포함됩니다. 일부 Bi-TCE는 종양 특이적 조건에서만 결합하는 미세환경 매개 활성화를 활용해 비의도적 표적 독성을 줄입니다 또한 알부민 결합 도메인을 추가해 자연적인 알부민 재순환을 활용함으로써 반감기 연장과 약동학 개선을 도모하고 있습니다. Bi-TCE는 면역 활성화를 강화하고 내성 기전을 극복하기 위해 체크포인트 억제제, 사이토카인 또는 세포 치료와 병용되고 있습니다.
Bi-TCE 치료의 향후 방향을 시사하는 임상시험 동향
이 분야의 현재 임상시험 환경을 파악하기 위해 Clinicaltrials.gov 데이터를 분석했습니다. 그림 5에서 확인되듯이, 상태가 '진행 중(모집 중)'인 시험의 대부분은 이미 확립되었거나 FDA 승인을 받은 후보물질로, 혈액암 영역을 중심으로 분포합니다(196건) 이에 비해 고형종양을 대상으로 한 시험은 상대적으로 적지만 의미 있는 비중을 차지하며(33건), 자가면역질환, 아밀로이드 경쇄 아밀로이드증(AL 아밀로이드증), 신장 질환에 대한 시도는 제한적으로 나타납니다.
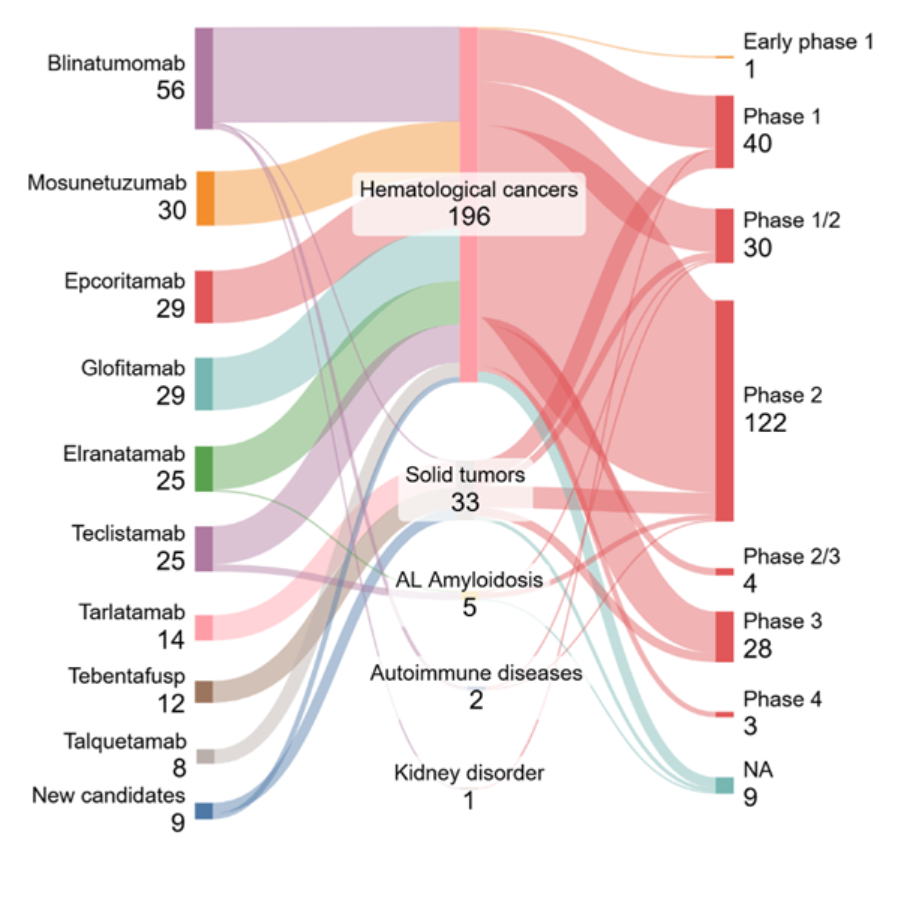
적응증 전반에서 임상시험은 2상이 가장 많은 비중을 차지하며(122건), 그 다음으로 1상(40건)과 1/2상(30건)이 뒤를 잇습니다. 이는 임상 파이프라인이 성숙 단계로 이동하고 있으나, 여전히 초기에서 중기 단계에 집중되어 있음을 보여줍니다. 3상에 도달한 후보물질은 소수에 그치며(28건), 이는 T 세포 재지향 치료를 혈액암을 넘어 확장하는 데 따르는 어려움을 반영합니다.
본 분석에서는 두 가지 주요 동향이 확인됩니다. 하나는 B세포 악성종양에서의 강한 임상적 추진력이며, 다른 하나는 Bi-TCE가 고형종양과 비종양성 질환으로 점진적으로 확장되고 있다는 점입니다. 고형종양을 대상으로 한 일부 3상 임상시험에서는 승인된 약물을 화학요법 또는 면역 체크포인트 억제제와 병용하는 사례가 포함되어 있습니다(예: Tebentafusp + Pembrolizumab).
아직 FDA 승인을 받지 않은 신규 후보물질과 그 세부 사항은 표 3에 요약되어 있습니다.
| Bi-TCE 후보물질(기업) | 적응증 | 종양 세포 표적 | 임상 시험 ID, 단계 | 혁신 요소 |
|---|---|---|---|---|
| AZD0486 (AstraZeneca) | B세포 악성 종양 | CD19 | NCT06564038, 1/2 단계 | CRS 감소를 위한 저친화도 CD3 |
| XmAb541 (Xencor, Inc.) | 난소암, 자궁내막암, 생식세포 종양 | CLDN6 | NCT06276491, 1상 | 선택성 향상을 위한 2+1 포맷 |
| BI764532 (Boehringer Ingelheim) | 소세포폐암, 신경내분비 종양 | DLL3 | NCT05882058, 2단계 | DLL3를 표적하는 고형종양 Bi-TCE |
| BA3182 (BioAtla, Inc.) | 진행성 선암 | EpCAM | NCT05808634, 1단계 | 종양 미세환경에서만 활성화되는 조건부 결합 |
| CLN-049 (Cullinan Therapeutics Inc.) | R/R AML, MDS | FLT3 | NCT05143996, 1상 | 신규 종양 항원(FLT3) |
| AMG 509 (Amgen) | 전립선암 | STEAP1 | NCT04221542, 1단계 | 2+1 포맷, 신규 고형종양 항원(STEAP1) |
| AMF 305(Amgen) | 진행성 고형종양 | CDH3/MSLN | NCT05800964, 1상 | 이중 표적화 Bi-TCE |
| VNX-202 (Vironexis Biotherapeutics Inc.) | HER2 발현 고형 종양 | HER2 | NCT07192432, 1/2 단계 | 생체 내 Bi-TCE 전달을 위한 AAV 유전자 치료 |
| VNX-101 (Vironexis Biotherapeutics Inc.) | B세포 악성 종양 | CD19 | NCT06533579, 1/2 단계 | 생체 내 Bi-TCE 전달을 위한 AAV 유전자 치료 |
표 3: 임상 개발 단계의 주목할 만한 Bi-TCE 후보물질 요약. 약어: R/R은 재발성 또는 불응성, AML은 급성 골수성 백혈병, MDS는 골수이형성증후군, EpCAM은 상피세포 접착 분자, CLDN6는 클라우딘-6, FLT3는 fms 유사 티로신 키나아제 3, STEAP1은 전립선 6회 막관통 상피 항원 1, CDH3는 카드헤린-3, MSLN은 메솔린, HER2는 인간 상피 성장인자 수용체 2, AAV는 아데노연관바이러스를 의미합니다.
이들 신규 Bi-TCE는 초기 임상 연구에서 상당한 잠재력과 긍정적인 결과를 보여주었습니다. 이는 해당 분야가 빠르게 진화하고 있음을 보여주며, 차세대 Bi-TCE 개발이 효능을 강화하는 동시에 안전성 프로파일을 개선하는 방향으로 진행되고 있음을 나타냅니다.
Bi-TCE는 종양학 치료에서 중요한 위치를 형성하고 있으며, 환자에게 개선된 치료 결과를 제공할 가능성이 있습니다. 또한 암 이외의 질환 치료에서도 중요한 역할을 할 수 있습니다. 연구가 확대됨에 따라, Bi-TCE는 향후 새로운 진전과 함께 더 많은 환자에게 희망을 줄 수 있을 것으로 기대됩니다.
표 1 참조문헌:
Slaney CY, Wang P, Darcy PK, Kershaw MH. 암 치료를 위한 T 세포 재지향 전략의 비교: CAR와 BiTE. Cancer Discov. 2018년 8월; 8(8) :924-934. doi: 10.1158/2159-8290.CD-18-0297. Epub 2018년 7월 16일. PMID: 30012854.
Edeline, J., Houot, R., Marabelle, A. 외. 고형종양에서의 CAR-T 세포와 BiTE: 도전 과제와 전망. J Hematol Oncol 14, 65(2021). https://doi.org/10.1186/s13045-021-01067-5
Dalal PJ, Patel NP, Feinstein MJ, Akhter N.CAR T 세포 치료의 심장 관련 이상반응: 특성, 모니터링, 관리 및 향후 연구 방향. Technology in Cancer Research & Treatment. 2022;21. doi:10.1177/15330338221132927