免疫疗法是癌症治疗中医学最有前景的前沿之一,它通过巧妙地将患者自身的免疫系统转化为个性化的抗癌武器库。通过消除恶性细胞而不损伤健康组织,这种治疗类型实现了高效性与精准性,成功癌症治疗的两大支柱。
虽然首批免疫疗法已经彻底改变了肿瘤学,但一项显著的创新正在出现:双特异性 T 细胞接合器 (Bi-TCE)。这些工程化蛋白质可能是迄今为止最优雅的解决方案,它们作为分子桥梁,将癌细胞与免疫细胞物理地连接在一起,制造出癌细胞无法逃脱的致命接触。
从结构上看,Bi-TCE 由两个单链可变片段 (scFv) 通过柔性连接子相连组成。一个 scFv 结合肿瘤相关抗原 (TAA),另一个则靶向 CD3,这是 T 细胞受体复合体的关键组成部分。这种双特异性使得 Bi-TCEs 能够将任何表达 CD3 的 T 细胞与癌细胞物理连接,从而无需依赖肽-MHC 识别。一旦结合,Bi-TCE 会触发强大的免疫级联反应,激活 T 细胞,促进其增殖,并诱导穿孔素和颗粒酶的释放,从而介导肿瘤细胞的裂解(见图 1)。这种作用机制已被证明在血液系统恶性肿瘤中有效,使 Bi-TCE 成为癌症免疫疗法中有前景的前沿方案。
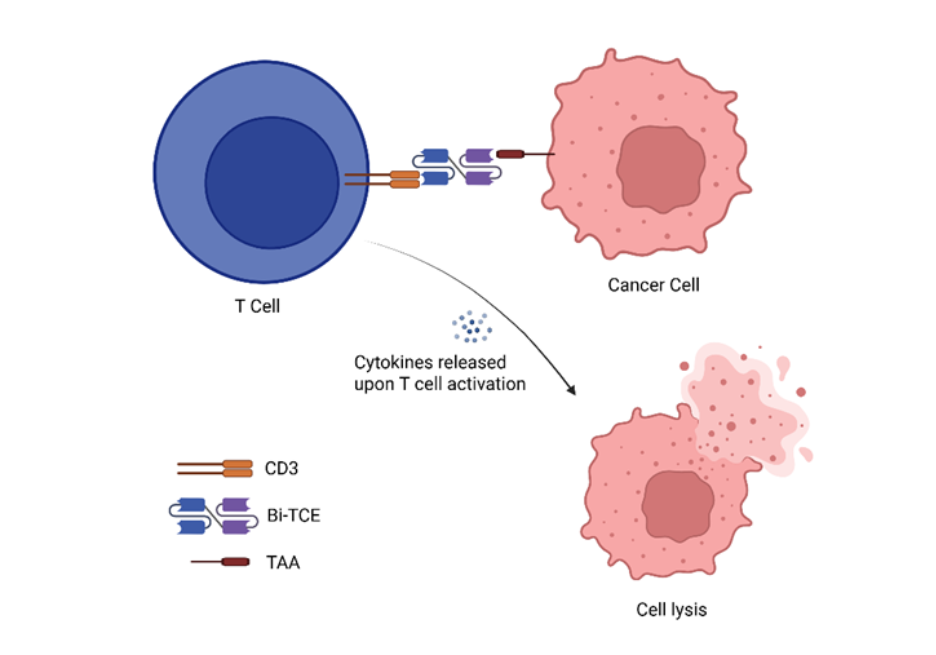
双特异性 T 细胞接合器在癌症免疫疗法领域的应用
Bi-TCEs 与主要的癌症免疫疗法方法 CAR-T 相比如何?一个关键区别在于它们的生产方式,CAR-T 疗法通过对患者自身的 T 细胞进行基因工程改造来开发,而 Bi-TCE 则通过在哺乳动物细胞系中工程化抗体蛋白来生产。这使得 Bi-TCE 成为一种“现成型”药物,其生产比个性化的 CAR-T 疗法更为简便。
还有其他重要的对比,总结如下表 1:
| 特点 | CAR-T 细胞 | Bi-TCEs |
|---|---|---|
| 结构化 | 通过工程化改造的患者 T 细胞,配备合成受体,包括靶抗原结合域 (scFv)、铰链区、跨膜域和细胞内信号传导域 | 一种重组抗体,含有两个相连的 scFv 区域;一个靶向肿瘤相关抗原 (TAA),另一个靶向 CD3,T 细胞受体 (TCR) 复合体的一部分 |
| T 细胞招募 | 激活并重新引导工程化 T 细胞杀伤肿瘤细胞 | 被动,依赖于内源性 T 细胞,并将其重新定向以杀死肿瘤细胞 |
| 细胞毒性机制 | CAR T 细胞释放穿孔素和颗粒酶 B | 由 Bi-TCE 激活的内源性 T 细胞释放穿孔素和颗粒酶 B |
| 治疗前的淋巴细胞清除 | 必需(如氟达拉滨和环磷酰胺等药物) | 不是必需的 |
| 半衰期 | 较长(数周至数月) | 短(小时)– 需要反复输液 |
| 生产 | 对患者 T 细胞进行体外基因工程改造 | 在哺乳动物细胞系中进行抗体的蛋白工程改造 |
| 可用性 | 针对每位患者的个性化生产流程 | “现成型”药物,生产流程相对简便 |
| 适应症 | 主要用于血液系统恶性肿瘤,对实体瘤的临床早期研究正在进行中 | 主要用于血液系统恶性肿瘤,对实体瘤的早期结果表明,与 CAR-T 相比,Bi-TCE 在实体瘤中可能具有轻微优势 |
文献发表趋势显示在癌症研究及其他领域的机会正在增加
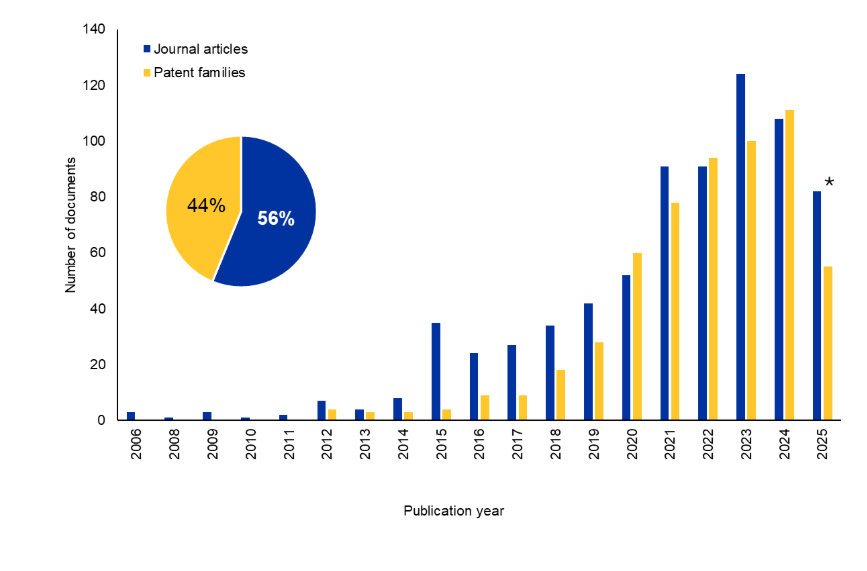
我们查阅了CAS 内容合集TM,全球最大的人工收录科学信息库,以更好地了解 Bi-TCE 的研究格局。在过去十年中,期刊文献和专利文献的数量显著增加。有趣的是,专利占文献总量的 44%,表明该领域持续受到商业关注(见图 2)。
我们分析了专利数据,以找出排名前 10 的商业专利受让人(见图 3)。Amgen 是首家在血液肿瘤领域开发出全球获批 Bi-TCE 分子的公司,并凭借其专有的 BiTE® 技术持续保持该领域的领先地位。
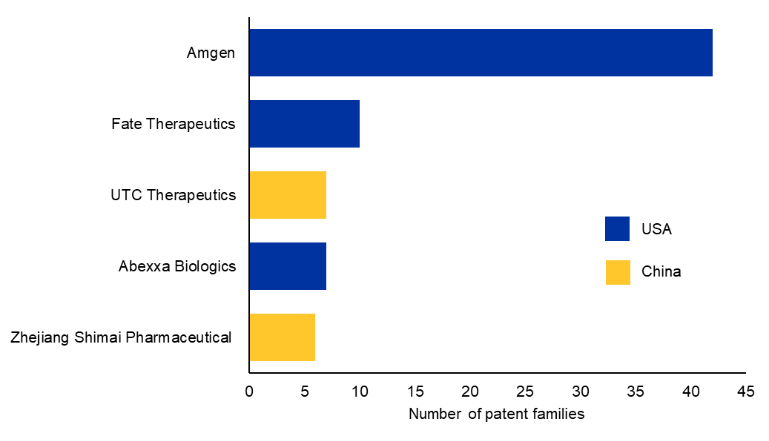
我们还利用通过 CAS STNext® 获取的 CAS 索引概念,探索了 Bi-TCE 的主要治疗领域。我们的布局分析显示,Bi-TCE 的开发主要集中在实体瘤领域,相关文献最多的癌症类型包括肺癌、乳腺癌、胰腺癌、前列腺癌和卵巢癌。血液系统恶性肿瘤构成第二大研究重点,主要由针对多发性骨髓瘤和急性白血病的研发项目推动(见图 4)。
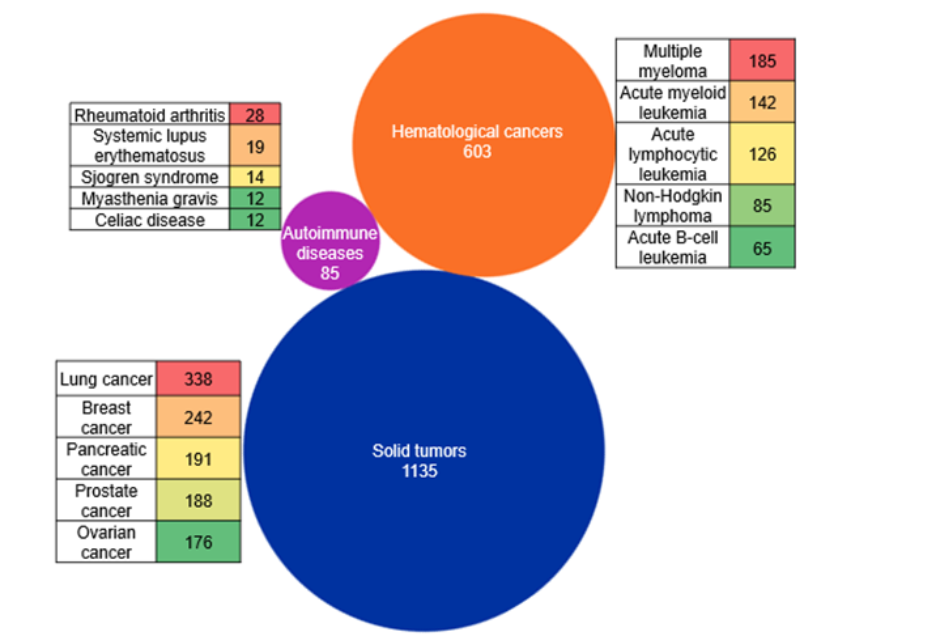
相比之下,自身免疫性疾病是一个较小的新兴研究领域,研究兴趣分布在类风湿关节炎、系统性红斑狼疮和舍格伦综合征等疾病上。值得注意的是,目前大多数获得 FDA 批准的 Bi-TCE 都是用于血液病适应症。然而,在我们的分析中可以看到,文献数量最多的是实体瘤领域。这很可能源于当前正加大力度推进 Bi-TCE 在实体瘤适应症中的高效应用。
首个获得 FDA 批准的 Bi-TCE blinatumomab(布林妥单抗)于 2014 年获批。它靶向 CD19 和 CD3,适用于复发或难治性 B 细胞急性淋巴细胞白血病。此后,又有多款 Bi-TCE 治疗药物获得 FDA 的加速批准,覆盖多种癌症类型,其中包括两个实体瘤适应症。详细信息汇总于下表 2:
| Bi-TCE名称 | 批准年份 | 疾病适应症 | 肿瘤细胞上的靶点 |
|---|---|---|---|
| Blinatumomab(Blincyto) | 2014 | 急性淋巴细胞白血病 | B细胞上的CD19 |
| Mosunetuzumab(Lunsumio) | 2022 | R/R 滤泡性淋巴瘤 | B细胞上的CD20 |
| Tebentafusp(Kimmtrak) | 2022 | 无法切除或转移性葡萄膜黑色素瘤 | gp100肽-HLA-A在葡萄膜黑色素瘤细胞上 |
| Teclistamab(Tecvayli,特立妥单抗) | 2022 | R/R多发性骨髓瘤 | 骨髓瘤细胞上的 BCMA |
| Elranatamab(Elrexfio,艾仑妥单抗) | 2023 | R/R多发性骨髓瘤 | 骨髓瘤细胞上的 BCMA |
| Epcoritamab(Epkinly,艾珂妥单抗) | 2023 | R/R 弥漫性大B细胞淋巴瘤 | B细胞上的CD20 |
| Glofitamab(Columvi) | 2023 | R/R 弥漫性大B细胞淋巴瘤,未另行说明;大B细胞淋巴瘤 | B细胞上的CD20 |
| Talquetamab(Talvey,塔尔妥单抗) | 2023 | R/R多发性骨髓瘤 | 骨髓瘤细胞上的 GPRC5D |
| Tarlatamab(Imdelltra) | 2024 | 小细胞肺癌(SCLC) | 小细胞肺癌 (SCLC) 细胞上的 DLL3 |
表 2:FDA 批准的 Bi-TCE 概览(包括加速批准,截至 2025 年 11 月)。CD:分化簇;gp100:糖蛋白 100;HLA-A:人白细胞抗原-A;BCMA:B 细胞成熟抗原;GPRC5D:G 蛋白偶联受体家族 C 组 5 成员 D;DLL3:Delta 样配体 3;R/R:复发或难治。资料来源:美国食品药品监督管理局 (FDA)
Bi-TCE 作为癌症疗法的局限性
Bi-TCE 在血液系统癌症中被认为具有变革性,但仍面临若干局限性。经典 Bi-TCE(例如 blinatumomab 这类 BiTE)是小型抗体片段(约 55 kDa),缺乏 Fc 结构域。这意味着它们会被肾脏快速清除,血浆半衰期仅为数小时。需要持续静脉输注以维持治疗浓度,这增加了患者和医疗资源的负担。
Bi-TCE 通过将 CD3 与肿瘤抗原交联,诱导多克隆 T 细胞活化,导致大量细胞因子(IL-6、IFN γ、TNF α)分泌,这被称为细胞因子释放综合征 (CRS)。CRS 的表现包括发热、低血压和多器官功能障碍。Bi-TCE 还与神经毒性风险相关,特别是一种免疫效应细胞相关神经毒性综合征 (ICANS)。这些毒性可能危及生命,需要住院治疗、使用皮质类固醇或IL-6 受体阻断(例如托珠单抗)。
Bi-TCE 在血液系统恶性肿瘤中表现出强效活性,但在实体瘤中的临床成功有限。其障碍包括肿瘤渗透性、抗原异质性以及免疫抑制性微环境。Bi-TCE 的另一个关键局限是“靶向正确但位点错误”的毒性现象。许多肿瘤相关抗原(如 CD19、BCMA、EpCAM)在正常组织中也低水平表达。因此,Bi-TCE 可能会重新引导 T 细胞攻击健康细胞,导致附带组织损伤,并限制可选抗原的范围。
Bi-TCE 在癌症研究领域的最新进展
Bi-TCE 的最新进展反映出为应对上述挑战并提升临床效果而进行的集中努力。正在进行的创新正在提高其精准性、安全性和持久性,使 Bi-TCE 成为快速发展的免疫疗法类别,并在多种癌症类型中展现日益扩大的潜力。其中一些最值得关注的方法包括:
半衰期延长型 Bi-TCEs(HLE Bi-TCE):
经典 Bi-TCE 分子由于缺乏 Fc 结构域,半衰期仅为 2 至 4 小时,因此需要持续静脉输注。为解决这一问题,正在开发半衰期延长型 Bi-TCE (HLE Bi-TCE),将 Bi-TCE 与 Fc 结构域融合,使其能够通过 FcRn 循环回收,从而延长体内循环时间。前临床和早期临床研究表明,HLE Bi-TCE 在 CD19 和 BCMA 上仍能保持活性,半衰期可达 210 小时,支持每周一次给药。
CD3 调谐和 2:1 格式:
Bi-TCE 中的 CD3 调控涉及调整 CD3 结合臂的亲和力,以控制 T 细胞的活化。降低 CD3 结合亲和力可以减少过量的细胞因子释放,同时仍能有效杀伤肿瘤细胞,从而提高安全性。2:1 构型在肿瘤抗原上设置两个结合域,在 CD3 上设置一个结合域,通过在激活 T 细胞前确保与癌细胞有更强的结合,从而增强肿瘤选择性和效力。总体而言,CD3 调控与 2:1 构型是下一代 Bi-TCE 疗法中平衡疗效与耐受性的关键工程策略。
双靶向和三特异性接合器:
为应对抗原异质性和逃逸现象,研究人员正在开发双特异性和三特异性接合器,这些接合器可同时靶向两个肿瘤抗原以提高特异性和覆盖范围,或增加共刺激臂以在免疫抑制环境中增强 T 细胞功能。双特异性 T 细胞接合器具有两个结合位点:一个结合 T 细胞上的 CD3,另一个结合肿瘤相关抗原,从而促进免疫突触形成和细胞毒性。三特异性接合器 (TriTE) 在此基础上增加第三个结合位点,可靶向第二个肿瘤抗原以防止逃逸,或结合共刺激受体(如 CD28)以增强 T 细胞活化。该额外结构域提高了选择性和效力,确保在 T 细胞介入前实现更强的肿瘤识别。“与门(AND-gate)”策略利用双肿瘤抗原靶向,有助于降低 Bi-TCE 的靶向正确但位点错误毒性。
新型递送系统:
Bi-TCE 的新型递送系统旨在克服半衰期短和需持续输注的局限。基于腺相关病毒 (AAV) 的基因疗法可在体内实现 Bi-TCE 的表达,使患者自身细胞持续产生 Bi-TCE,并有可能实现一次性给药。此外,诸如细胞外囊泡等其他方法也在探索中,用于将 Bi-TCE 直接递送至肿瘤微环境,以增强局部免疫活化。
其他策略包括靶向新型肿瘤抗原,以扩大 Bi-TCE 在实体瘤中的疗效。一些 Bi-TCE 利用肿瘤微环境介导的激活,仅在肿瘤特异性条件下结合,从而降低非靶向毒性。Bi-TCE 还正在添加白蛋白结合结构域,通过利用天然白蛋白循环来延长半衰期并改善药代动力学。此外,Bi-TCE 还与免疫检查点抑制剂、细胞因子或细胞疗法联合使用,以增强免疫活化并克服耐药机制。
临床试验显示了 Bi-TCE 疗法的未来发展方向
我们分析了 Clinicaltrials.gov 的数据,以了解该领域临床试验的现状。如图 5 所示,大多数标注为“进行中、招募中”的试验集中在已成熟且获得 FDA 批准的候选药物上,这些药物在血液系统癌症领域占主导地位(196 项试验)。较小但仍有意义的部分则针对实体瘤(33 项试验),而自身免疫性疾病、轻链淀粉样变性(AL 淀粉样变性)及肾脏疾病的研究较为有限。
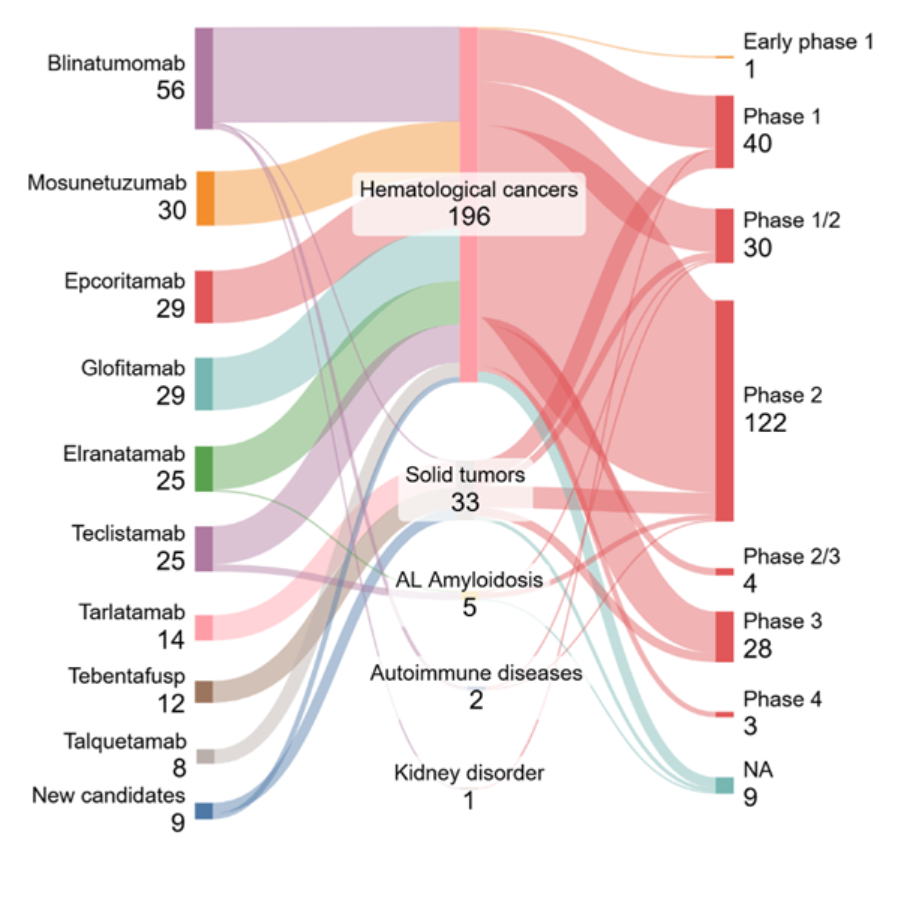
跨适应症来看,试验最集中于第二期(Phase 2,122 项),其次是第一期(Phase 1,40 项)和一期/二期联合(Phase 1/2,30 项),显示出临床管线正在成熟,但仍主要集中在早期至中期阶段。仅有少数候选药物进入第三期(Phase 3,28 项试验),反映出将 T 细胞重定向疗法应用于血液系统以外领域的挑战。
我们的分析显示两个主要趋势,B 细胞恶性肿瘤领域临床势头强劲,以及 Bi-TCE 正逐步拓展至实体瘤和非肿瘤性疾病。一些针对实体瘤的第三期临床试验涉及已获批药物与其他化疗或免疫检查点抑制剂联合使用(例如 Tebentafusp + Pembrolizumab)。
较新的候选药物(尚未获得 FDA 批准)及其相关信息总结见表 3:
| Bi-TCE 候选药物(公司) | 适应症 | 肿瘤细胞上的靶点 | 临床试验编号,阶段 | 创新亮点 |
|---|---|---|---|---|
| AZD0486(AstraZeneca 公司) | B 细胞恶性肿瘤 | CD19 | NCT06564038,第 1/2 阶段 | 低亲和力 CD3 以降低 CRS |
| XmAb541(Xencor 公司) | 卵巢癌、子宫内膜癌、生殖细胞肿瘤 | CLDN6 | NCT06276491,1 期 | 2+1选择性格式 |
| BI764532 (Boehringer Ingelheim) | 小细胞肺癌、神经内分泌肿瘤 | DLL3 | NCT05882058,第二阶段 | 靶向 DLL3 的实体瘤 Bi-TCE |
| BA3182(BioAtla, Inc.) | 晚期腺癌 | EpCAM | NCT05808634,第 1 阶段 | 条件性活化结合,仅在肿瘤微环境中发挥作用 |
| CLN-049 (Cullinan Therapeutics Inc.) | R/R AML,MDS | FLT3 | NCT05143996,第一阶段 | 新型肿瘤抗原(FLT3) |
| AMG 509(Amgen 公司) | 前列腺癌 | STEAP1 | NCT04221542,1 期 | 2+1格式,新型实体瘤抗原(STEAP1) |
| AMF 305(Amgen 公司) | 晚期实体瘤 | CDH3/MSLN | NCT05800964,第一阶段 | 双重靶向 Bi-TCE |
| VNX-202(Vironexis Biotherapeutics Inc.) | 表达 HER2 的实体瘤 | HER2 | NCT07192432,1/2期 | AAV 基因治疗用于体内 Bi-TCE 递送 |
| VNX-101(Vironexis Biotherapeutics Inc.) | B 细胞恶性肿瘤 | CD19 | NCT06533579,1/2 期 | AAV 基因治疗用于体内 Bi-TCE 递送 |
表 3:临床开发中值得注意的 Bi-TCE 候选药物总结。缩写:R/R:复发/难治性;AML:急性髓性白血病;MDS:骨髓增生异常综合征;EpCAM:上皮细胞粘附分子;CLDN6:Claudin-6;FLT3:fms 样酪氨酸激酶 3;STEAP1:前列腺 1 的六跨膜上皮抗原;CDH3:钙黏素-3;MSLN:间皮素;HER2:人类表皮生长因子受体 2;AAV:腺相关病毒。
这些新的 Bi-TCE 在早期临床研究中展示了相当大的潜力和良好的结果。它们表明该领域正在快速发展,下一代 Bi-TCE 的开发旨在提高疗效的同时改进安全性能。
Bi-TCE 正在肿瘤治疗中开辟出一个至关重要的利基市场,并有望为患者提供更好的治疗效果。它们还可能在治疗癌症以外的其他疾病方面发挥重要作用。随着研究的扩展,它们很可能很快推动新的突破,为世界各地的患者带来更多希望。
表 1 参考文献:
Slaney CY, Wang P, Darcy PK, Kershaw MH. CARs versus BiTEs: A Comparison between T Cell-Redirection Strategies for Cancer Treatment. Cancer Discov. 2018 Aug;8(8):924-934. doi: 10.1158/2159-8290.CD-18-0297. Epub 2018 Jul 16. PMID: 30012854.
Edeline, J., Houot, R., Marabelle, A. et al. CAR-T cells and BiTEs in solid tumors: challenges and perspectives. J Hematol Oncol 14, 65 (2021). https://doi.org/10.1186/s13045-021-01067-5
Dalal PJ, Patel NP, Feinstein MJ, Akhter N. Adverse Cardiac Effects of CAR T-Cell Therapy: Characteristics, Surveillance, Management, and Future Research Directions. Technology in Cancer Research & Treatment. 2022;21. doi:10.1177/15330338221132927