2025年初め、科学者たちは遺伝子編集された3匹の子オオカミを使って、ダイアウルフを絶滅から復活させたと発表しました。このニュースは大きな話題となりましたが、現存するハイイロオオカミのゲノムに限定的なダイアウルフの遺伝子編集を加えたものであるという重要な点にはあまり注目されませんでした。この研究は、永遠に失われたと思われていた遺伝子を復活させることができる高度な遺伝子技術の可能性を示しています。
絶滅した種を復活させるのではなく、より直接的で管理が容易なこの技術の応用として、分子の復元があります。これは、絶滅した遺伝子、タンパク質、または代謝経路を選択的に甦らせる技術です。この新興分野は、古代DNA(aDNA)を研究するパレオゲノミクスと、化石や亜化石の遺骸に保存された古代タンパク質を分析する古プロテオミクスの2つの主要な科学分野を活用しています。
これらのアプローチにより、科学者たちは進化の歴史から、医学、バイオテクノロジー、合成生物学に革命をもたらす可能性のある新しい生理活性化合物を発掘することができます。具体的には、分子レベルでの絶滅種復活は、抗菌分子の非従来型の供給源を提供することで、抗生物質耐性の問題に対処できる可能性があります。
最近の技術の進歩により、分子復元は理論的な推測から実験的現実へと進みました。次世代シーケンシング(NGS)と第三世代ロングリードシーケンシングにより、断片化されたaDNAの回復が劇的に改善されました。また、高解像度質量分析とバイオインフォマティクスタンパク質モデリングにより、研究者は古代のタンパク質配列を再構築し、その機能を予測できるようになりました。
計算生物学とAIの進歩により、好ましい分子の同定は、ほとんどランダムなプロセスから、より意図的でデータ主導の方法論に移行しました。この方法論では、研究者は広範なデータ分析に基づいて特定の分子特性をターゲットにし、潜在的な有効性を予測できます。
分子復元の研究トレンド
私たちは、分子復元の現在の状況と研究の進展を理解するために、人間の手によって収集された最大の科学情報リポジトリであるCASコンテンツコレクションTMを分析しました。過去10年間に文献数が増加し、その間に1件の特許が存在することがわかりました(図1参照)。
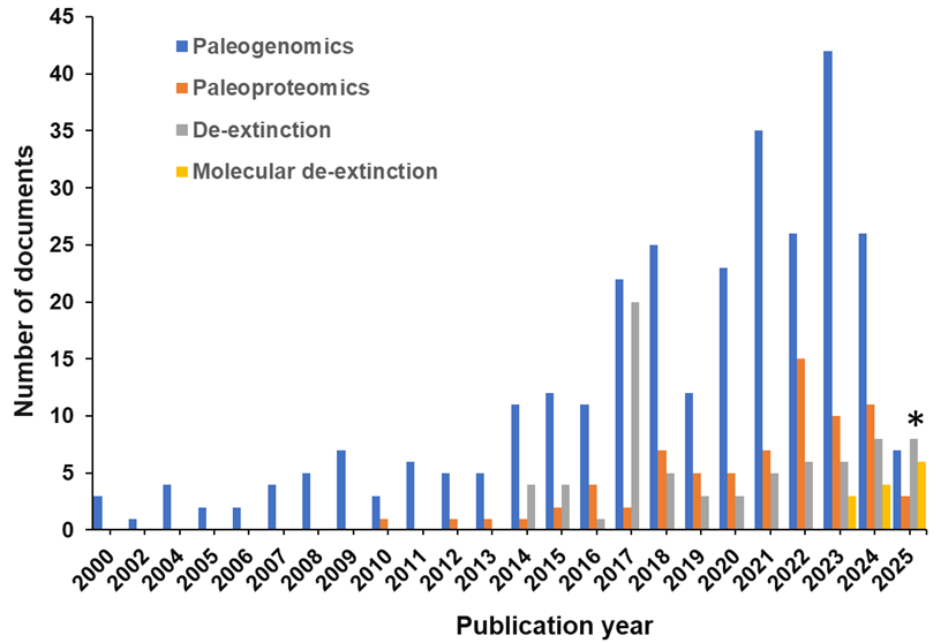
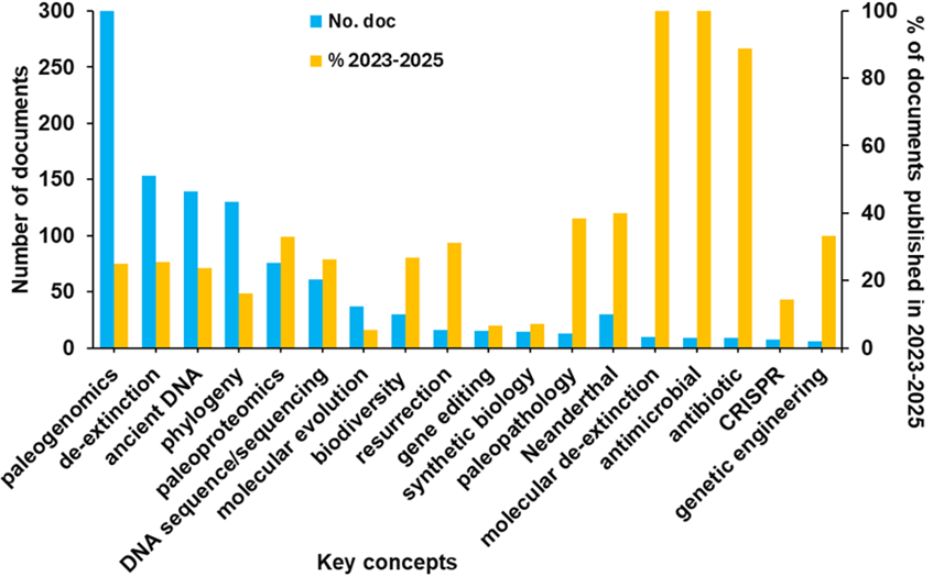
この分析により、2017年の絶滅種復活関連文書のピークが、ヘイスティングス生命倫理センターが特集号「Recreating the Wild: De‐Extinction, 技術, and the Ethics of Conservation」を出版したことに関連していることが明らかになりました。また、文献における絶滅種復活に関連する重要な概念についても調査しました(図2参照)。
今日の研究環境における主なポイントは次のとおりです。
- 最も研究が進んでいるのはパレオゲノミクスです。他のアプローチ(たとえば戻し交配やクローン作成)も絶滅種の復元に寄与していますが、パレオゲノミクスは正確な種の再生に必要な遺伝的設計図を提供します。絶滅した生物から遺伝物質を回収・解析・配列決定することで、研究者は失われたゲノムを再構築し、主要な機能的適応を特定し、ゲノム編集を通じて生きた代替個体を設計することが可能になります。ハイスループットシーケンシング、CRISPR-Cas9遺伝子編集、そして合成生物学の進歩が融合し、物質や種の復活を複雑でありながらも現実的な科学的取り組みへと変えつつあります。
- 抗菌剤および抗生物質に関する文献は、過去3年間で分子レベルの絶滅種復元研究に最も多く取り上げられたテーマとなっています(2025年分のデータは3月時点までの集計)。注目すべきは、(1) パレオゲノミクスによる古代抗菌ペプチドの発見、(2) 絶滅種復元ツールから開発されたCRISPRベースの抗菌戦略、(3) 復活させた微生物群集からの新たな抗生物質の発見という3つの重要な接点です。
- 古病理学、古代の病気の研究は、絶滅種復元と同時に発展しています。古病理学は伝統的に、骨格やミイラ化した遺体を通して過去の集団の健康状態を理解することに重点を置いていました。しかし、パレオゲノミクス、古プロテオミクス、バイオインフォマティクスの最近の進歩により、その応用は現代の創薬にも拡大しています。古代の病原体、ヒトの免疫反応、そして絶滅した薬用化合物を分析することで、研究者たちは抗生物質耐性、慢性疾患、そして新たな感染症に対抗するための新しい治療戦略を発見しています。さらに、進化生物学と古病理学を統合することで、絶滅種のがん感受性に影響を及ぼした選択圧についての理解が深まり、腫瘍抵抗性の潜在的なメカニズムを特定できるようになります。
- ネアンデルタール人に関するゲノム規模のデータが公開されており、彼らの生息域の大部分にわたる14か所の考古遺跡から出土した骨格遺骸を対象にしたものです。これらはネアンデルタール人の歴史を網羅しています。
絶滅種復元の手法
前述のように、絶滅種復元には2つのアプローチがあります。aDNAを研究するパレオゲノミクスと、古代のタンパク質を研究する古プロテオミクスです。それぞれが、潜在的な抗菌治療法の特定において重要な進歩をもたらしました。
パレオゲノミクス
パレオゲノミクスの進歩により、絶滅種復元の考え方はSFから具体的な科学的な探求へと移行しました。この手法は既に、更新世の巨大動物群の寒冷適応メカニズム、現代人とネアンデルタール人の神経遺伝学的差異、絶滅した病原体の免疫システム進化など、進化生物学における機能的な知見をもたらしています。
パレオゲノミクスは、現在の病原体に対する私たちの反応を理解するのにも役立ちます。例えば、ネアンデルタール人の免疫遺伝子の研究により、COVID-19のような新たな感染症に対する人間の感受性が合理的に説明されました。SARS-CoV-2感染後の呼吸不全の主要な遺伝的危険因子として特定された3番染色体上の遺伝子クラスターは、ネアンデルタール人から受け継いだゲノムセグメントによって付与され、南アジアの約50%、ヨーロッパの16%の人が持っていることがわかっています。
古遺伝学的プロセスは、絶滅種の遺伝子を復活させることを目的とし、そのゲノムを再構築したうえで、前述のダイアウルフの例のように近縁の現生生物へ導入することを目指しています。最初の最も重要なステップは、保存された生物材料から高品質な古代DNA(aDNA)を採取することであり、その後、DNAの分離、次世代シーケンシング、そして計算機による遺伝子組立てが行われます。
現代のDNAとは異なり、aDNAは高度に劣化し、化学的に改変されており、微生物や環境DNAに汚染されていることが多いです。DNA抽出、配列決定技術、バイオインフォマティクスの進歩により、aDNAを回収して分析することが可能となり、絶滅回復の取り組みへの道が開かれました。
ダイアウルフやケナガマンモスのような完全に形成された動物を復活させるには、多くの実際的、倫理的な課題が伴います。動物福祉と生態系への影響は、絶滅種復元に関する複雑な問題のうちの2つにすぎません。しかし、古代のペプチドを復元することは、それほど手間がかからず、創薬の取り組みを促進できる可能性があります。パレオゲノミクスを通じて、研究者たちは8つの絶滅した脊椎動物のゲノムを特定し、宿主の免疫に重要な役割を果たすジスルフィドが豊富な小さなカチオン性ペプチドであるディフェンシンについてコンピューターで検証しました。
その結果、6つの本物のβディフェンシンが同定されました。そのうち5つは2種類の絶滅した鳥類に由来し、もう1つは哺乳類に由来します。これらの分子の進化的・構造的分析は、まだ実験的に検証されていないものの、抗生物質発見の新たな道を開きつつあります。
古プロテオミクス
古プロテオミクスによる分子の復元には、絶滅した生物からのタンパク質の抽出、配列決定、計算による再構築、機能的復活が含まれます。この方法論では、質量分析、バイオインフォマティクス、合成生物学の進歩を活用して、古代の生体分子を回収して研究しています。
たとえば、科学者はディープラーニングモデルを使用して新しい抗生物質ペプチドを発見しました。タンパク質分解部位予測モデルは、絶滅した生物(いわゆる「絶滅体」)のプロテオームに含まれる広範囲のプロテアーゼによる抗菌活性を予測するように訓練されました。現存する生物には見られない多数の配列が、広範囲にわたる抗菌活性を示すと予測されました。このうち69のペプチドが合成され、細菌病原体に対する活性が実験的に検証されました。活性抗菌ペプチドの選択を表1に示します。
| ペプチド | 絶滅生物 | 親タンパク質 | ペプチド配列 | MIC |
|---|---|---|---|---|
| ヒドロダミン-1 3078251-51-8 |
ステラーカイギュウ(Hydrodamalis gigas) | 内皮分化遺伝子1 | LYCRIYSLVRARG RRLTFRKNISK | 4 μmol L-1 (A. baumannii, E. faecium) |
| Megalocerin-1 3078251-56-3 |
ギガンテウスオオツノジカ(Megaloceros giganteus) | シトクロムcオキシダーゼサブユニット3 | LIVCFFRQLKFHF | 8 μmol L-1(A. baumannii、E. faecium) |
| Mylodonin-2 3078251-68-7 |
巨大ナマケモノ(Mylodon darwinii) | アポリポプロテインB | KRKRGLKLATALS LNNKF | 32 μmol L-1 (E. coli) |
| Elephasin-2 3078251-59-6 |
直根象(Elephas antiquus) | ATPシンターゼF0サブユニット8 | IFLHLKILKIIRLL | 1 μmol L-1(A. baumannii、S. aureus、E. faecium) |
| マムツシン-2 3078251-49-4 |
ケナガマンモス(Mammuthus primigenius) | メラノコルチン-1受容体 | RACLHARSIARLHK RWRPVHQGLGLK | 32 μmol L-1(A. baumannii、E. faecium) |
| Equusin-1 3078251-35-8 |
グラントシマウマ(Equus quagga boehmi) | 自然抵抗性関連マクロファージ蛋白質1 | FLKLRWSRFARVLL | 1 μmol L-1 (E. faecium) 4 μmol L-1 (A. baumannii, E. coli, P. aeruginosa) |
| Equusin-2 3078251-48-3 |
グラントシマウマ(Equus quagga boehmi) | 異常紡錘体様小頭症関連タンパク質 | KIYKKLSTPPFTL NIRTLPKVKFPK | 8 μmol L-1 (A. baumannii) |
同じ絶滅生物由来の複数のペプチド対が、例えばアシネトバクター・バウマニ(A. baumannii)や緑膿菌(P. aeruginosa)などの病原体に対して強力な相乗的相互作用を示しました。A. baumanniiに対する分画阻害濃度(FIC)指数は0.38まで低下しました。Equusin-1とEquusin-3の組み合わせでは、最小発育阻止濃度(MIC)が64倍低下(4 μmol/Lから62.5 nmol/L)し、これは多くの最強の抗生物質と同等のサブミクロモル濃度に達しています。
注目すべきことに、Mammuthusin-2、Elephasin-2、Hydrodamin-1、Mylodonin-2、およびMegalocerin-1などの上位の化合物は、皮膚膿瘍や大腿部感染症のマウスにおいて、潜在的な抗感染活性を示しました。皮膚膿瘍感染モデルでテストされたより活性の高いペプチド(Elephasin-2とMylodonin-2)で得られた結果は、広く使用されている抗生物質ポリミキシンBと同等の抗菌活性を示しました。同様に、Mylodonin-2とElephasin-2は、マウス深部大腿感染を使用した場合にポリミキシンBと同等の抗感染効果を示し、抗生物質発見の成功アプローチとしての分子復元法の可能性を浮き彫りにしました。
最近の特許では、マルチタスクディープラーニングアルゴリズム「APEX」を用いて絶滅したプロテオーム由来の抗菌ペプチドを同定する方法、および同定された41種の抗菌ペプチドとその相乗効果・作用機序が開示されました。
さらに、開発された機械学習ツールであるプロテオーム全体の切断部位予測用panCleaveランダムフォレストモデルは、汎プロテアーゼ切断部位分類器を探索し、計算機によるタンパク質分解—ヒトタンパク質のin silico消化—を実行しました。分子レベルでの絶滅生物の復活に機械学習アプローチが用いられ、私たちの最も近い親戚である古代人類、ネアンデルタール人、デニソワ人のプロテオームが解析されました。いくつかの暗号化されたペプチド抗生物質が復活し、in vitroおよび前臨床マウスモデルで抗菌活性を示しました。
抗生物質の潜在的なブレークスルー
今日の糖ペプチド抗生物質の祖先がどのようなものであったかを理解するために、研究者たちはバイオインフォマティクスと遺伝的、生化学的方法を用いて、祖先の「パレオマイシン」を復活させました。まず、パレオマイシンの非リボソームペプチド合成酵素アセンブリラインを予測し、生合成遺伝子クラスターに基づくガイドツリーを構築しました。その後、研究者らは合成生物学技術を用いて予測されたペプチドを再構築し、その抗生物質活性を検証しました。
この研究は、合成生物学と計算技術の組み合わせが抗生物質の時間的進化を決定し、古代の分子を復活させる可能性があることを証明しました。また、現代の糖ペプチド抗生物質を生み出した進化的プロセスを通じて達成された自然な最適化戦略も実証されました。これにより、この重要なクラスの抗菌剤を開発するための将来の取り組みの基礎が築かれました。
科学者たちはまた、ネアンデルタール人のカテリシジンから抗生物質の新しい供給源を見つける可能性を模索しています。これは、現代の人間に見られる抗菌ペプチドに類似した抗菌ペプチドのファミリーであり、感染に対する防御の役割を果たします。研究者たちは、ネアンデルタール人とデニソワ人のプロテオミクスおよびゲノムデータをマイニングできる機械学習モデルを開発しました。基本的に、古代人類の配列を見つけ、どれが有効な抗生物質候補であるかを予測します。
絶滅種復元の課題と可能性
絶滅した動物を科学的に復活させて現代の生態系に再導入することは、論理的・倫理的なジレンマが避けられません。一方、絶滅分子復活なら、それよりもジレンマは少ないはずです。ただし、次のようなリスクがないわけではありません。
- DNAの劣化とゲノムデータの不完全さが避けられないため、完全な遺伝子再構築は困難。
- タンパク質の折り畳みエラー、翻訳後修飾、毒性、免疫原性など、復活した分子の機能に不確実性が伴う。
- 改変された遺伝子が、遺伝子サイレンシング、オフターゲット効果、水平遺伝子伝達などにより生態系内で広がって制御不能に陥り、意図しない影響を及ぼす可能性がある。
- 絶滅した分子を商業化すべきかどうかに関する生命倫理的問題。
こうした多くの懸念をクリアするには、倫理的な枠組みを構築し、科学界と規制当局が互いに協力することが不可欠です。潜在的な科学的ハードルに関しては、先進技術が引き続き重要な役割を果たすでしょう。AIは、タンパク質がどのように折り畳まれて機能するかをシミュレートできるので、完全なDNA配列はそれほど必要としません。ニューラルネットワークは、劣化した古代のDNAの欠落している断片を予測し、再構成の精度を向上させることができます。さらに、CRISPR-Cas9と塩基編集を使用すれば、古代の遺伝子を「ヒト化」して医療に安全に利用できる可能性があります。
絶滅分子復活は、まさに抗生物質創薬におけるパラダイムシフトであり、未知の抗菌薬の可能性を秘めた宝庫でもあります。規模拡大と規制に関して依然として課題が残るものの、絶滅分子復活の初期段階の成功は、地球の失われた生物多様性が、薬剤耐性の危機を解決する鍵を握っている可能性があることを実証しています。
詳細については、ACS Omegaの当社の記事「分子古生物学と創薬の出会い:絶滅分子復活による抗菌の事例」をご覧ください。
参考文献:
2: https://www.nature.com/articles/s41551-024-01201-x?utm_source=acs&getft_integrator=acs







