2025년 초, 과학자들은 유전자 편집을 통해 세 마리의 늑대 새끼를 탄생시켜 멸종된 늑대인 다이어울프를 되살렸다고 발표했습니다. 언론의 열광적인 반응은 일부 핵심적인 사실, 즉 현존하는 회색 늑대의 유전체를 일부 다이어울프 유전자로만 수정했다는 점을 어느 정도 흐리게 만들었지만, 이 연구는 한때 영원히 사라진 것으로 여겨졌던 유전자를 되살릴 수 있는 첨단 유전공학 기술의 가능성을 보여주었습니다.
그러나 멸종된 종을 되살리는 것보다, 이 기술의 보다 직접적이고 관리 가능한 응용은 분자 복원입니다. 이는 멸종된 유전자, 단백질 또는 대사 경로를 선택적으로 복원하는 과정입니다. 두 가지 주요 과학 분야를 활용하는데, 하나는 고대 DNA(aDNA)를 연구하는 고유전체학, 다른 하나는 화석이나 준화석 잔류물에 보존된 고대 단백질을 분석하는 고단백질체학입니다.
이러한 접근법을 통해 과학자들은 진화의 역사 속에서 새로운 생리활성 화합물을 찾아내어 의학, 생명공학, 합성생물학을 혁신할 수 있습니다. 특히 분자 복원은 항생제 내성 문제를 해결하기 위한 비전통적인 항균 물질의 새로운 원천을 제공할 수 있습니다.
최근 기술의 발전으로 분자 복원은 이론적 추측의 단계에서 실험적 현실로 발전했습니다. 차세대 염기서열 분석(NGS)과 3세대 롱리드 시퀀싱 기술은 단편화된 고대 DNA의 복원을 크게 개선했으며, 고해상도 질량분석법과 생정보학적 단백질 모델링을 통해 연구자들은 고대 단백질 서열을 재구성하고 그 기능을 예측할 수 있게 되었습니다.
계산생물학과 인공지능의 발전으로, 유망한 분자를 식별하는 과정은 과거의 무작위적 탐색에서 데이터 기반의 체계적 방법으로 전환되었습니다. 연구자들은 광범위한 데이터 분석을 바탕으로 특정 분자 특성을 목표로 설정하고, 그 잠재적 효능을 예측할 수 있게 되었습니다.
분자 복원 연구 동향
분자 복원의 현재 연구 현황과 진행 상황을 파악하기 위해, 사람이 직접 엄선한 세계 최대 규모의 과학 정보 저장소인 CAS Content CollectionTM을 분석했습니다. 그 결과, 지난 10년간 관련 문서의 수가 증가했으며, 이 기간 동안 한 건의 특허가 등록된 것으로 나타났습니다(그림 1 참조).
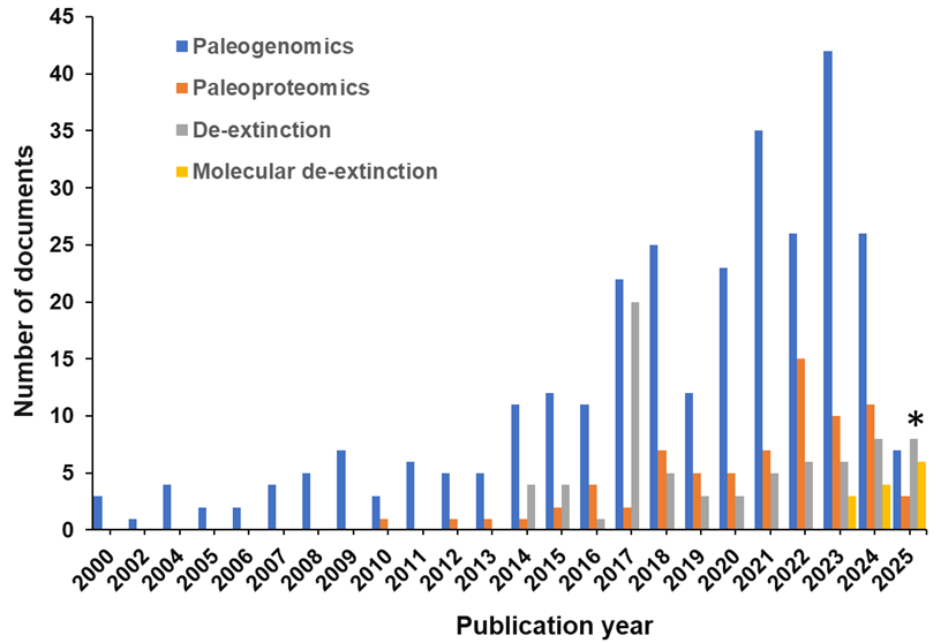
이번 분석에 따르면, 2017년에 분자 복원 관련 문서 수가 정점을 기록했으며, 이는 헤이스팅스 생명윤리센터(The Hastings Center for Bioethics) 가 '야생의 재창조: 복원, 기술, 그리고 보전의 윤리(Recreating the Wild: De‐Extinction, Technology, and the Ethics of Conservation)' 특별호를 발간한 시기와 일치합니다. 또한 문헌 내에서 분자 복원과 관련된 핵심 개념들을 함께 검토했습니다(그림 2 참조).
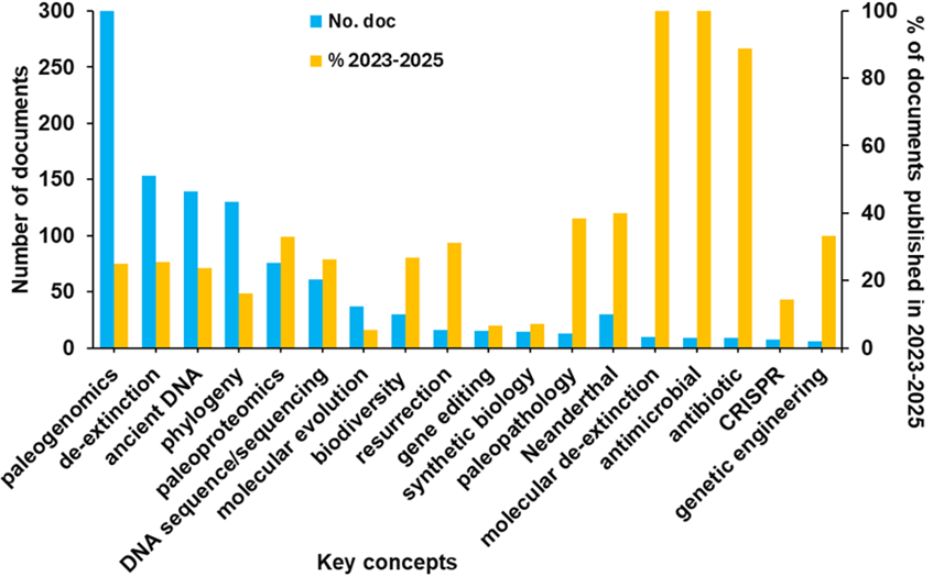
오늘날의 연구 환경에서 도출된 주요 시사점은 다음과 같습니다.
- 가장 활발히 연구되고 있는 개념은 고유전체학입니다. 다른 접근법(예: 역교배나 복제)도 복원에 기여하고 있지만, 고유전체학은 정밀한 종 복원을 위해 필요한 유전적 로드맵을 제공합니다. 멸종된 종의 유전 물질을 복원·염기서열 분석·해석함으로써, 연구자들은 소실된 게놈을 재구성하고 핵심 기능적 적응을 규명하며, 유전체 편집을 통해 살아있는 대체 개체를 설계할 수 있습니다. 고처리량 시퀀싱, CRISPR-Cas9 유전자 편집, 합성생물학의 발전이 맞물리며, 물질과 종의 복원을 복잡하지만 실현 가능한 과학적 시도로 만들고 있습니다.
- 항균제 및 항생제는 최근 3년간(2025년 3월까지의 데이터 기준) 분자 복원 관련 문헌에서 가장 많이 다뤄진 주제입니다. 주목할 만한 세 가지 교차 영역은 다음과 같습니다. (1) 고유전체학을 통한 고대 항균 펩타이드 발견, (2) 복원 기술에서 발전된 CRISPR 기반 항균 전략, (3) 복원된 미생물 군집으로부터의 신규 항생제 탐색.
- 고병리학, 즉 고대 질병의 연구는 분자 복원과 함께 등장하는 연구 분야입니다. 전통적으로 고병리학은 골격과 미라화된 유해를 통해 과거 인류의 건강 상태을 이해하는 데 초점을 맞춰왔습니다. 그러나 최근 고유전체학, 고단백질체학, 생물정보학의 발전으로 그 응용 범위가 현대 신약 개발로 확장되었습니다. 연구자들은 고대 병원체, 인간의 면역 반응, 그리고 멸종된 치료 화합물을 분석함으로써 항생제 내성, 만성 질환, 신종 감염병에 대응할 새로운 치료 전략을 밝혀내고 있습니다. 또한 진화생물학과 고병리학의 통합 연구를 통해 멸종된 종에서 암 감수성에 영향을 미친 선택 압력을 이해하고, 종양 저항성의 잠재적 기작을 식별할 수 있습니다.
- 네안데르탈인 게놈 규모 데이터가 공개되어 있으며, 이는 네안데르탈인의 역사 전반에 걸쳐 확인된 광범위한 지리적 지역의 14개 고고학 유적에서 발굴된 골격 잔해를 기반으로 합니다.
분자 복원 방법론
앞서 언급했듯이, 복원에는 두 가지 접근 방식이 있습니다. 하나는 aDNA를 연구하는 고유전체학이고, 다른 하나는 고대 단백질을 연구하는 고단백질체학입니다. 각각은 잠재적인 항균 치료법을 식별하는 데 중요한 돌파구로 이어졌습니다.
고유전체학
고유전체학의 발전 덕분에 복원의 개념은 공상 과학 소설의 영역에서 구체적인 과학적 탐구로 전환되었습니다. 이 접근법은 이미 진화생물학의 기능적 통찰을 제공했습니다. 예를 들어, 플라이스토세 대형동물의 냉적응 메커니즘, 현대 인류와 네안데르탈인의 신경유전학적 차이, 멸종 병원체의 면역체계 진화 등을 규명했습니다.
고유전체학은 또한 현대 병원체에 대한 인간의 반응을 이해하는 데에도 기여합니다. 예를 들어, 네안데르탈인의 면역 유전자를 분석한 연구는 COVID-19와 같은 신종 전염병에 대한 인간의 감수성을 설명했습니다. SARS-CoV-2 감염 후 호흡부전의 주요 유전적 위험 인자로 확인된 염색체 3번상의 유전자군은 네안데르탈인으로부터 유래한 유전체 구간에 의해 전달된 것이며, 남아시아 인구의 약 50%, 유럽 인구의 약 16%가 이를 보유하고 있는 것으로 밝혀졌습니다.
고유전체학적 과정은 멸종된 종의 유전체를 복원하여 이를 가까운 현존 생물의 유전체에 도입함으로써, 멸종된 종의 유전자를 되살리는 것을 목표로 합니다. 앞서 언급한 다이어울프 사례가 그 예입니다. 이 과정의 첫 번째이자 가장 중요한 단계는 보존된 생물학적 물질로부터 고품질의 aDNA를 확보하는 것이며, 이후 DNA 분리, 차세대 염기서열 분석, 계산 유전학적 조립이 뒤따릅니다.
현대의 DNA와 달리 aDNA는 심하게 분해되고 화학적으로 변형되며 있으며, 종종 미생물 및 환경 DNA로 자주 오염되어 있습니다. DNA 추출, 염기서열 분석 기술, 생물정보학의 발전으로 인해 aDNA의 복구와 분석이 가능해지면서, 복원 연구의 길이 열렸습니다.
다이어울프나 매머드와 같은 완전한 동물의 복원에는 많은 실질적, 윤리적 문제가 수반됩니다. 동물 복지나 생태학적 영향 등은 종 복원을 둘러싼 복잡한 쟁점 중 일부에 불과합니다. 반면, 고대 펩타이드의 복원은 훨씬 실현 가능성이 높으며, 신약 개발 연구를 이끌 수 있습니다. 고유전체학 연구를 통해 연구자들은 멸종된 척추동물 8종의 유전체를 식별하고, 디펜신을 계산적으로 검증했습니다. 디펜신은 이황화 결합을 포함한 양전하성 소형 펩타이드로, 숙주의 면역 반응에 중요한 역할을 합니다.
그 결과 6개의 진정한 β-데펜신이 확인 되었으며, 이 중 5개는 두 멸종 조류 종에서, 1개는 포유류 종에서 유래했습니다. 이러한 분자들의 진화적 및 구조적 분석은 새로운 항생제 발견의 가능성을 여는 데 기여하고 있지만, 아직 실험적으로 검증되지는 않았습니다.
고단백질체학
고단백질체학을 통한 분자 복원에는 멸종 생물에서 단백질을 추출하고, 염기서열을 분석하며, 계산적으로 재구성한 뒤 기능적으로 되살리는 과정을 포함합니다. 이 방법은 질량 분석, 생물정보학, 합성생물학의 발전을 활용해 고대 생체분자를 복원하고 연구할 수 있도록 합니다.
예를 들어, 과학자들은 딥러닝 모델을 활용해 새로운 항균 펩타이드를 발견했습니다. 단백질 분해 부위 예측을 위한 모델을 학습시켜, 멸종 생물의 단백질체(‘extinctome’)에서 다양한 프로테아제가 매개하는 항균 활성을 예측하도록 한 것입니다. 그 결과, 현존 생물에서는 발견되지 않는 수많은 염기서열이 광범위 항균 활성을 가질 것으로 예측되었습니다. 이 중 69개의 펩타이드가 합성되었고 세균성 병원체에 대한 활성이 실험적으로 검증되었습니다. 그 중 일부 활성 항균 펩타이드는 표 1에 제시되어 있습니다.
| 펩타이드 | 멸종된 생물 | 모 단백질 | 펩타이드 서열 | MIC |
|---|---|---|---|---|
| Hydrodamin-1 3078251-51-8 |
스텔러 해우(Hydrodamalis gigas) | 혈관내피분화유전자 1 | LYCRIYSLVRARG RRLTFRKNISK | 4 μmol L-1 (A. baumannii, E. faecium) |
| Megalocerin-1 3078251-56-3 |
거대 엘크(Megaloceros gigantescus) | 시토크롬 c 산화효소 서브유닛 3 | LIVCFFRQLKFHF | 8 μmol L-1 (A. baumannii, E. faecium) |
| Mylodonin-2 3078251-68-7 |
거대 나무늘보(Mylodon darwinii) | 아포지질단백질 B | KRKRGLKLATALS LNNKF | 32 μmol L-1 (E. coli) |
| Elephasin-2 3078251-59-6 |
직선 엄니 코끼리(Elephas antiquus) | ATP 합성효소 F0 서브유닛 8 | IFLHLKILKIIRLL | 1 μmol L-1 (A. baumannii, S. aureus, E. faecium) |
| Mammuthusin-2 3078251-49-4 |
시베리아 털북숭이 매머드(Mammuthus primigenius) | 멜라노코르틴-1 수용체 | RACLHARSIARLHK RWRPVHQGLGLK | 32 μmol L-1 (A. baumannii, E. faecium) |
| Equusin-1 3078251-35-8 |
그랜트얼룩말(Equus quagga boehmi) | 자연저항성 관련 대식세포 단백질 1 | FLKLRWSRFARVLL | 1 μmol L-1 (E. faecium) 4 μmol L-1 (A. baumannii, E. coli, P. aeruginosa) |
| Equusin-2 3078251-48-3 |
그랜트얼룩말(Equus quagga boehmi) | 비정상 방추상 소두증 관련 단백질 | KIYKKLSTPPFTL NIRTLPKVKFPK | 8 μmol L-1 (A. baumannii) |
몇몇 동일한 멸종 생물에서 유래한 펩타이드 쌍은 A. baumannii 및 P. aeruginosa와 같은 병원균에 대해 강한 상승 작용을 보였으며, A. baumannii의 경우 분할 억제 농도 지수(FIC index)가 0.38까지 낮게 나타났습니다.Equusin-1과 Equusin-3의 조합의 경우, 최소 억제 농도(MIC)가 4 μmol L-1에서 62.5 nmol L-1로 64배 감소하여, 가장 강력한 항생제의 MIC에 필적하는 서브마이크로몰 농도에 도달했습니다.
주목할 만하게도, Mammuthusin-2, Elephasin-2, Hydrodamin-1, Mylodonin-2, Megalocerin-1 등 주요 화합물은 피부 농양 또는 대퇴부 감염이 있는 생쥐 모델에서 잠재적인 항감염 활성을 나타냈습니다. 피부 농양 감염 모델에서 시험된 보다 활성이 높은 펩타이드(Elephasin-2 및 Mylodonin-2)는 널리 사용되는 항생제인 폴리믹신 B와 유사한 수준의 항균 활성을 보였습니다. 마찬가지로, Mylodonin-2 및 Elephasin-2는 생쥐 대퇴부 깊은 감염 모델에서도 폴리믹신 B와 비슷한 항감염 효능을 보여, 분자 복원이 항생제 발견의 유망한 접근법이 될 수 있음을 입증했습니다.
최근의 한 특허에서는 다중 작업 딥러닝 알고리즘 APEX를 활용하여 멸종된 단백질체로부터 유래한 항균 펩타이드를 식별하는 방법과, 식별된 41개의 항균 펩타이드, 그들의 상승 효과 및 작용 기전을 공개했습니다.
또한 개발된 머신러닝 도구인 panCleave 랜덤 포레스트 모델은 단백질체 전반의 절단 부위 예측을 수행하기 위해 범단백분해효소 절단 부위 분류기를 활용하여 계산 단백분해, 즉 인간 단백질의 in silico 소화 과정을 탐색했습니다. 이러한 머신러닝 접근법은 분자 복원에 적용되어, 고대 인류인 네안데르탈인과 데니소바인의 단백질체를 탐색했습니다. 그 결과, 여러 암호화된 펩타이드 항생제가 되살려졌으며, 이들은 시험관 내(in vitro) 및 전임상 생쥐 모델에서 항균 활성을 보였습니다.
항생제 분야의 잠재적인 돌파구
오늘날의 글라이코펩타이드 항생제의 조상 형태가 어떤 모습이었을지를 이해하기 위해, 연구자들은 생물정보학과 유전학적·생화학적 방법을 활용하여 고대 항생제 ‘팔레오마이신’을 되살렸습니다. 먼저, 팔레오마이신의 비리보솜 펩타이드 합성효소 조립 경로를 예측하고, 생합성 유전자 클러스터를 기반으로 한 가이드 트리를 구축했습니다. 이후, 합성생물학 기법을 사용해 예측된 펩타이드를 재구성하고, 그 항생제 활성을 검증했습니다.
이 연구는 합성생물학과 계산 기술의 결합을 통해 항생제의 시간적 진화 과정을 규명하고, 고대 분자를 잠재적으로 되살릴 수 있음을 입증했습니다. 또한 진화 과정에서 자연적으로 이루어진 최적화 전략이 오늘날의 글라이코펩타이드 항생제를 탄생시켰음을 보여주었으며, 향후 이 중요한 항균제 계열을 설계하기 위한 기초를 마련했습니다.
과학자들은 또한 네안데르탈인 카텔리시딘에서 새로운 항생제의 원천을 찾을 가능성도 탐구하고 있습니다. 카텔리시딘은 현생 인류에게도 존재하는 항균 펩타이드 계열로, 감염 방어에 중요한 역할을 합니다. 연구자들은 네안데르탈인과 데니소바인의 단백질체 및 유전체 데이터를 탐색할 수 있는 머신러닝 모델을 개발해, 고대 인류 유래 염기서열 중 항생제 후보로 유효할 가능성이 있는 염기서열을 예측하고 있습니다.
복원에서의 과제와 기회
분자 복원은 멸종한 동물을 되살려 현대 생태계에 재도입하는 것보다 물리적·윤리적 부담이 적은 접근법일 수 있습니다. 그러나 다음과 같은 여러 위험 요인이 존재합니다.
- DNA의 분해와 불완전한 유전체 데이터로 인해, 유전자의 완전한 복원이 어렵다는 점
- 되살린 분자의 기능적 불확실성, 즉 단백질의 접힘 오류, 번역 후 변형 문제, 독성, 면역원성 등의 가능성
- 유전자 침묵, 비표적 효과, 수평적 유전자 전달 등으로 인해 인위적으로 조작된 유전자가 생태계 내에서 통제 불가능하게 확산될 위험
- 멸종된 분자를 상업화해야 하는지에 대한 생명윤리적 논쟁
이러한 쟁점들을 올바르게 다루기 위해서는 과학계와 규제기관 간의 윤리적 프레임워크 구축과 협력이 필수적입니다. 과학적 측면에서도 여전히 해결해야 할 과제들이 존재하지만, 첨단 기술의 발전이 이를 극복하는 핵심 역할을 하고 있습니다. AI는 단백질의 접힘과 기능을 시뮬레이션하여 완전한 DNA 서열이 없어도 단백질 구조를 예측할 수 있으며, 신경망은 손상된 고대 DNA의 누락된 부분을 예측해 복원 정확도를 높입니다. 또한 CRISPR-Cas9과 염기 편집 기술은 고대 유전자를 의학적으로 안전한 형태로 인간화하는 데 활용될 잠재력을 가지고 있습니다.
분자 복원은 항생제 개발의 패러다임 전환을 이끌며, 아직 활용되지 않은 잠재적 항균 자원의 독특한 저장고를 제공합니다. 규모 확대와 규제 측면에서 여전히 과제가 남아 있지만, 초기 성공 사례들은 지구가 잃어버린 생물다양성이 항균제 내성 위기를 해결할 열쇠가 될 수 있음을 보여줍니다.
자세한 내용은 ACS Omega 게재 논문 '분자 고생물학과 신약 개발의 만남: 복원 항균제 사례(Molecular Paleontology Meets Drug Discovery: The Case for De-extinct Antimicrobials)'를 참고하세요.
참조:
2: https://www.nature.com/articles/s41551-024-01201-x?utm_source=acs&getft_integrator=acs







