脂質は、その生体適合性、汎用性、およびさまざまな治療薬をカプセル化する能力により、現代のドラッグデリバリー方法に欠かせないものになっています。生体膜の必須成分である脂質は、溶解性の低さ、バイオアベイラビリティの低さ、急速な分解、オフターゲット効果など、ドラッグデリバリーにおける重要な課題に対処する独自の物理化学的特性を備えています。この分野では、単純なリポソームから、固体脂質ナノ粒子(SLNs)や刺激応答性脂質などの高度のシステムに至るまで、近年、目覚ましい革新が見られました。
この成長を続ける研究分野において、研究はどの方向に進んでいるのでしょうか?ドラッグデリバリーシステム(DDS)の次のブレークスルーとなるのは、どのような脂質でしょうか?私たちは、脂質DDS研究の状況を完全に理解し、主要なトレンドと進展を特定するために、人手によって収集された最大の科学情報リポジトリである CAS コンテンツコレクションTMを徹底的に調査しました。その結果が私たちの新しいレポート、『Lipid-Based Drug Delivery Systems: Unlock the Future of Drug Delivery』です。このレポートでは、脂質ベースのシステムによるドラッグデリバリーの分野を発展させる最先端の研究を紹介しています。
ここでは、私たちが発見した、CAS コンテンツコレクションで最も頻繁に引用される脂質ベースのDDSの設計のスナップショットを示します。この分析は、どの脂質がDDS研究の主力であり、どの発見がより精密医療の限界を押し広げているかを示しています。
{{lipid-report="/new-components"}}
脂質DDSとは何ですか?
生体膜の基礎である脂質は、親水性および疎水性の両方の部分に対して顕著な親和性を示し、比類のない生体適合性と生物学的利用能を持っています。この固有の柔軟性により、単純なリポソームカプセル化から複雑な脂質ベースのナノ粒子に至るまで、多くの薬物送達モダリティで広く採用されています。実際、脂質ベースのDDSの最も顕著な利点のひとつは、低分子薬物、核酸、ペプチドなど、幅広い化合物をカプセル化できる能力です。
脂質二重層構造は、カプセル化された物質を保護し、酵素による分解や早期の除去から守るとともに、標的部位での制御された放出速度を可能にします。これらの特性により、脂質ベースのDDSは、COVID-19用のmRNAワクチンを含むワクチン、がん治療、遺伝子療法、および体内の複雑なシステムへの薬剤送達に使用されます。たとえば、一部の脂質ベースのDDSは、血液脳関門を通過して眼での薬物保持を高めることができるため、神経疾患の治療に使用されており、眼科疾患に有用です。
CAS コンテンツコレクションを分析した結果、過去20年間にわたり脂質DDS関連の出版物が着実かつ一貫して増加していることがわかりました(図1を参照)。2010年以降、脂質DDSに関する出版物は脂質関連の出版物全体を上回り、一貫して急速に成長しています。また、脂質DDS文書の特許対ジャーナルの比率は、脂質関連文書全体の同じ比率よりも高く、商業的関心が高いことを示しています。
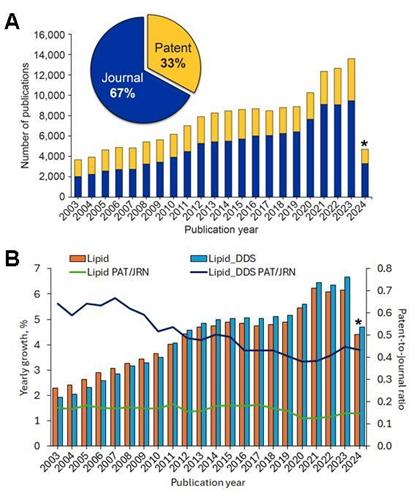
図1: (A)過去20年間(2003~2024年)における脂質ベースのDDSおよび関連研究のCAS データ。データにはジャーナル(青)と特許(黄)の出版物が含まれています。(B)脂質関連出版物全体(オレンジ)と脂質DDS関連出版物(青)の年間成長率(集合棒グラフ)と特許-ジャーナル比率(折れ線グラフ)の比較。*2024年のデータは一部であり、2024年1月から5月までのデータのみを含みます。出典:CAS コンテンツコレクション。
最近のmRNAワクチンの成功など、脂質DDSの継続的な革新により、この分野での注目が高まっていることは理解できます。新しいレポートのためにインデックスされた20万件以上の科学的な文書の分析に基づいて、これらのDDSの最も顕著なタイプのいくつかを探ってみましょう。
標的精度と薬効を高めるための脂質DDS設計
脂質DDSには、リポソームからミセル、エクソソームまで、多様な形態を含む幅広い種類があります。全文レポートでは、ウイルス様粒子や、エコー原性リポソームを含むリポソームの刺激応答系についてもレビューしています。ここでは、脂質DDSの最も注目すべきタイプをいくつか説明します。
リポソーム
リポソームは、文献中で最も注目されている脂質DDSの一種であり、その理由は明らかです。リポソームはナノキャリアの開発において基礎を築き、概念から臨床応用へと成功裏に進展した最初のナノ医薬品送達プラットフォームとなり、多くの承認された医薬品製剤が生まれました。
リポソームは20nmから約1000nmのサイズの1つまたは複数の脂質二重層で構成されており、親水性薬物と疎水性薬物の両方をカプセル化できます。親水性薬剤はリポソームの水性内部に内包され、疎水性薬剤は脂質二重層の炭化水素鎖領域に閉じ込められるため、リポソームは多用途で汎用性の高いドラッグデリバリープラットフォームとなります。
近年、ナノサイズのリポソームは二重の区画構造を持つように設計されており、これらは「コンセントリソーム」または「リポソーム・イン・リポソーム」と呼ばれています。各脂質二重層の組成を制御し、各区画内に内包する物質を指定することで、それぞれの二重層に異なる刺激応答性を持たせることが可能となり、これにより、2種類の薬剤を特定のタイミングで段階的に放出するマルチステージリリースが実現できるようになっています。
リポソームはその多様性から、小分子、タンパク質、遺伝子などのさまざまな種類の薬物のキャリアとして研究されてきました(図2を参照)。これらは、抗がん剤、抗炎症剤、抗生物質、抗真菌剤を送達するために、多くの臨床試験で使用されてきました。
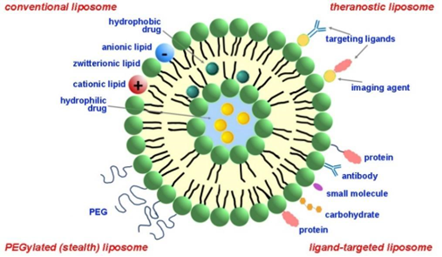
図2:様々な種類の医薬品リポソームを示す模式図。出典:CAS。
固体脂質ナノ粒子(SLN)およびナノ構造脂質キャリア(NLC)
すべてのリポソームは脂質ナノ粒子の一種と見なされますが、固体脂質ナノ粒子(SLN)およびナノ構造脂質キャリア(NLC)は次世代の脂質ナノキャリアです。これらは、リポソーム生産における有機溶剤、カプセル化効率の低さ、生産規模拡大の難しさといった問題に対処するために開発されました。
従来のリポソームは液晶脂質二重層で構成されていますが、SLNは固体脂質で構成され、NLCは固体脂質と液晶脂質の混合物です(図3を参照)。SLNとNLCの一般的なサイズは40〜約1000nmです。これらの高度なLNPは、物理的安定性が向上し、積載容量が増加し、貨物のバイオアベイラビリティが高まります。有機溶媒を使用せずに大規模に製造しやすく、他のLNPよりも滅菌耐性に優れています。さらに、固体状態での分子の移動性が制限されているため、SLNおよびNLCからの薬剤の放出をより正確に制御できます。
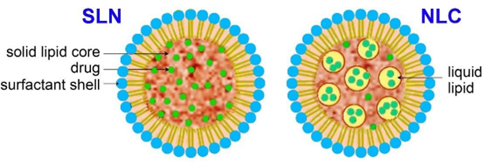
図3:固体脂質ナノ粒子(SLN)とナノ構造脂質キャリア(NLC)の模式図。出典:CAS。
SLNの最新の成功例は、最近承認されたファイザー/ビオンテックおよびモデルナによる2つのCOVID-19 mRNAワクチンにおけるデリバリーキャリアとしての利用です。これらのワクチンは、これまでにない速さで開発され、疾病予防において顕著な効果を示しています。これらの進歩は、SLNとNLCが新たなDDSのブレークスルーを推進する可能性を示しています。
リポプレックス
核酸は遺伝子療法薬として有望視されています。しかし、細胞への送達には大きな課題があります。核酸の負電荷と親水性により、細胞膜を介した受動拡散が阻害されます。さらに、核酸と血清タンパク質との結合、食細胞による取り込み、内因性ヌクレアーゼによる分解により、効果的な送達が妨げられます。したがって、核酸をより効率的に取り込むためには、送達ベクターが必要です。
リポプレックスとは、合成カチオン性脂質とアニオン性核酸が安定な複合体を形成するカチオン性LNPのことです。リポプレックスは、核酸を分解から保護し、細胞への取り込みを促進し、さらに細胞内で核や細胞質への輸送を助けることで、遺伝物質を効果的に細胞内へ送達します。その構造は、脂質とDNA/RNAの比率および脂質組成に応じて、球状の粒子からより複雑な多層ラメラ構造までさまざまです(図4を参照)。
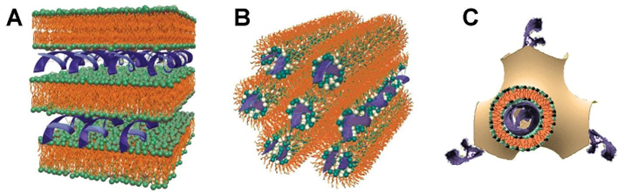
図4: (A)ラメラ構造、(B)六方晶構造、(C)立方構造のリポプレックスの模式図。出典: CAS。
正に帯電した脂質と結合すると、核酸が安定し、ヌクレアーゼ分解に対する耐性が高まり、標的細胞への送達が可能になります。核酸は、リポプレックスが細胞表面に吸着することで細胞に入り、続いてエンドサイトーシスして細胞内に放出されます。
細胞膜には通常負の電荷があり、リポプレックス脂質には正の電荷があるため、脂質担体の細胞膜への吸着と細胞膜との融合は静電的に駆動されます。それらの静電引力により、膜融合とエンドサイトーシスが引き起こされます。
カチオン性脂質との複合体からの核酸の放出は、細胞内への送達を成功させるために必要です。細胞膜のアニオン性脂質は、カチオン性脂質キャリアの電荷を中和し、脂質キャリアとカーゴ(核酸)との間の静電的相互作用を消失させることで、リポプレックスから核酸を放出するのを助けていると考えられます。さらに、アニオン性脂質をカチオン性脂質と混合することで、ナノ粒子の構造が乱れ、非ラメラ構造が形成されます。これにより、核酸の放出が促進されるという利点があります。
非層状脂質ナノ粒子
ドラッグデリバリーにおける非層状脂質相の使用、および吸入薬の送達用制御放出製剤における逆立方体および六方晶液晶相の使用に関する技術は、1980年代に初めて発表されました。これらは後に、次世代のナノメディシンのための有望な先進キャリアのクラスとして登場しました。そのユニークな構造特性と調整可能な特性により、有効性と特異性が向上した高度なDDSを開発するための有望な候補となっています。
キュボソームは、脂質の立方相から形成され、ポリマー由来の外部コロナによって安定化された安定性の高いナノ粒子であり、最近では脂質系医薬品ナノキャリアとして開発されました(図5参照)。
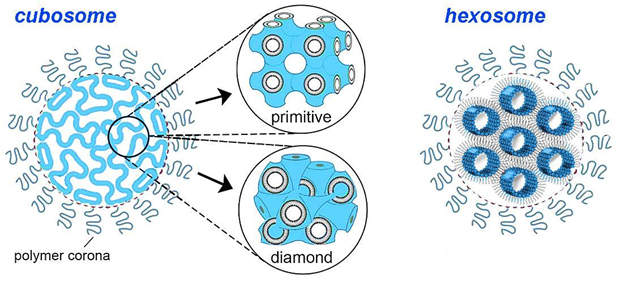
図5: 模式図:二連続二層キュービック相(プリミティブ(Im3m)型またはダイヤモンド(Pn3m)型)中の脂質からなるキューボソームナノ粒子(左)、逆六方晶相中の脂質からなるヘキソソーム・ナノ粒子(右)。出典:CAS。
自己組織化キュボソームは、発見以来、活性薬物送達手段として大きな注目を集めています。それらは相互接続された水路を備えた双連続立方体構造を持ち、薬物装填のための大きな表面積を提供します。疎水性、親水性、両親媒性の薬剤をカプセル化するのに適しており、表面改質して標的送達が可能です。
非層状LNPのその他の利点には、立方晶相の構造による高い薬物分散性、比較的単純な製造プロセス、生分解性、および生理活性剤の制御放出があります。
脂質ベースのDDSイノベーションの将来の展望
医薬品業界がより精密な医療アプローチへと進む中で、パーソナライズドDDSへの需要は今後も増加し続けるでしょう。SLNやNLC、その他のリポソームを含む、より高度なLNPシステムの開発は、標的型ドラッグデリバリーにおいて極めて重要な役割を果たします。これらのDDSは、がん治療や遺伝子治療に画期的な進歩をもたらす可能性があります。COVID-19ワクチンで見られたように、脂質DDS技術を用いることで、他のmRNAワクチンもより迅速に市場に投入できる可能性があります。
脂質DDS研究の現状と新たな進歩について詳しくは、当社のレポート「脂質ベースのドラッグデリバリーシステム:ドラッグデリバリーの未来を拓く」をご覧ください。脂質ベースのDDSの未来は明るく、世界中の患者にとって有望な発展を遂げています。