エグゼクティブサマリー
生殖補助医療(ART)は、生殖医療に革命をもたらし、人工授精から最先端の遺伝子編集に至るまでの方法を通じて、不妊に直面する何百万人もの人々に希望を提供してきました。現在、体外受精や顕微授精のような確立された技術が広く使用されていますが、体外配偶子形成(IVG)、遺伝子治療、幹細胞ベースの治療など新興テクノロジーにより、可能性の限界が押し広げられています。
ARTは急速に発展している分野ですが、人間における新興テクノロジーの使用は依然として非常に実験的であり、厳しく規制され、倫理的・法的課題とは切り離せません。ARTにおける多くのイノベーションは動物モデルでのみ試験されていますが、着床前遺伝子検査、ミトコンドリア置換療法、タイムラプスイメージング、体外成熟など、一部は人間への応用に成功しています。さらに、人工知能が生殖医療に変革をもたらし、高精度な胚選択、臨床プロトコルの最適化、治療結果の予測を可能にしています。
本レポートは、CASコンテンツコレクションTMのデータを調査して、ART研究の進展を概説し、主要な新興概念と課題を特定することで、ARTがどのように生殖医療の未来を形作っているかをより深く理解できるようにします。
ARTの現状:イントロダクション
生殖補助医療(ART)には、個人やカップルが不妊の課題を克服し、妊娠できるよう支援するために設計された幅広い医療技術が含まれます。不妊は世界中で約10〜15%のカップルに影響を及ぼしており、ARTは現代医療において重要な要素となっています。
ARTの処置では通常、受精と着床を実現するために卵子、精子、胚を取り扱います。現在、IVFや凍結保存といった技術が世界中の不妊治療クリニックで標準的な手法となっています。近年では、人工知能(AI)、遺伝子検査、幹細胞研究といった新興テクノロジーがARTをさらに進化させ、成功率を高めると同時に、倫理的・社会的な課題にも対処しています。さらに、体外配偶子形成(IVG)などの実験的イノベーションにより、配偶子を作ることができない人々に配偶子を提供できるようになる可能性もあります。
しかし、さまざまなARTイノベーションに倫理的な問題が残っており、多くは依然として動物モデルに大きく依存しています。このアプローチは生殖生物学やさまざまなART介入の効果について貴重な洞察を提供しますが、多くのイノベーションが人間での臨床使用にはまだ程遠いことを示しています。
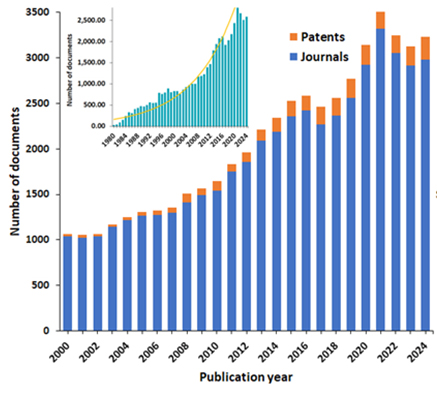
当社は、ART研究の進展を概説するために、人間がキュレーションした世界最大規模の科学情報のリポジトリであるCASコンテンツコレクションTMのデータを調査しました。2000年以降の文献の増加はこれらのイノベーションに対する広範な研究的・商業的関心を示しており、ART関連の文献数は過去20年間で3倍に増加しています(図1参照)。
現在の生殖補助医療の手法
不妊克服への取り組みには長い歴史があり、最初に記録された人工授精の事例は1790年にさかのぼります。ヒト卵母細胞の体外受精による最初の妊娠は1973年に達成されましたが、流産に終わりました。1978年には初めて体外受精による妊娠・出産が成功し、1980年代までには体外受精が主流となりました。
これまでに800万人以上の赤ちゃんが体外受精で誕生しており、ARTは現在、世界の生殖医療において確立された手法となっています。最も一般的な伝統的手法には以下のようなものがあります。
- 体外受精(IVF):人間の不妊治療の基盤であり、世界中で数百万件の出産を実現しています。IVFには、不妊治療薬を使用した卵巣刺激による複数の卵子の生成、軽度の外科的処置による成熟卵子の回収、実験室での卵子の受精、得られた胚の子宮への移植が含まれます。現在は臨床診療に完全に統合されており、卵管因子不妊、子宮内膜症、男性因子不妊、原因不明の不妊などへの適用が成功しています。成功率は年齢によって異なり、35歳未満では1サイクルあたり30〜40%と最も高くなっています。CASコンテンツコレクションの分析では、ART関連文献においてIVFが最も大きな割合を占めています(図2参照)。
- 人工授精:精子を女性の生殖器官に導入し、受精と妊娠を促す医療処置です。精子のサンプルを採取して洗浄・濃縮し、健康な精子を選別し、排卵期に子宮内(子宮腔内人工授精、IUI)または子宮頸部(子宮頸管内人工授精、ICI)に直接注入します。主に、軽度の男性不妊、原因不明の不妊、頸管粘液の問題があるケースに適用されます。IVFに比べて簡単で侵襲性も低い手法です。成功率は年齢や精子の質などにより異なりますが、通常1サイクルあたり10〜20%です。
- 配偶子卵管内移植(GIFT):卵子と精子を直接卵管内に配置することで女性の妊娠を助ける処置です。回収した卵子と精子を混合し、腹腔鏡を用いて卵管内に注入します。これにより、体内で自然に受精が起こります。IVFの進歩により、現在この方法はあまり行われていません。
- 接合子卵管内移植(ZIFT):IVFに似ていますが、受精卵(接合子)を子宮ではなく卵管に移植する点が異なります。健康な卵管を持つ不妊患者に適用されます。IVFとGIFTの利点を兼ね備えていますが、現在はあまり一般的ではありません。
- 凍結保存(生殖細胞保存):卵子、精子、胚などの生殖細胞を将来の使用のために冷凍保存する技術です。胚や精子の凍結保存はすでに日常的に行われており、卵母細胞の凍結保存も一般的になりつつあります。たとえば、がん患者の化学療法・放射線治療前の生殖能保存、IVFで余った胚の保存、あるいは個人的・職業的理由で妊娠を遅らせたい人々に利用されています。
- 卵子提供・精子提供:健康な卵子や精子を自分で作ることができない人々が子どもを産むのを助ける技術です。卵子や精子は第三者から提供され、IVFや子宮腔内人工授精のようなART処置で妊娠を目指します。この方法は、年配の女性、同性カップル、シングルペアレントに広く利用されています。
- 代理出産:女性が他の個人やカップルのために妊娠・出産を行う方法で、使用する卵子によって「妊娠型代理出産」と「従来型代理出産」に分けられます。従来型代理出産では、代理母自身の卵子が(IUIやIVFを通じて)受精するため、代理母が生物学的な母親となります。一方、妊娠型代理出産では、意図された親またはドナーの卵子と精子を用いてIVFで作られた胚を代理母の子宮内に移植して妊娠・出産するため、代理母は子供と遺伝的な関係を持ちません。
最も急速に成長しているART手法:AIと体外配偶子形成
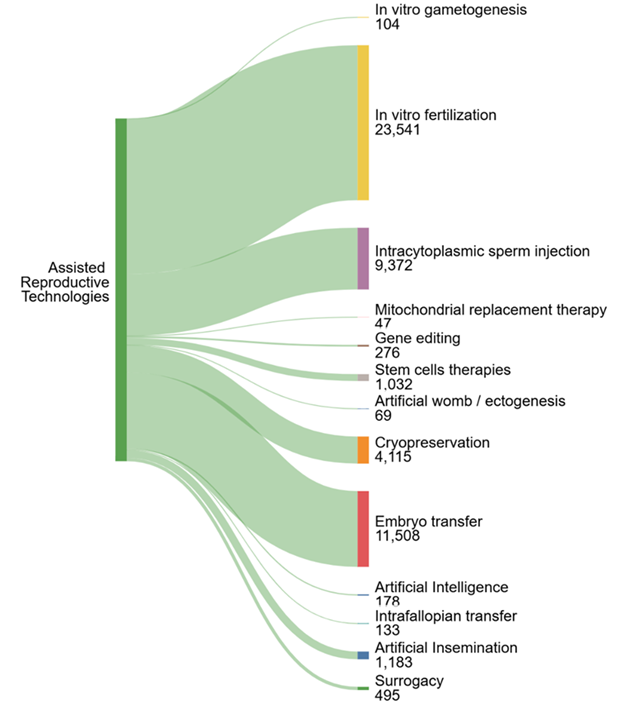
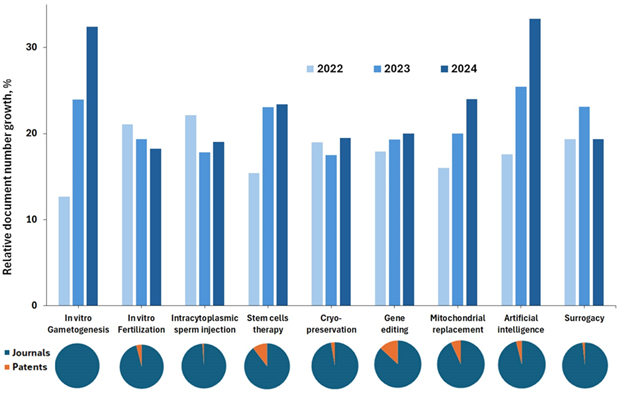
従来のART手法は画期的ではありましたが、高コスト、身体的・精神的負担、健康リスク、倫理的・法的問題といった多くの課題がありました。新しいイノベーションは不妊に悩む人々にさらなる希望をもたらしており、CASコンテンツコレクションの分析によれば、ARTにおけるAI活用と体外配偶子形成(IVG)が過去3年間(2022〜2024年)で最も急速に成長している新しい手法であることがわかりました(図3参照)。
ARTにおけるAI
胚の選択において、AIアルゴリズムは胚の画像を解析し、その質と着床成功の可能性を評価します。これらのアルゴリズムでは以下が使用されます。
- タイムラプスイメージング:胚の発育を経時的にモニタリングし、形態、細胞分裂パターン、動態などを評価します。
- 形態動態データ:人間の目では見えない微細な特徴を特定することで、胚が正常な妊娠に至る可能性を予測します。
AIはまた、運動性が高く形態的に正常な精子の特定や、精子のDNA断片化レベルを評価して最も健康な候補を選択するDNA完全性チェックにより、精子選択の改善にも役立ちます。
機械学習モデルは、患者の病歴(年齢、ホルモンレベル、生活習慣)、臨床データ(卵巣予備能マーカー、子宮内膜受容性)、胚の品質指標など、複数のデータポイントを解析し、IVFの成功率を予測します。AIは、患者ごとの反応に基づいて薬剤の投与量を個別化することで卵巣刺激プロトコルを最適化し、刺激に対する卵巣の反応を予測して、卵巣過剰刺激症候群(OHSS)のリスクを低減することができます。さらに、採卵や胚移植といった臨床介入の最適なタイミングを特定することはARTサイクルの成功に極めて重要であり、AI駆動モデルの導入によって顕著な改善効果がもたらされることが認められています。
分析の結果、2025年にはコーネル大学により機械学習やディープラーニングを用いて胚の倍数性を解析・予測する特許が取得されるなど、AI主導のイノベーションに関する特許が増加していることが明らかになりました。また、Univfy社は最近、IVFの失敗や中間的な治療結果の確率を評価するコンピュータ支援手法に関する特許を取得しました。
AI駆動の自動化は、ARTラボ内のプロセスを効率化します。具体的には、インキュベーターの条件の監視・制御、胚評価の標準化による人的ミスの最小化、凍結保存プロトコルの管理などが含まれます。クリニックや研究試験から得られる大規模データセットを活用し、ARTの成功に影響を与える傾向や要因を特定することで、AIは患者および胚データのパターンを認識し、治療プロトコルの改善に役立てることができます。このように、ARTにおけるAIの活用範囲は非常に広く、多くの患者において治療成果の向上が期待されます。
ARTにおけるIVG
IVGは実験段階のテクノロジーであり、皮膚細胞や血液細胞などの体細胞から精子や卵子を作り出すことを可能にします。IVGでは、胚性幹細胞(ESC)や人工多能性幹細胞(iPSC)などの多能性幹細胞(PSC)を配偶子へ分化させます。このプロセスは、始原生殖細胞が複雑な分子および細胞経路を経て成熟した配偶子に発達するという自然な配偶子形成の進行を模倣しています。重要なのは、自分で有効な卵子や精子を作ることができない人々に配偶子を提供できる可能性があることです。
研究者たちは、マウスを含む動物モデルで機能的な配偶子を作り出し、健康な子孫を得ることに成功しました。しかし、人間の配偶子形成は非常に複雑であり、重要な倫理的懸念もあるため、これらの技術を人間に応用するにはまだ課題が残っています。2024年には京都大学の科学者が人工多能性幹細胞(iPSC)から人間の配偶子の前駆体を作成しましたが、この技術を広く利用できるようになるまでには依然として大きなハードルが残っています。
最近のIVGの進展にもかかわらず、倫理的な懸念は依然として存在します。胚の作成や操作、つまり大量の胚を作成し廃棄する問題については、実施前に解決される必要があります。また、安全性と有効性についても、臨床応用前に広範囲にわたる検証が必要です。
最も商業的関心が高い手法:幹細胞療法と遺伝子編集
図3の下部にある円グラフに示されているように、遺伝子編集と幹細胞ベースの治療法はすべての文献の中で最も高い特許比率(それぞれ13%と10%)を示しており、商業的関心が高いことを示しています。
幹細胞ベースの治療法
幹細胞は、胚性幹細胞や人工多能性幹細胞などの生殖細胞型へ分化して卵母細胞や精子を形成することができ、パラクリンシグナルを分泌して組織修復や細胞機能を高め、さらに生殖組織に統合されて構造的および機能的な回復に寄与します。
ARTにおける幹細胞ベースの治療の応用は、多くのブレークスルーをもたらす可能性があります。
- 加齢による卵巣予備能の低下は、不妊の大きな原因です。間葉系幹細胞や骨髄由来幹細胞は、卵巣組織の再生、卵胞形成の改善、ホルモンバランスの回復において有望な結果を示しています。
- 幹細胞移植は、無精子症やその他の男性不妊における精子形成の回復に可能性を示しています。精原幹細胞(SSC)は採取・培養が可能であり、精巣に再導入することで精子産生を再開させることができます。
- アッシャーマン症候群や子宮内膜菲薄といった状態は、着床成功において大きな障害となります。子宮内膜の再生と受容性の向上において、子宮内膜幹細胞(ESC)やMSCが検討されています。
- 前述のとおり、多能性幹細胞からIVGを通じて配偶子(卵子や精子)を作り出すことは、生物学的親子関係の新たな可能性を開きます。
ARTで使用されるさまざまな幹細胞の種類を表1にまとめます。
| 幹細胞の種類 | 器官 | 適用対象 | 効果/刺激 |
|---|---|---|---|
| 脂肪組織由来幹細胞(ADSC) |
精巣 |
ラット |
|
|
卵巣 |
マウス、ラット |
||
|
臍帯由来幹細胞(UCSC) |
精巣 |
マウス |
|
|
子宮内膜 |
ヒト |
||
|
人工多能性幹細胞(iPSC) |
精巣 |
ヒト |
|
|
精原幹細胞(SSC) |
精巣 |
マカク |
|
|
卵原幹細胞(OSC) |
卵巣 |
マウス |
|
|
羊水(AFSC) |
卵巣 |
マウス |
|
|
骨髄(BMSC) |
卵巣 |
マウス |
|
|
胚性幹細胞(ESC) |
卵巣 |
マウス |
|
|
子宮内膜前駆細胞(EPC) |
子宮内膜 |
マウス |
表1:幹細胞の種類とARTへの応用
遺伝子編集
ARTにおける遺伝子編集には、遺伝性疾患の減少、胚選択の改善、生殖成功率向上の可能性があります。嚢胞性線維症、鎌状赤血球貧血、ハンチントン病といった遺伝性疾患に関連する胚の突然変異を修正し、将来の世代への伝達を防ぐことができます。ARTにおける遺伝子編集のもう1つの応用は、胚選択の改善です。遺伝子スクリーニングと編集を組み合わせることで、着床・発育成功の可能性が最も高い胚を選択し、胚の質を向上させることができます。また、染色体異常や配偶子機能に影響する突然変異といった不妊の遺伝的原因を特定・修正することで、不妊の解決にも貢献できます。
遺伝子編集で最も代表的なツールは、CRISPR-Cas9システムです。特定のDNA配列を標的とすることで、遺伝子の追加、削除、改変が可能となり、IVFで作成された胚における遺伝性疾患に対処するための貴重な技術となります。
しかし、この技術は、「デザイナーベビー」を生み出したり、予期せぬ結果をもたらしたりする可能性があるため、議論を呼んでいます。現在、人間における遺伝子編集、特に卵子・精子・胚に影響し、将来の世代に受け継がれる可能性のある生殖系列編集は、多くの国で厳しく制限または禁止されています。
最近、この分野でいくつか注目すべき特許が取得されています。たとえば、藤田学園は2024年、不妊治療のためにノンコーディングRNAを用いて胚の染色体異数性を検査する方法の特許を取得しました。このプロセスでは、体外で培養された胚を検査し、機械学習によって染色体異数性の有無を判定して細胞外RNAプロファイルを作成します。
ARTのさらなる新手法
CASコンテンツコレクションの分析により、ARTにおいて注目を集めつつある他のいくつかの新規手法が明らかになりました。
遺伝子スクリーニング
ARTにおける最も重要なトレンドの1つは、高度な遺伝子スクリーニング技術の統合です。着床前遺伝学的検査(PGT)はますます高度化し、着床前に胚の染色体異常や単一遺伝子疾患を検出できるようになっています。
- PGT-A(異数性スクリーニング)技術は、着床失敗や流産の主な原因である染色体異常をスクリーニングします。次世代シーケンシング(NGS)の進歩により、PGT-Aの精度と効率が高まり、IVFサイクルの成功率が向上しています。
- PGT-M(単一遺伝子疾患)は、特定の遺伝子変異を持つ胚を特定するために使用され、遺伝性疾患を持つカップルが健康な子どもを持つことを可能にします。CRISPR-Cas9やその他の遺伝子編集ツールの開発により、胚段階で遺伝子欠陥を修正できる可能性がさらに高まりました。
- PGT-SR(構造的再編成)検査は、染色体転座や逆位を持つ個人を対象として設計されており、バランスの取れた染色体構造を持つ胚を特定するのに役立ちます。
これらの進歩は、妊娠成功の可能性を高めるだけでなく、遺伝性疾患が引き継がれるリスクを減らし、生殖医療に対するより個別化されたアプローチを可能にします。
ミトコンドリア置換療法
ミトコンドリア置換療法(MRT)、別名ミトコンドリアドネーションは、母親から子どもへのミトコンドリアDNA(mtDNA)疾患の伝達を防ぐことを目的とした技術です。これは、卵子または胚内の欠陥のあるミトコンドリアを、ドナーから得た健康なミトコンドリアに置き換えることを意味します。
MRTを使用すると、母親、父親、そしてミトコンドリアドナーの3人の遺伝物質を持つ胚が作成されます(いわゆる「3人の遺伝的親」)。MRTには、遺伝子改変や将来世代への長期的な影響に関する倫理的懸念があります。しかし、この手法は遺伝的に関連する子どもを持ちたいミトコンドリア疾患の女性にとって有益です。このテクノロジーについては現在、国ごとに規制が異なり、厳しいガイドラインの下で許可される国もあれば、禁止されている国もあります。
MRTと遺伝子編集の間には、以下の表2に示すような重要な違いがあります。
| 特徴 | 遺伝子編集 | ミトコンドリア置換療法 |
|---|---|---|
|
標的 |
核DNA |
ミトコンドリアDNA |
|
適用範囲 |
幅広い(疾患、形質、生存性) |
特定(ミトコンドリア疾患のみ) |
|
倫理的懸念 |
デザイナーベビー、生殖細胞系列編集 |
3人の遺伝的親、アイデンティティの懸念 |
|
技術 |
CRISPR、塩基編集、プライム編集 |
前核移植(PNT)、母体紡錘体移植(MST)、極体移植(PBT) |
顕微授精(ICSI)
ICSIは、顕微操作ツールを使用して生きた精子を成熟卵子の細胞質内に直接注入するART手法です。受精卵はその後、IVFと同様に培養され移植されます。これはIVFの改良版であり、精子数の少なさ、運動性の低下、形態異常といった精子の問題によって引き起こされる男性不妊、または以前にIVFの試みが失敗した場合において、最も一般的かつ成功率の高い治療です。成功率はIVFと同程度ですが、男性不妊の症例において、ICSIは受精率を大幅に改善することができます。
胚培養システムの改良
たとえば、胚により良い微小環境を作り出す新しいタイプの培養プラットフォーム設計など、胚培養システムを改良する方法は多数あります。酸化的損傷を軽減し胚盤胞発生を改善する抗酸化物質を含む新しい培地配合や、静的培養ではなく動的な培地フローを用いる灌流型システムも研究されています。
タイムラプスイメージングや最適化された培養培地の進歩により、胚発生を継続的に監視することが可能となり、移植用胚の選択が改善され、着床率が向上します。
凍結保存技術の改善
ARTにおける凍結保存技術は、ガラス化と呼ばれる氷結晶形成を防ぐ急速凍結プロセスなど、いくつかの点で改善されおり、凍結された配偶子や胚の生存率を向上させます。また、改良・最適化された凍結保護剤も開発されています。たとえば蒸気タンクでは、組織を液体窒素に浸漬するのではなく、窒素の気相に保存することで、凍結卵子、精子、胚の生存率をより高めます。
生殖能力保存のイノベーション
卵巣組織凍結保存や人工卵巣開発などの技術は進歩しており、生殖能力に影響を与える医療処置を受ける人々に利益をもたらしています。卵巣若返り技術は、特に卵巣予備能が低下した女性や早発卵巣不全の女性において、卵巣を刺激して新しい卵子を産生させるために使用されます。これには、多血小板血漿(PRP)を卵巣に注入して組織修復と卵子生産を刺激する方法や、幹細胞を用いて卵巣組織を再生する方法が含まれます。この技術はまだ実験段階であり、初期研究では結果にばらつきがあります。
非侵襲的かつ自動化されたテクノロジー
タイムラプスイメージングは、胚を手作業で取り扱うことなく継続的に監視することで、胚選択を改善し、胚へのストレスを軽減します。自動化されたIVFシステムは、受精や胚移植といったプロセスの効率性と一貫性を高めるために研究室に導入されています。培養培地を利用するなど、侵襲的な生検ではなく非侵襲的な遺伝子検査によって胚の遺伝的健康状態を評価する方法も開発されており、リスクの最小化が図られています。
人工子宮
外部子宮(人工子宮)技術に関する研究は、人間の体外で胚を発生させることを目的としています。このようなテクノロジーは、医学的または解剖学的理由で妊娠を継続できない人々への解決策を提供するとともに、極めて早産の新生児を支援することで新生児ケアを進歩させます。
動物モデルにおけるART研究
多くのART手法は倫理的・法的懸念を引き起こすため、研究者はこれらの技術を開発し最適化するために動物モデルに依存しなければなりません。動物モデルは、人間との生物学的・生理学的類似性、ならびに種特異的な生殖過程を研究する上での役割から、ART研究において不可欠です。さらに、動物モデルは、生殖のメカニズムを研究し、新しいテクノロジーをテストし、ART介入の安全性と有効性を評価するための管理された環境を提供します。
ART研究で一般的に用いられる動物モデルには以下が含まれます。
- げっ歯類(マウスやラット):繁殖周期が短く、遺伝子操作が容易で、低コスト。
- 家畜(牛、羊、ヤギ):農業効率の向上や、絶滅危惧種への技術応用を通じた野生生物保全に貢献。
- 非ヒト霊長類:生殖生物学において人間に最も近いモデル。
- ゼブラフィッシュ:体外受精し、胚が透明であるため、初期胚発生の独自モデルを提供。
- 野生生物:遺伝的多様性の強化や個体群回復を通じて、地球規模の保全活動を支援。
動物モデルはART研究において引き続き不可欠であり、人間への応用が安全かつ有効であることを保証する架け橋としての役割を果たします。表3では、動物モデルと人間で使用されている技術を比較しています。
| 技術 | モデル動物 | ヒト |
|---|---|---|
|
IVFとICSI |
動物で完全に確立・最適化 |
臨床で広く使用されています |
|
遺伝子編集 |
研究や試験で一般的に使用 |
研究に限定、臨床での生殖細胞系列の利用はなし |
|
凍結保存 |
動物で十分に研究 |
臨床で日常的に使用 |
|
ミトコンドリア置換 |
動物で広範に試験済み |
一部の国では臨床使用を承認 |
|
人工子宮 |
羊で成功 |
前臨床段階、人間での応用なし |
|
IVG(幹細胞配偶子) |
マウスで機能的な配偶子を実現 |
まだ適用されていません |
課題と倫理的考慮事項
ARTの方法論は大きな可能性を秘めていますが、同時に独自の課題と倫理的考慮事項を伴います。さらに、多くの手法の長期的影響はいまだ不明であるため、安全性も考慮しなければなりません。その結果、これらのイノベーションを導入するにあたって数多くの懸念事項が生じています。
- 胚関連の倫理:必要以上に多くの胚を作成することは、余剰胚の扱いについて懸念を引き起こします。胚の廃棄を倫理的に問題視する人もいます。
- 親権と子どもの権利:卵子・精子ドナーや代理母の利用は、親権や遺伝的出自を知る子どもの権利に関する法的・感情的な複雑さをもたらします。亡くなった人からの配偶子や胚の使用は、同意や生まれる子どもの福祉について疑問を引き起こします。また、同性カップルや独身者のART利用には、社会的偏見や法的障壁が影響することがあります。
- 法的・規制上の問題:ARTの慣行や法律は国によって異なり、倫理的不整合を生じます。ARTの法規制が緩い国に渡航する人々が抜け道を悪用すると、倫理的監督や法執行が複雑になる可能性があります。ARTにおけるAIや遺伝子データの利用も、患者の機密保持や機微情報の悪用に関する懸念を引き起こします。
おそらく最も複雑な問題は、遺伝子およびテクノロジーに関する倫理です。ARTで使用されるCRISPRのようなテクノロジーは、意図しない結果、遺伝性の変化、人類の遺伝子を改変することの社会的影響に関する懸念を呼び起こします。実際、生殖細胞に加えられた変化は遺伝性を持ち、将来の世代に影響します。これは、将来世代がこれらの改変に同意できないという点で倫理的疑問を生じさせます。
遺伝子編集が治療目的以外の強化(知能、外見、運動能力の選択など)に利用され、社会的不平等や優生学的な実践につながるのではないかという懸念もあります。さらに、一部のグループは、人間のDNAを改変することは「神様気取りの行為」であり、自然のプロセスに干渉するものだと主張しています。
また、安全性の懸念に対しても、ARTのイノベーションを臨床現場で広く使用する前に対処しなければなりません。繰り返しになりますが、遺伝子編集については、長期的な結果やオフターゲット効果に関する十分なデータがないことが問題となります。意図しない突然変異は、個人や将来世代に深刻な影響を及ぼす可能性があり、臨床応用の前に潜在的な長期的影響を十分に理解することが重要です。CRISPRのような精密なツールであっても、時にゲノム内の意図しない場所に編集を加えることがあり(「オフターゲット効果」)、予期しない健康上の合併症につながる可能性があります。
規制当局は、遺伝子編集技術を安全かつ倫理的に利用するための枠組みを確立するため、科学界と協力しています。遺伝子編集の倫理的・法的・社会的影響について議論するために、一般市民を巻き込む緊急性が高まっています。世界保健機関(WHO)は、人間の遺伝子編集研究のグローバルレジストリとより厳格な監督を呼びかけており、ユネスコ国際生命倫理委員会は生殖細胞系列の編集に関する一時停止を勧告しています。
ARTに関する規則は国によって異なります。たとえば2023年、英国は鎌状赤血球貧血やベータサラセミアといった血液疾患の治療のためのCRISPRベースの療法を承認し、体細胞遺伝子編集における大きな前進を示しました。米国では生殖細胞系列の編集は禁止されてはいませんが厳しく制限されており、欧州諸国やオーストラリアを含む多くの国では、この実践は禁じられています。
ARTの未来
ARTに関する新興テクノロジーは、生殖医療の限界を押し広げ、不妊に直面する人々に希望をもたらす一方で、深い倫理的・社会的課題を提起しています。AIによる胚選択から体外配偶子形成(IVG)、遺伝子編集に至るまで、これらの進歩は親子関係の意味を再定義する可能性を秘めています。
しかし、これらのイノベーションを臨床実践に移すには、安全性、アクセスの公平性、倫理的課題を慎重に考慮し、公平で責任ある利用を保証する必要があります。ARTのイノベーションが動物モデルで成功を収めた後は、人間での臨床試験へと進みますが、これは小規模で慎重に監視された研究から始まります。タイムラプスイメージングやAIによる胚選択といったイノベーションはすでに、理論や動物ベースの研究から出発し、厳格な検証を経て人間への応用に移行してきました。
ARTを取り巻く問題は複雑であり、これらのさらなるブレークスルーを臨床現場に導入できるようになる前に、科学はまだ多くを学ばなければなりません。しかし、当社の分析が示すように、生殖技術における革新的なアプローチは希望の灯であり、科学的創意工夫の証です。