Resumen ejecutivo
Las infecciones fúngicas representan una amenaza importante y creciente para la salud mundial, ya que afectan a millones de personas cada año. Estas infecciones van desde afecciones superficiales, como el pie de atleta y la candidiasis oral, hasta enfermedades sistémicas graves y potencialmente mortales, como la candidiasis invasiva, la aspergilosis y la criptococosis.
Hay varios factores que están contribuyendo al aumento de la incidencia de las enfermedades fúngicas y las complicaciones del tratamiento. El cambio climático y las infecciones asociadas a la atención sanitaria están modificando los patrones de aparición, lo que aumenta la posibilidad de contraer infecciones fúngicas. El coste del desarrollo de nuevos fármacos también está ralentizando el proceso de búsqueda de nuevos tratamientos clínicos para estas infecciones. Aunque normalmente la investigación aumentaría en esta fase, estamos observando un estancamiento y un descenso de las publicaciones y los ensayos clínicos.
Afortunadamente, existen muchos enfoques innovadores para mejorar el tratamiento de las enfermedades fúngicas. La inteligencia artificial y la edición genética son nuevas opciones terapéuticas importantes. La reutilización de fármacos y las terapias combinadas aprovechan los medicamentos existentes para mejorar su eficacia. Los biomateriales y los métodos de administración mejorados también ofrecen nuevos enfoques potenciales. Con el renovado interés de los investigadores y la industria farmacéutica, podemos implementar avances en el tratamiento de las infecciones fúngicas y evitar el empeoramiento de la incidencia de estas infecciones en pacientes de todo el mundo.
Introducción: el creciente problema de las enfermedades fúngicas
Las enfermedades fúngicas constituyen una amenaza para la salud mundial importante, aunque a menudo pasada por alto, que afecta a aproximadamente 6,5 millones de personas al año y provoca más de 3,8 millones de muertes. A diferencia de la mayoría de las enfermedades infecciosas, las infecciones fúngicas se deben principalmente a la exposición ambiental, al crecimiento excesivo de comensales o a la reactivación de infecciones latentes. En 2022, la Organización Mundial de la Salud (OMS) publicó su primera clasificación de patógenos fúngicos en categorías de prioridad crítica, alta y media, lo que subraya el creciente reconocimiento de esta amenaza y tiene como objetivo centrar los esfuerzos de respuesta global en combatirla.
Múltiples factores están impulsando cambios epidemiológicos significativos en las enfermedades fúngicas. Los avances médicos modernos, por ejemplo, han creado efectos paradójicos: el uso profiláctico de antifúngicos ha reducido la incidencia de candidemia en determinadas poblaciones, al tiempo que ha favorecido el desarrollo de resistencias. El uso cada vez mayor de medicamentos inmunosupresores, regímenes quimioterapéuticos y antibióticos ha creado nuevas poblaciones de riesgo en aumento. La mejora de los tratamientos para enfermedades que antes eran mortales ha prolongado la supervivencia de los pacientes, lo que ha aumentado las posibilidades de que se desarrollen infecciones fúngicas. Además, el aumento del uso de dispositivos y procedimientos médicos invasivos ofrece nuevas vías para que los hongos comensales accedan a los tejidos y al torrente sanguíneo.
El cambio climático también está desempeñando un papel fundamental en la propagación de las enfermedades fúngicas (véase la figura 1). A medida que aumentan las temperaturas, regiones que antes eran inhóspitas para diversos hongos se están volviendo más adecuadas, lo que amplía su alcance a poblaciones que antes no estaban expuestas. Un ejemplo convincente de esta expansión del área de distribución impulsada por el clima es Coccidioides, el hongo responsable de la fiebre del valle. Históricamente confinado a los entornos cálidos y áridos del suroeste de Estados Unidos, México y partes de América Central y del Sur, este patógeno ha demostrado una preocupante migración hacia el norte. En 2015, los investigadores documentaron la presencia de Coccidioides en el estado de Washington, una región que antes se consideraba demasiado fría para que este hongo se estableciera.
Las temperaturas más altas también impulsan adaptaciones evolutivas en los hongos, lo que les permite desarrollar una mayor tolerancia al calor y superar la barrera térmica que históricamente ha protegido a los seres humanos de las infecciones fúngicas. Candida auris ejemplifica esta preocupante tendencia: en Estados Unidos, su prevalencia aumentó más de un 200 % entre 2019 y 2021.
Los desastres naturales provocados por el cambio climático, como las inundaciones y los incendios forestales, aumentan significativamente el riesgo de infecciones fúngicas. Las inundaciones crean entornos ideales para el crecimiento de hongos, ya que generan una humedad generalizada que es esencial para la germinación de las esporas. Los incendios aerosolizan las esporas fúngicas, que pueden viajar distancias significativas, exponiendo a poblaciones alejadas de los lugares originales del incendio. Este mecanismo ha desencadenado múltiples brotes de coccidioidomicosis entre los bomberos y las comunidades distantes.
El cambio climático no solo expone directamente a los seres humanos a más patógenos fúngicos, sino que también impulsa la resistencia a los antifúngicos debido al uso excesivo de estos tratamientos en los campos agrícolas. El aumento de las temperaturas potencia la virulencia de los hongos, lo que obliga a aplicar más fungicidas agrícolas para proteger los cultivos. Este uso generalizado de azoles agrícolas, especialmente en las regiones cálidas, se ha convertido en un factor crítico para el desarrollo de la resistencia.
Las investigaciones demuestran que la combinación del estrés térmico y la exposición a los azoles crea las condiciones ideales para acelerar la evolución de la resistencia en hongos patógenos como Aspergillus fumigatus, las especies de Candida y las especies de Cryptococcus. La reciente identificación de Rhodosporidiobolus fluvialis, capaz de provocar mutaciones inducidas por la temperatura, proporciona una prueba más de que el aumento de las temperaturas globales puede acelerar la evolución de la resistencia y la hipervirulencia en los hongos, lo que plantea retos importantes para el tratamiento clínico en nuestro clima cada vez más cálido.
Para complicar aún más la cuestión de las infecciones fúngicas, está la naturaleza de los fármacos antifúngicos, que pueden causar efectos no deseados y dañar al hospedador (es decir, al paciente). Las células fúngicas comparten muchas similitudes con las células humanas, lo que dificulta el desarrollo de fármacos antifúngicos que actúen selectivamente sobre el patógeno fúngico.
Esto ha limitado el número de clases de fármacos antifúngicos disponibles, y solo unos pocos agentes, como los polienos, los azoles, las equinocandinas y las alilaminas, constituyen la base del tratamiento antifúngico. Cada clase se dirige a componentes celulares fúngicos específicos, como la membrana celular (por ejemplo, el ergosterol) o la pared celular (por ejemplo, el β-glucano), pero su uso suele verse limitado por cuestiones como la toxicidad, las interacciones entre medicamentos y la aparición de resistencias.
Por último, estos retos se ven agravados por el hecho de que el desarrollo de nuevos fármacos antimicóticos es costoso y lleva mucho tiempo. Como veremos, el interés comercial por los nuevos antifúngicos se ha estancado en los últimos años, lo que puede agravar una situación ya de por sí preocupante, ya que la amenaza de las enfermedades fúngicas sigue evolucionando. Por lo tanto, se necesitan nuevos enfoques, como sistemas avanzados de administración de fármacos, reutilización de fármacos y otros.
Principales clases de antifúngicos
El desarrollo de los antifúngicos modernos comenzó a mediados del siglo XX con la introducción de los polienos. En la década de 1980, los azoles surgieron como una alternativa más segura y disponible a los polienos. El desarrollo de azoles de segunda generación, como el fluconazol (1990) y el itraconazol (1992), supuso un avance significativo. El fluconazol se utilizó ampliamente para tratar la candidiasis y la meningitis criptocócica, especialmente en pacientes con VIH/SIDA.
El siglo XXI trajo consigo la introducción de las equinocandinas, una nueva clase de fármacos antimicóticos que actúan sobre la síntesis de la pared celular fúngica. Estos fármacos ofrecían un nuevo mecanismo de acción y eran eficaces contra las cepas resistentes a los azoles. El aumento de la resistencia a los antimicóticos, especialmente en Candida auris, ha puesto de relieve la urgencia de desarrollar nuevos tratamientos para contrarrestar estas amenazas en constante evolución. La FDA ha aprobado recientemente el ibrexafungerp, el primer fármaco de una nueva clase de antifúngicos llamados triterpenoides, para el tratamiento de la candidiasis vulvovaginal.
Esta autorización supuso un hito importante en el desarrollo de fármacos antifúngicos, pero la aparición de resistencia a los antifúngicos, junto con el coste y el tiempo que requieren los ensayos clínicos, son obstáculos para el desarrollo de nuevos fármacos. A continuación, resumimos las cinco clases principales de antifúngicos que existen actualmente en el mercado —polienos, azoles, equinocandinas, análogos de pirimidina y alilaminas— incluyendo los nuevos avances:
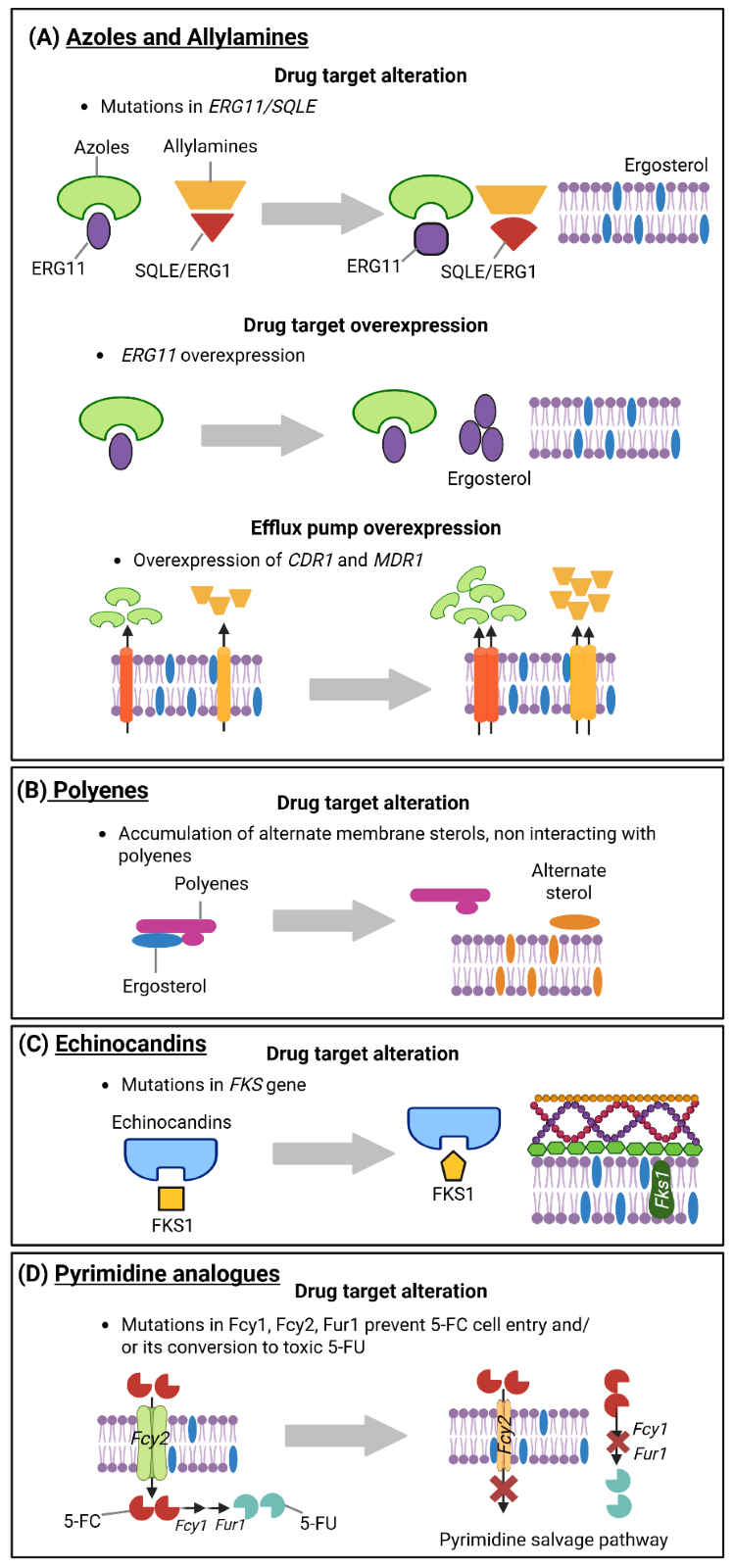
- Los polienos son productos naturales que consisten en grandes macrólidos cíclicos derivados de la bacteria Streptomyces. Se unen al ergosterol de las membranas celulares fúngicas y actúan mediante un modelo de formación de poros, lo que compromete la integridad de las membranas celulares. Son antifúngicos de amplio espectro con una baja propensión a desarrollar mecanismos de resistencia, pero no pueden utilizarse para infecciones fúngicas sistémicas, excepto la anfotericina B. Tienen una solubilidad en agua limitada, lo que conduce a una biodisponibilidad muy baja. Recientemente, el nuevo derivado del polieno, la mandimicina, que actúa como antifúngico dirigiéndose a los fosfolípidos en lugar del ergosterol, ha demostrado una actividad fungicida de amplio espectro contra muchos patógenos multirresistentes.
- Los azoles son moléculas pequeñas que presentan un sistema de anillos triazólicos o imidazólicos. Interrumpen la biosíntesis del ergosterol al inhibir la enzima 14α-lanosterol desmetilasa (CYP51) dependiente del citocromo P450 fúngico. La mejora de la biodisponibilidad de los azoles permite su administración oral y el tratamiento de infecciones fúngicas sistémicas, pero se ha desarrollado resistencia a estos fármacos, lo que ha dado lugar a una disminución de su eficacia. Entre los avances recientes con los azoles se incluyen la finalización del ensayo clínico de fase II con opelconazol en 2024; el ensayo clínico de fase III en curso con opelconazol en combinación con otros antifúngicos sistémicos; y la autorización de la FDA para el oteseconazol en 2022.
- Las equinocandinas son derivados semisintéticos de productos naturales aislados de cepas fúngicas. Actúan inhibiendo la β-1,3-D-glucano sintasa para comprometer la integridad de la pared celular fúngica. Las equinocandinas, un antifúngico de amplio espectro, tienen una toxicidad mínima y pocos casos de resistencia a los medicamentos, pero deben administrarse por vía intravenosa. En 2023, la FDA autorizó el medicamento Rezafungin.
- Los análogos de la pirimidina son antimetabolitos que interfieren en la síntesis de ácidos nucleicos. Su mecanismo de acción consiste en convertir la 5-fluorocitosina en 5-fluorouridina monofosfato catalizada por enzimas fúngicas, lo que provoca una síntesis proteica defectuosa cuando se incorpora al ARN fúngico. Estos fármacos tienen un espectro de actividad limitado y la resistencia a sus propiedades antifúngicas está aumentando. Sin embargo, en 2024 se identificaron y desarrollaron nuevos derivados de pirimidina mediante cribado de alto rendimiento.
- Lasalilaminas son un grupo terciario de alilamina que provoca actividad antifúngica. Actúan mediante la inhibición enzimática, lo que provoca la acumulación de escualeno y la interrupción de la síntesis de ergosterol, lo que afecta a la integridad de la membrana celular fúngica. Estos fármacos tienen una actividad antifúngica de amplio espectro, pero la resistencia a ellos está reduciendo su eficacia.
Mecanismos de resistencia antifúngica
El principal reto del tratamiento antifúngico es la aparición de resistencia a los fármacos. Esta resistencia es una característica en evolución que permite a los hongos sobrevivir a pesar de la presencia de agentes químicos dañinos. En un periodo de profundos cambios medioambientales a nivel mundial, solapamiento entre agentes antifúngicos vegetales y animales, y aumento de las poblaciones en riesgo, los hongos patógenos están desarrollando resistencia a todos los fármacos antifúngicos sistémicos autorizados.
Por ejemplo, el uso de fungicidas triazólicos en los Estados Unidos se cuadruplicó entre 2006 y 2016, y las tendencias en el uso de fungicidas azólicos se correlacionaron con el fuerte aumento de las infecciones por Aspergillus fumigatus resistentes a los azoles en los seres humanos. Se prevé que el uso de fungicidas aumente como consecuencia del cambio climático y la consiguiente necesidad de aplicaciones más concentradas y frecuentes para compensar la pérdida de productividad debida a las condiciones meteorológicas extremas.
La presencia de catéteres permanentes, válvulas cardíacas artificiales y otros dispositivos quirúrgicos también puede contribuir a las infecciones refractarias, ya que los organismos infecciosos se adhieren a estos objetos y establecen biopelículas que resisten la acción de los fármacos. Las biopelículas presentan una estructura tridimensional organizada compuesta por una densa red de células de levadura y filamentosas incrustadas en una matriz exopolimérica de carbohidratos, proteínas y ácidos nucleicos. Las biopelículas fúngicas muestran una mayor tolerancia a los fármacos debido a varios factores, entre los que se incluyen su matriz de sustancias poliméricas extracelulares, sus tasas de crecimiento más lentas, la presencia de células persistentes, el intercambio de material genético y las interacciones sinérgicas en las células de la biopelícula.
Sin embargo, las formas más comunes de resistencia adquirida implican mutaciones en los sitios de unión a proteínas diana. Este mecanismo es típico entre las cepas resistentes a los azoles de las especies de Candida como Candida albicans, Candida tropicalis y Candida parapsilosis, así como en las especies de Aspergillus resistentes a los azoles. La figura 2 resume los mecanismos de resistencia en las cinco clases principales de antifúngicos:
Las tendencias de investigación en antifúngicos revelan la necesidad de identificar nuevos tratamientos
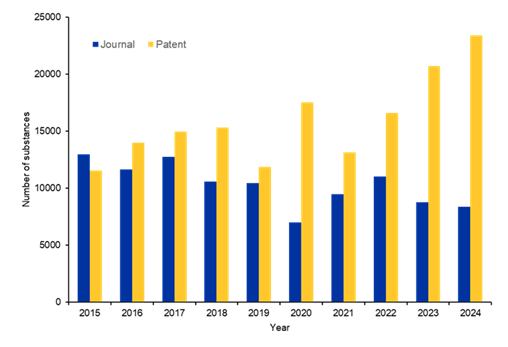
Analizamos la CAS Content CollectionTM, el mayor repositorio de información científica catalogado por humanos, para comprender mejor cómo está abordando la comunidad científica el problema de las infecciones fúngicas. Descubrimos que, aunque las publicaciones han aumentado en los últimos 20 años, las cifras se están estabilizando e incluso disminuyendo, una tendencia preocupante dado el aumento de la resistencia a los medicamentos antimicóticos existentes (véase la figura 3).
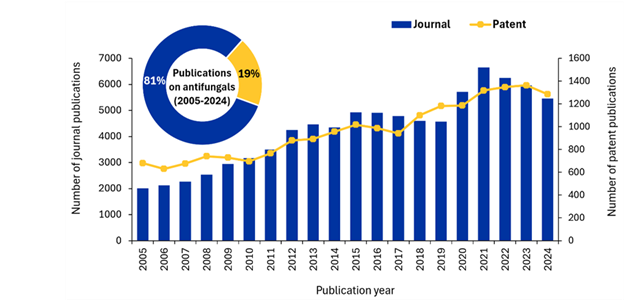
Las publicaciones en revistas muestran una trayectoria ascendente constante, desde aproximadamente 2000 publicaciones en 2005 hasta casi 6600 en su punto álgido en 2021. Se observó un aumento gradual inicial (2005-2012), un período de estabilización en torno a las 4500-5000 publicaciones anuales (2013-2019) y un aumento espectacular que alcanzó niveles sin precedentes en 2020-2021, seguido de un descenso moderado hasta 2024.
Las publicaciones de patentes siguen una trayectoria algo diferente, aunque mantienen una tendencia general al alza. Sin embargo, en los últimos años se observa un ligero descenso de las patentes, lo que sugiere que, aunque ha aumentado el interés académico, siguen existiendo importantes retos para traducir esos descubrimientos en terapias antifúngicas comercialmente viables. La disparidad se acentúa aún más por la distribución de los resultados de la investigación, ya que las patentes solo representan el 19 % del total de publicaciones, frente al 81 % que corresponde a las revistas.
Como se ha señalado, la OMS clasificó los patógenos fúngicos prioritarios en tres grupos en función de su impacto en la salud pública y la necesidad de investigación y desarrollo: prioridad crítica, alta y media. Los patógenos fúngicos de prioridad crítica son las amenazas más urgentes debido a su alta morbilidad, mortalidad y resistencia a los antifúngicos. Afectan principalmente a personas inmunodeprimidas, como las que padecen VIH/SIDA, cáncer o las que han recibido un trasplante de órganos. Entre ellos se incluyen Candida auris, Cryptococcus neoformans, Aspergillus fumigatus y Candida albicans.
Los patógenos fúngicos de alta prioridad también suponen amenazas importantes, pero se consideran menos urgentes que el grupo crítico. Provocan infecciones graves y presentan patrones de resistencia emergentes. Entre ellos se incluyen los agentes causantes del eumicetoma, así como Histoplasma, Fusarium y varias especies de Candida.
Los patógenos fúngicos de prioridad media son importantes, pero actualmente tienen un impacto menor en la salud pública en comparación con los grupos críticos y de alta prioridad. Aun así, requieren atención debido a su potencial para causar enfermedades graves.
Analizamos la atención que se ha prestado a la investigación de diversos patógenos fúngicos prioritarios designados por la OMS en bibliografía y patentes entre 2005 y 2024 (véase la figura 4). Dentro del grupo crítico, Candida albicans domina el foco de la investigación con aproximadamente 16 000 publicaciones, casi cuatro veces más que la atención prestada a Aspergillus fumigatus (unas 4000 publicaciones), mientras que Cryptococcus neoformans y Candida auris reciben una cobertura sustancialmente menor a pesar de su designación crítica.
Este análisis reveló que la investigación está distribuida de forma desigual entre las amenazas fúngicas, ya que ciertos patógenos como Candida albicans reciben atención, mientras que otros patógenos prioritarios críticos de la OMS siguen estando muy poco estudiados a pesar de su importancia para la salud pública.

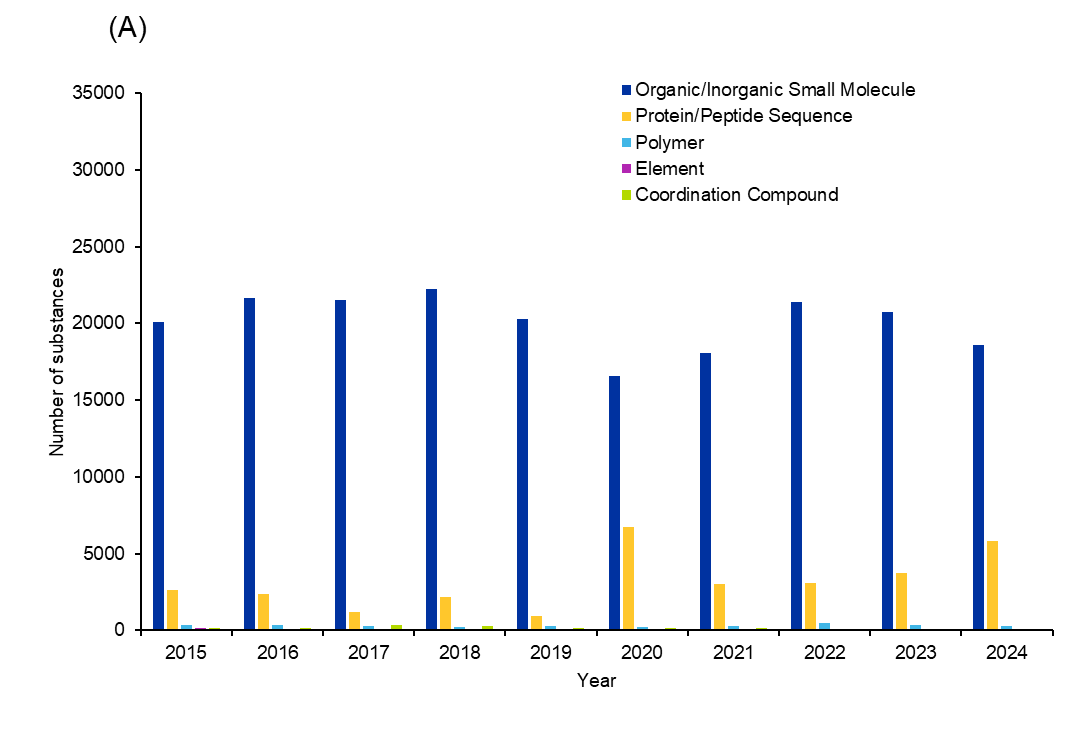
Analizamos más a fondo las publicaciones de los últimos 10 años de la CAS Content Collection para comprender qué sustancias se están investigando en los antifúngicos. El análisis de las sustancias se limitó a las funciones relevantes, incluyendo las terapéuticas (THU), farmacológicas (PAC) o farmacocinéticas (PAK). El número de sustancias por año muestra una tendencia al alza a partir del año 2021 (véase la figura 5).
Una investigación más detallada de las clases de sustancias indica que las moléculas pequeñas orgánicas e inorgánicas, las secuencias de proteínas/péptidos, los polímeros, los elementos y los compuestos de coordinación son las principales clases exploradas en los antifúngicos (véase la figura 6).
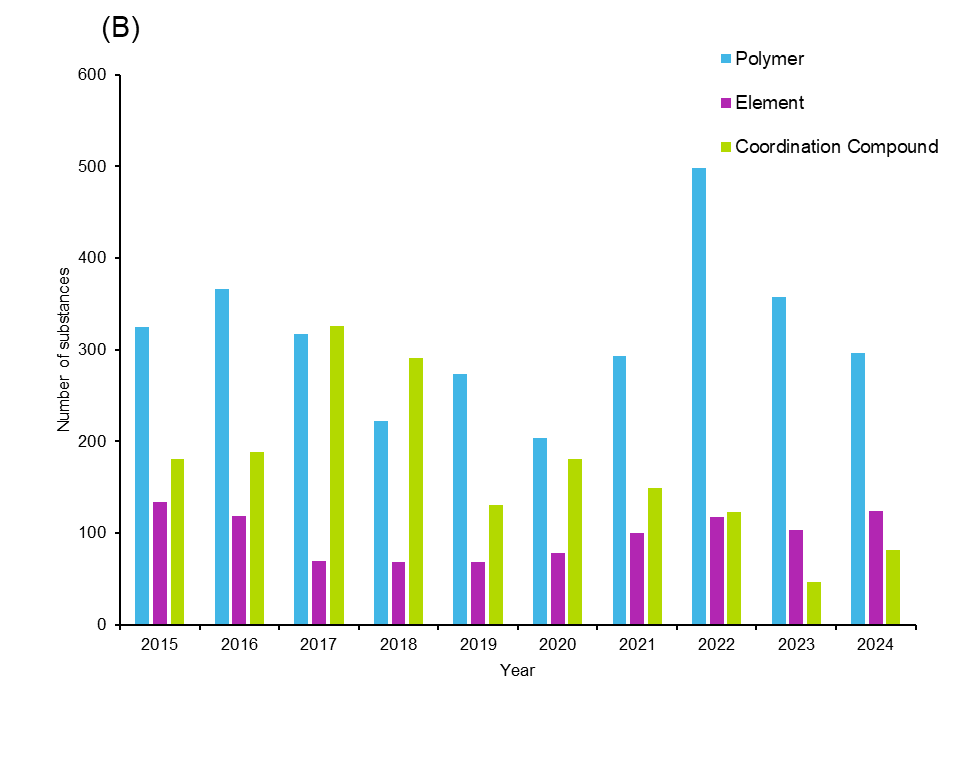
Los polímeros son una categoría interesante de sustancias, ya que los polímeros o los hidrogeles basados en polímeros pueden utilizarse como agentes de administración de fármacos o pueden actuar ellos mismos como antifúngicos. Los polímeros naturales como el quitosano y la celulosa, y los polímeros sintéticos como el alcohol polivinílico, el polietilenglicol y el ácido poliacrílico, son los más comunes en los antifúngicos. Aunque estas sustancias representan una pequeña fracción del total, hemos observado una tendencia de interés creciente que alcanzó su punto álgido en 2022. Esto sugiere que las sustancias y materiales no convencionales están siendo objeto de un interés más intencionado para la terapia antifúngica.
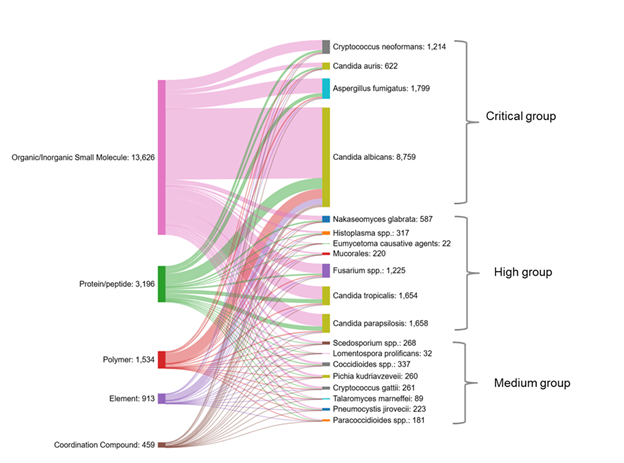
También examinamos las coocurrencias entre diversas clases de sustancias y diferentes especies de hongos en la bibliografía (véase la figura 7). Las especies de hongos se ordenan aquí según la clasificación de la OMS: grupo crítico, grupo alto y grupo medio. Candida albicans tiene el número máximo de sustancias que coocurren con ella, seguida de Candida tropicalis, Candida parapsilosis y Aspergillus fumigatus.
Las moléculas pequeñas orgánicas/inorgánicas coexisten con mayor frecuencia con las especies de Candida y Aspergillus fumigatus. Tres patógenos del grupo de alta prioridad y dos patógenos del grupo de prioridad media tienen muy pocas sustancias que coexisten con ellos (menos de 100), lo que indica la necesidad de identificar nuevos agentes que puedan actuar contra estos patógenos.
Ralentización de los ensayos clínicos
Si las publicaciones relacionadas con los patógenos fúngicos se están estancando o incluso disminuyendo, ¿qué significa eso para los ensayos preclínicos y clínicos de tratamientos antifúngicos? Al examinar la actividad de los candidatos preclínicos contra los grupos prioritarios de patógenos fúngicos de la OMS, es obvio que la mayoría de los fármacos tienen actividad contra múltiples especies de hongos (véase la tabla 1). Por ejemplo, en el grupo crítico, 19 fármacos tienen actividad contra Candida albicans, 15 contra Candida auris, 12 contra Aspergillus fumigatus y ocho contra Cryptococcus neoformans.
|
Grupo prioritario de la OMS |
Patógeno |
Candidatos preclínicos |
|
Crítico |
Aspergillus fumigatus |
12 |
|
Candida auris |
15 |
|
|
Candida albicans |
19 |
|
|
Cryptococcus neoformans |
8 |
|
|
Alto |
Histoplasma spp. |
5 |
|
Candida parapsilosis |
9 |
|
|
Candida tropicalis |
8 |
|
|
Fusarium spp. |
3 |
|
|
Mucorales |
5 |
|
|
Nakaseomyces glabratus (Candida glabrata) |
3 |
|
|
Agentes causantes del eumicetoma |
2 |
|
|
Medio |
Cryptococcus gattii |
5 |
|
Pichia kudriavzeveii (Candida krusei) |
2 |
|
|
Scedosporium spp. |
3 |
|
|
Lomentospora prolificans |
2 |
|
|
Paracoccidioides spp. |
4 |
|
|
Coccidioides spp. |
6 |
|
|
Talaromyces marneffei |
5 |
|
|
Pneumocystis jirovecii |
4 |
Tabla 1: Niveles de prioridad de la OMS, patógenos fúngicos y número de candidatos preclínicos con actividad contra ellos. Fuente: CAS, información disponible públicamente.
En cuanto a los ensayos clínicos, la mayoría (71 %) de los efectuados en los últimos 20 años han concluido. En la figura 8 se puede observar que el número de ensayos ha oscilado a lo largo de los años, con una tendencia actual a la baja. En la última década, la FDA de EE. UU. solo ha aprobado ocho fármacos antifúngicos. Actualmente, solo cuatro candidatos a fármacos se encuentran en ensayos clínicos de fase III.
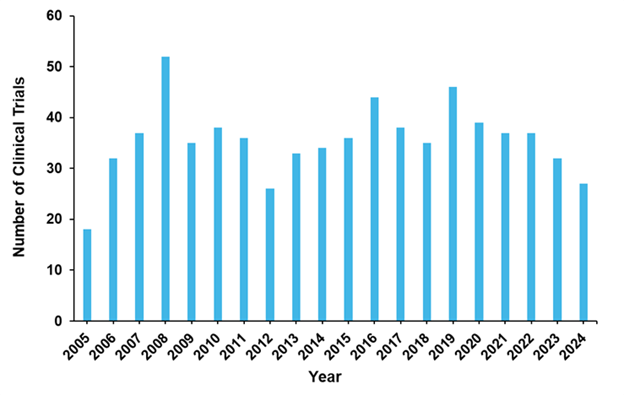
De los casi 100 ensayos clínicos activos en curso, solo el 18 % evalúa agentes novedosos en lugar de medicamentos reutilizados o reformulados. Como se observa en la tabla 2, 12 de estos medicamentos son moléculas pequeñas, cinco son terapias con péptidos biológicos y uno es un microorganismo vivo.
|
Intervención |
Promotor, ubicación |
Activo contra |
|||
|
A. fumigatus |
C. auris |
C. albicans |
C.neoformans |
||
|
Azoles |
|||||
|
†HCP-02 (Fase I) |
HC Synthetic Pharmaceutical, China |
y |
y |
y |
n |
|
†VT 1598 (Phase I/NCT04208321) |
Mycovia Pharmaceutical, Estados Unidos |
y |
y |
y |
y |
|
†Opelconazole (Fase III/NCT05238116) |
Pulmocide, Reino Unido |
y |
n |
y |
n |
|
Basado en péptidos |
|||||
|
BAL-2062 (Fase I) |
Basilea Pharmaceuticals, Suiza |
y |
n |
n |
n |
|
Occidiofungin B (Fase I) |
Sano Chemicals, Estados Unidos |
n |
y |
y |
n |
|
§PL-18 (Fase I/NCT05340790) |
Protelight Pharmaceutical, China |
n |
y |
y |
n |
|
Novexatin (Fase II) |
NovaBiotics, Reino Unido |
n |
y |
y |
n |
|
**Pezadeftida (Fase II) |
Hexima, Australia |
n |
y |
y |
n |
|
Polienos |
|||||
|
§SF-001 (Fase I) |
Elion Therapeutics, Estados Unidos |
y |
n |
n |
n |
|
*BSG005 |
Biosergen, Suecia |
y |
y |
y |
y |
|
Equinocandina |
|||||
|
*HRS9432 (Fase II/NCT06194201) |
Jiangsu Hengrui Pharmaceuticals, China |
n |
y |
y |
n |
|
Gepix |
|||||
|
§Fosmanogepix (Fase III/NCT05421858) |
Amplyx Pharmaceuticals, Estados Unidos |
y |
y |
y |
n |
|
Orotomida |
|||||
|
†Olorofim (Fase III/NCT05101187) |
F2G, Reino Unido |
y |
n |
n |
n |
|
Triterpenoide |
|||||
|
†SCY-247 (Fase I) |
Scynexis, Estados Unidos |
y |
y |
y |
n |
|
Otros |
|||||
|
Zambon antifúngico (Fase I) |
Zambon Pharmaceutical, Italia |
Actividad no reportada |
|||
|
§ATB1651 (Fase II/NCT06327295) |
AmtixBio, Corea |
n |
n |
n |
n |
|
BGY-1601 (Fase II/NCT06450990) |
Nexbiome Therapeutics, Francia |
n |
y |
y |
n |
|
WXSH0102 (Fase II/NCT06771063) |
Cisen Pharmaceutical, India |
n |
y |
y |
n |
|
TY-1801J (Fase III/CTR20231279) |
Kaken Pharmaceutical, China |
Actividad no reportada |
|||
†inhibidor de la síntesis de la pared celular fúngica
§disruptor de la membrana de la pared celular fúngica
*disruptor de la pared celular fúngica
**disruptor mitocondrial
Tabla 2: Agentes antifúngicos activos en fase de ensayo clínico con su fase de ensayo clínico, clase/modo de acción, CAS RN, patrocinador, identificador y actividad fúngica crítica según la OMS. Fuente: CAS, información disponible públicamente.
Investigadores que exploran más enfoques terapéuticos para nuevos antifúngicos
El aumento de los hongos resistentes a los medicamentos, junto con los cambios medioambientales y las oportunidades de infección a través de los entornos sanitarios, es problemático. El hecho de que estos factores converjan en un momento en el que las publicaciones de investigación y los ensayos clínicos sobre tratamientos antifúngicos se están ralentizando es igualmente preocupante. Sin embargo, esto también significa que existen importantes oportunidades para nuevos avances.
Como muestra nuestro análisis, existen muchas opciones prometedoras para nuevas terapias, que van desde el reexamen de los fármacos existentes para determinar su eficacia antifúngica hasta la terapia génica de vanguardia y los sistemas de administración de fármacos. La figura 9 resume estos enfoques:

Identificacar nuevas dianas fúngicas
Las terapias antifúngicas tradicionales suelen dirigirse a la pared celular o la membrana de los hongos, como los azoles que se dirigen a la síntesis de ergosterol o las equinocandinas que inhiben la β-glucano sintasa. Un área crítica de la nueva investigación es la identificación de nuevas dianas en los patógenos fúngicos para desarrollar fármacos contra dichas dianas.
- Dirigirse a los polisacáridos de la pared celular fúngica:
- Síntesis de β (1,6)-glucano: el β(1,6)-glucano es un componente crucial de las paredes celulares fúngicas. Sin embargo, nuestro conocimiento limitado de la síntesis de β (1,6)-glucano ha complicado el desarrollo de antifúngicos dirigidos a este componente. El derivado de piridobenzimidazol D75-4590 (CAS RN 384376-42-5) ha demostrado bloquear la función de Kre6 en Candida albicans (uno de los genes importantes en la síntesis de β(1,6)-glucano).
- Biosíntesis de la quitina: existe un enlace covalente entre la quitina y el β (1,3)-glucano que forma la capa estructural de la pared celular, lo que la convierte en una atractiva diana farmacológica. Sin embargo, las redundancias estructurales y funcionales de la quitina sintasa (Chs) han complicado el desarrollo de dianas biosintéticas de la quitina. Las nikkomicinas son péptidos naturales que inhiben las enzimas Chs y han demostrado actividad antifúngica. Otros compuestos, como los nuevos derivados de amino-4-hidroxicumarina sustituidos en la posición 3, mostraron una actividad inhibidora de moderada a excelente contra la proteína Chs.
- Dirigirse a las proteínas de la pared celular fúngica:
- Síntesis del anclaje de glicosilfosfatidilinositol (GPI): el anclaje GPI es un resto de glicolípido que une muchas proteínas de la pared celular a la membrana plasmática. La biosíntesis de los anclajes GPI implica una vía compleja con múltiples pasos enzimáticos. La Gwt1, una manosiltransferasa que interviene en las primeras etapas de la biosíntesis del anclaje GPI, es la diana del fosmanogepix (E1210/APX001, CAS RN 2091769-17-2), un nuevo agente antifúngico de amplio espectro que ha demostrado su eficacia contra el Aspergillus y otros hongos filamentosos y que se encuentra en la fase clínica avanzada de desarrollo.
- Biosíntesis de manoproteínas: las manoproteínas, proteínas altamente glicosiladas, forman la capa más externa de la pared celular de la levadura y desempeñan un papel crucial en la adhesión, la formación de biopelículas y la interacción con el sistema inmunitario del hospedador. La inhibición de su síntesis o modificación podría alterar la integridad de la pared celular y exponer los componentes subyacentes de la pared celular a los fármacos antifúngicos o al sistema inmunitario del hospedador. Las pradimicinas se unen al manano y alteran la pared celular de los hongos, y presentan una baja toxicidad in vivo. Un derivado de la pradimicina, el BMS-181184 (CAS RN 139272-69-8), ha demostrado actividad in vitro contra Cryptococcus neoformans, especies de Aspergillus, otras especies de Candida y mohos.
- Dirigirse a la membrana celular fúngica:
- Biosíntesis del ergosterol: los antifúngicos azólicos inhiben la enzima citocromo P450 CYP51, lo que provoca el agotamiento del ergosterol y la acumulación de intermediarios esterólicos tóxicos, alterando la función de la membrana. Se están desarrollando nuevos azoles, como el VT 1598 (CAS RN 2089320-99-8), para superar la resistencia a los azoles conocidos. Este compuesto también muestra una selectividad mejorada para el CYP51 fúngico frente a las enzimas citocromo P450 humanas, lo que podría reducir las interacciones entre fármacos y la toxicidad.
- Síntesis de glicoesfingolípidos: los glicoesfingolípidos son componentes importantes de las membranas fúngicas que intervienen en la señalización celular, el crecimiento y la virulencia. La inhibición de enzimas como la inositol fosforilceramida sintasa, que no existe en los seres humanos, podría proporcionar una estrategia antifúngica selectiva.
- Proton ATPasas: Estas enzimas unidas a la membrana mantienen el gradiente electroquímico a través de la membrana plasmática, esencial para la absorción de nutrientes y la supervivencia celular. Se están explorando las características específicas de los hongos de estas ATPasas para su inhibición selectiva.
- Dirigirse a los procesos intracelulares: varias vías y procesos intracelulares que son esenciales para la supervivencia y la virulencia de los hongos difieren significativamente de sus homólogos en los mamíferos, lo que los convierte en prometedoras dianas para el desarrollo de fármacos antifúngicos:
- Respiración mitocondrial
- Absorción de sideróforos
- Biosíntesis de pirimidina
- Biosíntesis de riboflavina
- Ciclo del glioxilato
- Vía de la calcineurina
- Plegamiento de proteínas
- Vía de síntesis de aminoácidos
Mejora de los fármacos existentes
- Formulaciones nuevas o mejoradas: una estrategia clave es crear formulaciones intravenosas (IV) de fármacos que ya están disponibles en formulación oral. Las formulaciones IV tienen una mejor biodisponibilidad y son útiles en casos de infección grave. Por ejemplo, el posaconazol, que inicialmente estaba disponible en forma de suspensión oral, se ha reformulado en comprimidos y en forma IV.
- Terapia combinada: otro enfoque para combatir la creciente resistencia a los antifúngicos y el limitado arsenal de medicamentos antifúngicos es el uso de combinaciones sinérgicas de los antifúngicos existentes. Las combinaciones sinérgicas se producen cuando dos o más medicamentos actúan conjuntamente para producir un efecto mayor que la suma de sus efectos individuales. Esta estrategia no solo mejora la eficacia antifúngica, sino que también reduce la probabilidad de que se desarrolle resistencia. La combinación de fármacos que actúan sobre diferentes vías fúngicas puede interrumpir múltiples procesos esenciales simultáneamente, lo que dificulta que los hongos desarrollen resistencia. Un ejemplo de ello es la combinación de azoles con equinocandinas.
Reutilización de fármacos
Con el aumento de los patógenos fúngicos multirresistentes y la limitada oferta de nuevos fármacos antifúngicos, la reutilización de fármacos existentes para la actividad antifúngica ofrece una alternativa prometedora. Dado que los fármacos reutilizados ya han sido sometidos a exhaustivas pruebas de seguridad, el tiempo y el coste necesarios para el desarrollo preclínico y clínico inicial se reducen considerablemente. Además, la farmacocinética, la toxicidad y los efectos secundarios de los fármacos existentes están bien documentados, lo que minimiza el riesgo de efectos adversos inesperados. Algunos ejemplos de fármacos reutilizados con actividad antifúngica son los antidepresivos como la sertralina, los fármacos contra el cáncer como el tamoxifeno y los antibióticos como la doxiciclina.
En el caso de muchos de los fármacos que se están reutilizando, se desconocen las dianas fúngicas precisas, por lo que se necesitan más estudios para identificarlos. Técnicas como el análisis transcriptómico y los ensayos genéticos avanzados ayudarán a descubrir las dianas y sentarán las bases para el desarrollo de nuevos fármacos antifúngicos.
Inteligencia artificial
La inteligencia artificial (IA) se ha convertido en una poderosa herramienta en la investigación antifúngica, ya que ofrece la posibilidad de acelerar la identificación de nuevos compuestos antifúngicos, optimizar el diseño de fármacos y predecir los mecanismos de resistencia. Aprovechando el aprendizaje automático, el aprendizaje profundo y otras técnicas de IA, los investigadores pueden analizar grandes conjuntos de datos, descubrir patrones ocultos y hacer predicciones que serían imposibles con los métodos tradicionales.
- Modelización predictiva: las herramientas basadas en IA pueden contribuir a identificar nuevos compuestos antifúngicos y a comprender las interacciones entre los fármacos y sus dianas. Algunos ejemplos incluyen el uso de redes neuronales artificiales para predecir las propiedades antifúngicas de las sales de amonio cuaternario contra Candida albicans. Además, se espera que herramientas predictivas como AlphaFold 3 (AF3) enriquezcan la biología estructural de las dianas antifúngicas.
- Cribado de alto rendimiento: el aprendizaje automático, especialmente el aprendizaje profundo, ha demostrado ventajas significativas en el descubrimiento y desarrollo de fármacos al acelerar el cribado de alto rendimiento. Un estudio reciente identificó fármacos que pueden reutilizarse como antifúngicos con un alto grado de confianza utilizando métodos basados en el aprendizaje automático.
- Diseño de fármacos de novo: los modelos generativos, incluidas las redes generativas adversarias profundas (GAN), han mostrado resultados prometedores en el diseño de fármacos de novo mediante la creación de estructuras moleculares novedosas con las propiedades deseadas. La IA ha contribuido de manera significativa a acelerar el desarrollo de péptidos antifúngicos (AFP) al combinar enfoques de aprendizaje profundo con estudios QSAR.
- Análisis de datos ómicos: la IA puede analizar datos genómicos, transcriptómicos y proteómicos de hongos para identificar posibles dianas farmacológicas y mecanismos de resistencia. Los datos ómicos suelen ser complejos y voluminosos, lo que plantea varios retos que pueden abordarse con la IA. Algunas aplicaciones de la IA en el análisis de datos ómicos incluyen la reducción de la variabilidad de los datos, la reducción del ruido y la integración de datos.
Edición de genes basada en CRISPR/Cas
Las repeticiones palindrómicas cortas agrupadas y espaciadas regularmente (CRISPR) y las proteínas asociadas a CRISPR (Cas) han transformado la ingeniería genética, ofreciendo una precisión, eficiencia y versatilidad sin precedentes. Descubierta originalmente como parte del sistema inmunitario bacteriano, la tecnología CRISPR-Cas se ha adaptado para su uso en muchos organismos, incluidos los hongos. El sistema CRISPR-Cas9 más utilizado para la edición del genoma en hongos es el sistema Cas9 de tipo II, reconocido por su alta especificidad y eficiencia.
Sin embargo, existen varias limitaciones en la tecnología CRISPR/Cas para la edición de genes fúngicos. Los hongos tienen paredes celulares y estructuras complejas que pueden dificultar la administración de herramientas de edición genética. Las diferentes especies de hongos requieren enfoques personalizados para la optimización de codones, la selección de promotores y los sistemas de entrega. Por ejemplo, en muchas especies de Candida, la secuencia de nucleótidos CTG para las células humanas no es eficaz en estas especies.
Las especies de hongos también muestran variaciones en sus mecanismos de reparación del ADN, que se basan en la reparación dirigida por homología (HDR) o en la unión de extremos no homólogos (NHEJ). Esta variabilidad afecta a la eficacia de las herramientas de edición genética. La estabilidad y la integración de los plásmidos y vectores pueden suponer un reto. Algunas especies requieren vectores linealizados (por ejemplo, Candida albicans y Crytococcus neoformans), mientras que otras se benefician de plásmidos episomales o complejos ribonucleoproteicos (Candida glabrata, Aspergillus fumigatus y Mucorales).
La edición genética basada en CRISPR/Cas en hongos se encuentra todavía en una fase preliminar y, en la actualidad, no hay estudios clínicos que evalúen su potencial en el tratamiento de las infecciones fúngicas. Sin embargo, múltiples estudios preclínicos han ampliado nuestro conocimiento sobre la patogenicidad de los hongos y los mecanismos de resistencia. Morio et al. demostraron que, en la Candida orthopsilosis, ciertas mutaciones del CoERG11 confieren resistencia a los azoles. Rybak et al. demostraron que la sobreexpresión de CDR1 contribuye de manera significativa a la resistencia clínica a los triazoles en Candida auris. En otro estudio, se identificaron los genes que contribuyen a la supervivencia de los hongos bajo el estrés de las equinocandinas utilizando la edición genética basada en CRISPR/Cas en Aspergillus fumigatus.
Las futuras investigaciones sobre la aplicación de CRISPR/Cas en hongos seguirán proporcionando información útil que conducirá a una comprensión más completa de este complejo género y, en última instancia, ayudarán a desarrollar nuevos antifúngicos.
Péptidos antifúngicos
Los péptidos antifúngicos (AFP) son pequeños péptidos catiónicos que exhiben una fuerte actividad antifúngica contra varios hongos patógenos, lo que los convierte en candidatos potenciales para el desarrollo de nuevos agentes antifúngicos. Los AFP presentan varias ventajas con respecto a los antifúngicos convencionales, como una cinética de eliminación rápida, una menor tendencia al desarrollo de resistencias y diversos mecanismos de acción. Los AFP se clasifican normalmente en función de su origen: naturales, semisintéticos y sintéticos. APD3 es una base de datos muy utilizada con fines de investigación que recoge péptidos antimicrobianos procedentes de diversas fuentes. En abril de 2025, se habían registrado 1550 péptidos antifúngicos, de los cuales 932 eran péptidos anticándida.
- Péptidos naturales: los AFP naturales se descubrieron al probar su actividad antagonista in vitro contra hongos patógenos. Sin embargo, métodos más nuevos, como los basados en plantillas, las simulaciones de acoplamiento y otros métodos basados en secuencias, son cada vez más comunes para la predicción in silico de nuevos AFP. Analizamos las publicaciones presentes en la CAS Content Collection relacionadas con terapias antifúngicas e identificamos las defensinas como los AFP naturales más estudiados.
- Péptidos semisintéticos y sintéticos: el objetivo de crear péptidos semisintéticos y sintéticos es mejorar las propiedades farmacológicas, como la estabilidad y la biodisponibilidad, reduciendo la toxicidad y/o la inmunogenicidad de los péptidos naturales. Las relaciones estructura-actividad (SAR) son cruciales para el diseño y el desarrollo de estos AFP.
Inmunoterapia
La compleja interacción entre el sistema inmunitario del hospedador y los patógenos fúngicos invasores determina el resultado de la infección. Este conocimiento ha fomentado la exploración de enfoques de inmunoterapia para el tratamiento de las infecciones fúngicas. Se están explorando diversas modalidades inmunoterapéuticas, como las terapias con citocinas, los inhibidores de puntos de control, la transferencia adoptiva de células y las vacunas, como posibles opciones de tratamiento antifúngico. El objetivo de su uso es modular la respuesta inmunitaria del hospedador para mejorar la eliminación de los patógenos fúngicos y, por lo tanto, mejorar los resultados del tratamiento.
Nuevos fármacos candidatos
Existen numerosas clases de antifúngicos fuera de las cinco principales que se están investigando, algunas de las cuales se descubrieron hace décadas y otras son nuevas. Por ejemplo, la miriocina se descubrió por primera vez en la década de 1970, pero se está estudiando en combinación con antifúngicos conocidos, como el flucanazol. Los investigadores están explorando productos naturales como la khafrefungina y la rustmicina, y pequeñas moléculas como la PQA-Az-13 también han mostrado resultados prometedores.
Los sistemas innovadores de administración de fármacos pueden mejorar la eficacia antifúngica
Los vectores de administración de fármacos antifúngicos son sistemas o métodos utilizados para transportar los agentes antifúngicos al lugar de la infección en el organismo. Estos vectores tienen como objetivo mejorar la eficacia, reducir los efectos secundarios y mejorar la administración dirigida de los fármacos antifúngicos. La especificidad de los vectores de administración de los fármacos antifúngicos es crucial para maximizar la eficacia terapéutica y minimizar los efectos secundarios. Los diferentes sistemas de administración de fármacos (DDS) se adaptan a las propiedades fisicoquímicas de los fármacos antifúngicos y a la naturaleza de la infección fúngica.
- Liposomas: son vesículas esféricas compuestas por una bicapa fosfolipídica que puede encapsular fármacos hidrófilos e hidrófobos. Entre sus ventajas se incluyen una mayor solubilidad y estabilidad del fármaco, una menor toxicidad al dirigirse a tejidos específicos y una liberación prolongada del fármaco. Entre los fármacos antifúngicos ejemplares en formulaciones liposomales se incluyen la anfotericina B, el fluconazol y la nistatina.
- Nanopartículas: son partículas diminutas (1-100 nm) que pueden fabricarse a partir de diversos materiales, como lípidos, polímeros y metales. Sus ventajas son una mejor administración del fármaco en lugares específicos, una mayor biodisponibilidad, una liberación controlada y una reducción de los efectos secundarios. Entre los fungicidas ejemplares administrados mediante nanopartículas se incluyen el fluconazol, el itraconazol y el voriconazol. Las nanopartículas lipídicas sólidas son una clase prometedora de partículas de tamaño submicrónico que muestran una mayor estabilidad, así como una toxicidad reducida y una mayor selectividad. Los nanotubos de carbono (CNT) son otra plataforma prometedora para la administración de fármacos antifúngicos.
- Micelas: son estructuras autoensambladas formadas por moléculas anfifílicas en soluciones acuosas. Sus principales ventajas incluyen una mayor solubilidad de los fármacos hidrófobos, la administración dirigida y una toxicidad sistémica reducida.
- Niosomas: son vesículas basadas en tensioactivos no iónicos similares a los liposomas. Sus ventajas son una mayor estabilidad en comparación con los liposomas, así como una liberación controlada y sostenida del fármaco.
- Dendrímeros: son estructuras muy ramificadas, similares a árboles, con un alto grado de funcionalidad superficial. Presentan una alta capacidad de carga de fármacos, una orientación precisa y una liberación controlada.
- Microemulsiones: son mezclas estables e isotrópicas de aceite, agua y tensioactivo. Presentan una mayor solubilidad y absorción de los fármacos, así como una mejor biodisponibilidad.
- Hidrogeles: son redes tridimensionales de polímeros hidrófilos que pueden hincharse en agua. Son adecuados para aplicaciones tópicas y mucosas, para la liberación sostenida y localizada de fármacos.
- Ciclodextrinas: son oligosacáridos cíclicos que pueden formar complejos de inclusión con fármacos. Mejoran la solubilidad y la estabilidad de los fármacos, reducen la irritación y mejoran la biodisponibilidad.
Los materiales antifúngicos combaten las infecciones asociadas a la asistencia sanitaria
Las infecciones fúngicas en entornos sanitarios, a menudo denominadas infecciones asociadas a la asistencia sanitaria, son un motivo de gran preocupación. Como se ha señalado, los procedimientos médicos invasivos y el uso de dispositivos médicos implantados crean puntos de entrada y superficies para que los patógenos fúngicos colonicen y formen biopelículas. Candida albicans, Aspergillus fumigatus y otros hongos oportunistas son los causantes habituales, especialmente en personas inmunodeprimidas.
El desarrollo de biomateriales antifúngicos tiene como objetivo combatir estas infecciones previniendo la adhesión inicial de los hongos y la formación de biopelículas o administrando agentes antifúngicos directamente en el lugar de la posible infección. Estos materiales representan un campo en expansión en la intersección entre la ciencia de los materiales y la ingeniería biomédica, y ofrecen soluciones innovadoras para combatir las infecciones fúngicas.
Hemos analizado la CAS Content Collection en relación con los materiales antifúngicos de los últimos 20 años. Se observa un aumento constante en las publicaciones de revistas y patentes (véase la figura 10). Sin embargo, el crecimiento de los documentos es casi diez veces superior al de las patentes, que solo es de aproximadamente el triple. Además, hemos identificado los principales patógenos fúngicos mencionados en estas publicaciones. Como se muestra en la figura 10B, Candida albicans fue el patógeno más común, seguido de tres especies de Aspergillus y, por último, Candida glabrata.


Los materiales antifúngicos convencionales que se han utilizado ampliamente incluyen nanopartículas, polímeros e hidrogeles. Entre las nanopartículas, los metales son los más estudiados, como las nanopartículas de plata, que alteran las membranas celulares fúngicas, interfieren en los procesos metabólicos y generan especies reactivas de oxígeno.
Los polímeros, tanto naturales como sintéticos, constituyen la base de muchos biomateriales. Una estrategia habitual consiste en incorporar agentes antifúngicos o modificar la estructura del polímero para conferirle propiedades antifúngicas. Los polímeros pueden cargarse con fármacos antifúngicos y utilizarse para tratar infecciones superficiales crónicas. Los hidrogeles son otra forma emergente de biomateriales. Su biocompatibilidad, flexibilidad y capacidad para encapsular fármacos los hacen ideales para apósitos para heridas y recubrimientos de catéteres.
El campo de los biomateriales antifúngicos está en constante evolución con la exploración de nuevos materiales con propiedades únicas, por ejemplo, estructuras metalorgánicas (MOF), puntos cuánticos, líquidos iónicos y vidrios bioactivos. Estas innovaciones podrían suponer importantes avances en el tratamiento, pero aún es necesario evaluar su eficacia y seguridad a largo plazo en ensayos clínicos. La fabricación de estos materiales también debe ser rentable y escalable para que estas innovaciones puedan tener un uso clínico más amplio.
Futuras direcciones para los tratamientos antifúngicos
El desarrollo de fármacos antifúngicos está cambiando rápidamente debido al aumento de la prevalencia de las infecciones fúngicas, el auge de las cepas resistentes a los fármacos y el arsenal limitado de agentes antifúngicos eficaces. A pesar de la exploración de nuevos enfoques, como la identificación de dianas específicas para los hongos, la inmunoterapia, la terapia combinada y otros, el desarrollo clínico de terapias antifúngicas ha sido lento. Durante la última década, solo ocho fármacos antimicóticos han sido autorizados por la FDA, y solo cuatro fármacos candidatos se encuentran actualmente en ensayos clínicos de fase III.
Esto se atribuye a varios retos, entre los que destacan los elevados costes de desarrollo, las complejas interacciones entre el hospedador y los hongos y la necesidad de comprender los patógenos emergentes en un clima cada vez más cálido. Por lo tanto, el futuro de la terapia antifúngica será un enfoque multifacético que combine el descubrimiento de nuevos fármacos, tecnologías avanzadas y una comprensión más profunda de la biología de los hongos y la inmunidad del hospedador.
Las estrategias innovadoras, como la inmunoterapia, la nanotecnología y el descubrimiento de fármacos impulsado por la inteligencia artificial, son muy prometedoras para hacer frente a la creciente carga de las infecciones fúngicas. La colaboración entre investigadores, médicos y empresas farmacéuticas es esencial para superar los retos actuales y mejorar los resultados de los pacientes.
Para obtener más información sobre las terapias antifúngicas, consulte nuestra publicación en un servidor de preimpresión.