Há mais de 100 mil pessoas nos EUA na lista de espera de um transplante de órgão. Em 2024, foram realizados quase 48 mil transplantes de órgãos e, embora esse número represente um crescimento impressionante nesses procedimentos que salvam vidas, ainda está muito abaixo da necessidade geral. À medida que a população global envelhece, esse descompasso entre os órgãos disponíveis e os pacientes necessitados continuará aumentando.
No entanto, órgãos de animais doadores podem ser a solução. Conhecido como xenotransplante, o procedimento tem uma longa história que remonta ao início do século 20, mas problemas imunológicos e rejeições de órgãos impediram que esses transplantes fossem bem-sucedidos. Com o advento da tecnologia de edição genética, especificamente CRISPR-Cas, os pesquisadores estão cada vez mais aptos a lidar com questões de imunocompatibilidade. Eles estão cada vez mais perto de tornar corações, rins e outros órgãos e tecidos disponíveis para transplante de doadores animais para receptores humanos, como visto em vários transplantes inovadores entre 2022-2024. Essas inovações podem trazer nova esperança para milhares de pacientes que precisam de órgãos vitais.
O que é xenotransplante?
De acordo com o FDA, "Xenotransplante é qualquer procedimento que envolva transplante, implantação ou infusão em receptor humano de (a) células, tecidos ou órgãos vivos de uma fonte animal não humana, ou (b) fluidos corporais humanos, células, tecidos ou órgãos que tiveram contato ex vivo com células, tecidos ou órgãos animais não humanos vivos".
Os médicos começaram a experimentar o xenotransplante no início dos anos 1900, mas não foi até meados do século, quando os medicamentos imunossupressores foram desenvolvidos, que as taxas de sucesso do transplante melhoraram. O Prêmio Nobel de Fisiologia ou Medicina de 1960 foi concedido a Peter Medawar por seu trabalho pioneiro na imunidade a transplantes.
Lista dos principais eventos na história do xenotransplante
Apresentado como ano, órgão que se tentou transplantar, animais doadores ou evento e referência.
- 1906: Rim, porco e cabra.
Rodger, D. e Hurst, D. J. Xenotransplantation 2022, 29, e12765 - 1910: rim, macaco
Unger, E. Berliner Klinische Wochenschrift. 1910, 47, 573-578 - 1913: Kidney, Monkey
Morel, L. and Papin, E. Biologie Médicale 1913, 11, 397 - 1923: Kidney, Lamb
Neuhof, H. D. The transplantation of tissues 1923, 260 - 1963: Kidney, Baboon
Hitchcock, C. et al. JAMA 1964, 189, 934-937 - 1963: rim, macaco Rhesus
Reemtsma, K. et al. Science 1964, 143, 700-702 - 1963: coração, chimpanzé
Hardy, J. et al. JAMA 1964, 188, 1132-1140 - 1964: rim, chimpanzé
Reemtsma, K. et al. Ann. Surg. 1964, 160, 384-408 - 1970: Fígado, Babuíno
Bertoye, A. et al. Lyon Chir. 1969, 222, 347-354 - 1971: Fígado, Babuíno
Pouyet, M. e Berard, P. Lyon Chir. 1971, 67, 288-291 - 1974: Fígado, Chimpanzé
Starzl, T. et al. Transplant Proc. 1974, 6, 129-139 - 1977: Coração, chimpanzé e babuíno
Barnard, C. et al. S. Afr. Med. J. 1977, 52, 1035-1038 - 1984: coração, babuíno
Bailey, L. et al. JAMA 1985, 254, 3321-3329 - 1992: Coração, Porco
Czaplicki, J. J. Heart Lung Transplant. 1992, 11, 393-397 - 1992: fígado, babuíno
Starzl, T. et al. Lancet 1993, 341, 65-71 - 1993: fígado, porco
Makowka, L. et al. Transplante 1995, 59, 1654-1659 - 1993: fígado, babuíno
Starzl, T. et al. Immunol. Rev. 1994, 141, 213-244 - 1996: coração, porco
Jayaraman, K. Nature 1997, 385, 378 - 2002: porcos α-Gal KO
Lai, L. et al. Science 2002, 295, 1089-1092 - 2009: Tentativas de inibir a replicação do PERV em porcos
Shi, M. et al. Antivírus. Res. 2009, 83, 201-204 - 2013: tecnologia CRISPR/Cas usada para edição de genes de células eucarióticas
Cong, L. et al. Science 2013, 339, 819-823 - 2015: Uso da tecnologia CRISPR/Cas para erradicar o PERV
Yang, L. et al. Science 2015, 350, 1101-1104 - 2017: Geração de suínos sem PERV
Niu, D. et al. Science 2017, 357, 1303-1307 - 2021: rim, suíno (geneticamente modificado) em humano com morte cerebral
Cooper, D.K.C. Xenotransplantation 2021, 28, e12718 - 2021: rim, suíno (geneticamente modificado) em humano com morte cerebral
Porrett, P.M. et al. Am. J. Transplant. 2022, 22, 1037-1053 - 2022: coração, suíno (geneticamente modificado) em receptor humano vivo
Wang, W. et al. The Innovation 2022, 3, 100223 - 2023: coração, suíno (geneticamente modificado) em receptor humano vivo
Griffith, B.P. et al. Nat. Med. 2025, 31, 589-598 - 2024: rim suíno (geneticamente modificado) em receptor humano vivo
https://hms.harvard.edu/news/first-genetically-edited-pig-kidney-transplanted-human - 2024: tim e timo, suíno (geneticamente modificado) em receptor humano vivo
https://nyulangone.org/news/first-ever-combined-heart-pump-gene-edited-pig-kidney-transplant-gives-new-hope-patient-terminal-illness - 2025: Está previsto o início do ensaio clínico da UKidney™ da United Therapeutics
NCT06878560
O desenvolvimento da tecnologia CRISPR/CAS deu início a novos avanços e resultou em experimentação clínica com uma série de xenotransplantes relatados em 2022-2024. Examinamos a Coleção de Conteúdo do CASTM, o maior repositório de informações científicas com curadoria humana e encontramos um crescimento consistente em publicações relacionadas a xenotransplantes (Figura 1).
As publicações atingiram o pico em 2021, pouco antes do início dos últimos transplantes geneticamente modificados. O domínio das publicações em periódicos e o número relativamente pequeno de patentes mostram que essa tecnologia ainda está longe de ser amplamente comercializada, mas a pesquisa permanece estável.
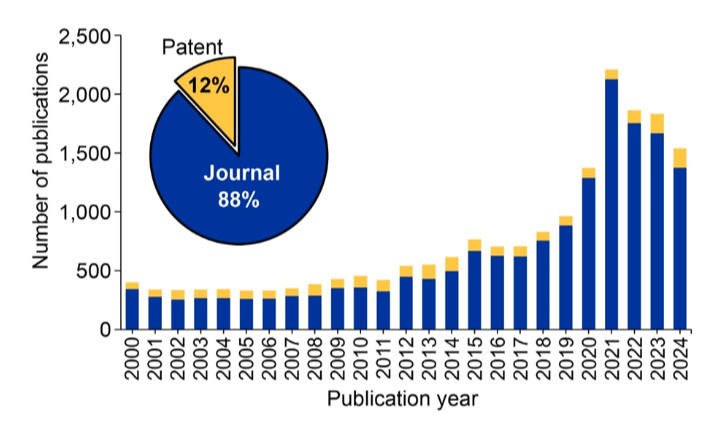
As espécies animais mais comumente estudadas e utilizadas em xenotransplantes são mostradas na Figura 2. Os suínos são, de longe, os animais preferidos para esses estudos e, como veremos, os órgãos de suínos tiveram os maiores avanços em engenharia genética e transplante.
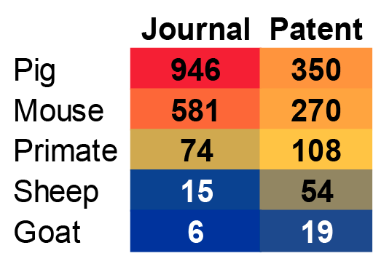
Há várias razões pelas quais os porcos são o animal de escolha para o xenotransplante, incluindo:
- Semelhanças anatômicas com humanos (tamanho dos órgãos).
- Semelhanças fisiológicas com humanos.
- Custo relativamente mais baixo devido à facilidade de criação e reprodução rápida.
- Facilidade relativa e alta compatibilidade com modificações genéticas.
- Menor risco de doenças zoonóticas.
Barreiras para o xenotransplante
Os órgãos xenotransplantados podem enfrentar vários tipos de rejeição: hiperaguda (ocorrendo quase imediatamente, em questão de minutos a horas), aguda (ocorrendo semanas a meses após o transplante) e crônica (ocorrendo meses a anos após o transplante).
A rejeição de órgãos é mediada por muitos fatores, incluindo a imunidade inata e adaptativa (ver Tabela 1). A imunidade inata é controlada por anticorpos naturais que se ligam e reconhecem as glicoproteínas suínas (geralmente referidas como xenoantígenos). Alguns dos xenoantígenos identificados incluem galactose-α-1,3-galactose (α-Gal), ácido N-glicolilneuramínico (NeuGc) e SDa.
Desde a década de 1990, esforços consideráveis de pesquisa têm sido direcionados para criar porcos com os genes dessas proteínas eliminados para evitar a rejeição hiperaguda. A eliminação da α-Gal em suínos foi considerada um marco importante no avanço do xenotransplante. Nos últimos anos, os suínos com triple knockout (TKO) estão se tornando mais prevalentes.
|
Inato |
Adaptativo |
|
|
Definição |
(Presente desde o nascimento e considerado "a primeira linha de defesa do corpo") |
Desenvolve-se em resposta à exposição a substâncias ou patógenos ou células estranhas (presente desde o nascimento e considerado "a primeira linha de defesa do corpo") |
|
Características |
Não específico Imediato |
Específico Resposta personalizada Memória imunológica |
|
Componentes |
Barreiras físicas Células NK |
Células B células T |
Tabela 1: Principais diferenças nos sistemas imunológicos inato vs. adaptativo.
Outros componentes do sistema imunológico inato que desempenham um papel na rejeição de órgãos são macrófagos e células assassinas ou natural killer (NK). O primeiro desempenha um papel na rejeição, mediando a inflamação (liberação de citocinas pró-inflamatórias, espécies reativas de oxigênio etc.) e fagocitando células. O CD47, uma proteína transmembrana expressa em células imunológicas, como as células T e B, interage com a proteína regulatória de sinal α (SIRPα), que são receptores inibitórios expressos em macrófagos e células NK, para impedir a fagocitose. O CD47 suíno não parece interagir com o SIRPα de forma semelhante ao CD47 humano e, portanto, não pode impedir a fagocitose. Nos últimos anos, vários estudos exploraram a viabilidade de expressar CD47 humano em órgãos de suínos para reduzir a rejeição de órgãos. No entanto, o CD47 tem muitas outras funções além de sua interação com a SIRPα, e a expressão do CD47 humano em órgãos de suínos pode ter consequências indesejadas.
Semelhante aos macrófagos, as células NK também podem levar à rejeição de órgãos, seja direta ou indiretamente. Como os macrófagos, as células NK também expressam receptores inibitórios e ativadores em sua superfície que interagem com os parceiros de ligação e modulam sua atividade. Acredita-se que a ligação das moléculas HLA de classe I aos receptores do tipo imunoglobulina de células assassinas (KIR), um tipo de receptor inibitório nas células NK, impeça a ativação das células NK.
Diferentemente da imunidade inata, a imunidade adaptativa ocorre em resposta à exposição a substâncias estranhas usando células B e T. Os receptores de células B são anticorpos ligados à membrana expressos na superfície das células B que reconhecem antígenos e resultam nos resultados da ativação das células B e em uma resposta imune. Um artigo de 2012 relatou o prolongamento da sobrevivência do xenoenxerto cardíaco suíno em babuínos em 2,5 vezes incorporando anticorpos contra CD20, uma proteína expressa na superfície das células B, no regime imunossupressor. Outros também relataram o uso de anticorpos contra CD40, receptores de superfície celular encontrados em células B, macrófagos e outras células imunes, em combinação com outros agentes imunossupressores para prolongar a sobrevivência de xenoenxertos de ilhotas suínas em primatas não humanos.
As células T são outro tipo de glóbulo branco semelhante às células B, mas as células T sofrem maior desenvolvimento e maturação na glândula timo. A ativação das células T pela interação dos receptores de células T (TCR) com as principais células de histocompatibilidade (MHC) em células apresentadoras de antígenos na presença de moléculas coestimuladoras desencadeia uma complexa cascata de sinalização intracelular e geração de subtipos de células T.
As evidências sugerem que, no xenotransplante de porco para humano, moléculas de MHC suínas chamadas antígeno leucocitário suíno (SLA) se ligam ao TCR nas células T humanas, causando ativação e resultando em uma resposta imune. Continuam os esforços para criar suínos doadores com expressão reduzida de SLA para diminuir a ativação das células T.
Além da rejeição de órgãos mediada pela resposta imune, a inflamação e a disfunção coagulativa são os principais obstáculos para o sucesso do xenotransplante. O fígado desempenha um papel fundamental na síntese de muitos fatores de coagulação. Embora haja semelhanças entre os sistemas de coagulação humano e suíno, diferenças fundamentais também contribuem para incompatibilidades nas complicações de coagulação e sangramento.
A inflamação é considerada uma resposta fisiológica normal após a exposição a estímulos prejudiciais, que é atenuada quando os estímulos são tratados. No entanto, há cada vez mais evidências de que a inflamação sistêmica pode ocorrer após o xenotransplante e que essa resposta inflamatória sistêmica contribui para problemas de coagulação e resposta imunológica, que contribuem para o fracasso do xenoenxerto/xenotransplante.
Considerando as complexas interconexões entre os sistemas inflamatório e de coagulação, o controle da inflamação sistêmica provavelmente auxilia na redução da disfunção da coagulação e portanto ajuda a prolongar a sobrevivência após o xenotransplante, seja pelo uso de medicamentos anti-inflamatórios ou pela expressão de proteínas como a hemeoxigenase-1 (HO-1) e outras com efeitos anti-inflamatórios em porcos doadores.
Por fim, foi relatado que vírus como retrovírus endógenos suínos (PERVs) e citomegalovírus suíno (PCM) são transmitidos entre espécies, incluindo humanos, em ensaios e experimentos de xenotransplante. Um possível fator contribuinte para uma falha recente no xenotransplante pode ter sido uma reação à PCM latente.
Esses desafios demonstram como o xenotransplante é complexo e por que a edição genética mostra tanto potencial nesse campo.
Por que o CRISPR pode ser a chave do sucesso do xenotransplante
CRISPR (repetições palindrômicas curtas agrupadas regularmente intercaladas), parte do mecanismo de defesa bacteriana, é uma tecnologia de edição de genes revolucionária com a primeira terapia baseada em CRISPR/Cas9, Casgevy, recebendo aprovação da FDA dos EUA em 2023.
As principais vias pelas quais a tecnologia CRISPR/Cas é utilizada no contexto do xenotransplante são:
- Eliminação de genes suínos que codificam proteínas que atuam como antígenos e cuja ausência ajuda a superar a rejeição hiperaguda e a diminuir a rejeição geral do órgão xenotransplantado.
- Aumentando a imunocompatibilidade de órgãos de doadores transplantados pela expressão de transgenes humanos.
- Reduzir o risco de doenças zoonóticas, como o PERV, eliminando os genes associados a elas.
- Controle do tamanho dos órgãos do doador.
Há duas rotas comuns pelas quais porcos geneticamente modificados podem ser criados usando a tecnologia CRISPR/Cas. O primeiro incorpora mRNA para a nuclease Cas9 e RNA guia (gRNA) em células primárias suínas usando transfecção, seguido por rodadas sucessivas de cultura de células e transferência nuclear de células somáticas, técnica utilizada para transferir o núcleo de uma célula somática para óvulos e, finalmente, reprodução para dar origem a porcos geneticamente modificados. A outra rota envolve a microinjeção de zigotos suínos com a nuclease Cas9 e vetores de expressão de gRNA ou RNA, seguido de reprodução para produzir porcos geneticamente modificados.
A Tabela 2 lista os genes modificados com a tecnologia CRISPR/Cas na pesquisa de xenotransplante. A maioria dos porcos geneticamente modificados usados em pesquisas de xenotransplante tende a ter mais de uma modificação genética, como porcos com knockout (KO) duplo, triplo e quádruplo.
Genes suínos (knocked out) e proteínas relacionadas
- GGTA1: Glicoproteína α-galactosiltransferase 1
- CMAH: ácido N-glicolilneuramínico
- β4GALNT2: β-1,4-acetil-galactosaminiltransferase
- A3GALT2: α-1,3-galactosiltransferase 2
- PERV: Retrovírus endógenos suínos
- GHR: Receptor do hormônio do crescimento
- β2M: β2-microglobulina,
- CIITA: transativador do complexo principal de histocompatibilidade classe II
- SLA: Antígeno leucocitário suíno
Genes humanos inseridos (knocked in) e proteínas relacionadas
- CD39: Ectonucleosídeo trifosfato, difosfohidrolase 1
- CD46: Proteína cofator de membrana
- CD47: Proteína associada à integrina
- CD55: Fator de aceleração da degradação
- CD59: proteína inibidora de MAC
- β2M: B-2-microglobulina
- HLA-E: Complexo principal de histocompatibilidade, classe I, E
- THBD: Trombomodulina
- TFPI: Inibidor da via do fator tecidual
- HO1: Heme oxigenase-1
- EPCR: Receptor endotelial da proteína C
Tabela 2: Lista de genes modificados paro xenotransplante com a tecnologia CRISPR/Cas.
Relatórios sugerem que corações suínos continuam crescendo após o transplante em primatas não humanos, levando à falha. Isso também requer a administração de medicamentos capazes de reduzir esse crescimento, como o inibidor de mTOR, temsirolimus e outros. Uma maneira de superar esse problema de crescimento contínuo é eliminar o receptor do hormônio do crescimento em porcos, resultando em porcos e órgãos menores. Por enquanto, essa questão está confinada a modelos pré-clínicos de primatas não humanos para xenotransplante, embora o controle do tamanho dos xeno-órgãos possa se tornar importante no caso de xenotransplantes pediátricos.
Como observado, a tecnologia CRISPR/CAS resultou em várias descobertas importantes em xenotransplantes nos últimos anos. São elas:
- Transplante de coração de porco em receptor humano vivo em 2022. O coração suíno foi extensivamente modificado geneticamente para aumentar as chances de sobrevivência. As modificações genéticas foram a eliminação de genes de três xenoantígenos (galactose-α-1,3-galactose, antígeno do grupo sanguíneo Sda e ácido N-glicolilneuramínico), a eliminação de genes do receptor do hormônio do crescimento para controlar o tamanho do órgão e a introdução de um total de seis genes humanos em uma tentativa de humanizar o coração suíno e melhorar a compatibilidade (CD46, fator acelerador de decaimento, trombomodulina, receptor da proteína C da célula endotelial, CD47 e heme oxigenase 1). Embora não houvesse evidência óbvia de rejeição do xenoenxerto, o paciente faleceu dois meses após a ocorrência do xenotransplante. Embora lamentável, esse caso é, no entanto, uma conquista/marco notável no campo.
- Transplante de coração de porco em receptor humano vivo em 2023. Realizado pela mesma equipe de médicos e pesquisadores que o xenotransplante em 2022, foi usado um coração suíno geneticamente modificado de forma semelhante. Como em 2022, o paciente faleceu seis semanas após a cirurgia. Em ambos os casos, um aumento acentuado no peso do coração acompanhado por “espessamento miocárdico” foi observado durante a autópsia.
- Transplante de rim de porco em receptor humano vivo em 2024. Como os xenotransplantes de coração suíno descritos acima, o rim suíno também foi geneticamente modificado, consistindo supostamente em 69 edições genômicas realizadas com a tecnologia CRISPR/Cas. O paciente faleceu quase dois meses após a cirurgia.
- Transplante de rim e timo de porco em receptor humano vivo em 2024. Esse procedimento foi único, e o órgão transplantado foi denominado UThymoKidney™ (United Therapeutics Corporation). Consistia em um rim suíno combinado com tecido de timo do mesmo porco implantado para reduzir a probabilidade de rejeição, impedindo que o sistema imunológico do doador reconhecesse o órgão transplantado como um objeto estranho. Diferentemente dos outros casos, o xenotransplante foi removido do corpo do doador um mês e meio após a cirurgia devido à falência do órgão, exigindo a retomada da diálise, e o paciente acabou falecendo após algumas semanas.
Apesar dos desafios constantes da sobrevivência pós-cirúrgica, os ensaios clínicos estão em andamento. Por exemplo, em 2025, a United Therapeutics anunciou a aprovação pela FDA dos EUA de seu pedido de Novo Medicamento Experimental (IND) para estudar o UKidney™ em um ensaio clínico. O ensaio clínico de Fase 1/2 está programado para começar neste verão e pretende estudar os efeitos do xenotransplante de 10 rins geneticamente modificados (UKidney™), resultantes de 10 modificações genéticas — uma mistura de eliminação de quatro genes de porco e adição de seis genes humanos em pacientes com doença renal em estágio terminal.
Além dos transplantes de órgãos
Os procedimentos de xenotransplante também podem tratar de outras condições além da falência de órgãos. Graças a técnicas de edição de genes como CRISPR, células e tecidos animais podem ser modificados para tratar doenças humanas adicionais.
Diabetes tipo 1:
O transplante de ilhotas de doadores humanos falecidos para pacientes com diabetes tipo 1 tem sido uma área de interesse contínua, mas a demanda por ilhotas supera a oferta. Nos últimos anos, o transplante de ilhotas suínas geneticamente modificadas com xenoantígenos desativados e humanização pela expressão de proteínas humanas em primatas não humanos têm apresentado resultados promissores. Entretanto, vários desafios fundamentais permanecem, incluindo a reação inflamatória e imunológica inicial ao transplante (IBMIR), bem como as diferenças na fisiologia das ilhotas e na secreção de insulina.
Síndrome do ovário policístico (SOP)
Recentemente, cientistas da Nanjing Medical University na China tentaram o xenotransplante de tecido adiposo marrom de ratos para camundongos para tratar a SOP. O tecido adiposo marrom, comumente abreviado como BAT, é um tipo de gordura envolvida no uso de lipídios e glicose para termogênese e regulação da temperatura corporal. O xenotransplante de BAT de rato para camundongos permitiu uma correção parcial da SOP e melhorou o desempenho geral dos ovários nos camundongos. Esses estudos experimentais iniciais parecem promissores e são um raio de esperança para indivíduos que sofrem de SOP, quase seis milhões apenas nos EUA.
Câncer
A aplicação do xenotransplante no câncer envolve o desenvolvimento de xenoenxertos derivados de pacientes, que são modelos criados pelo implante de tecidos e células cancerosas de pacientes em animais como camundongos e ratos. Esses modelos são inestimáveis para compreender a fisiopatologia da doença, testar e avaliar medicamentos mais eficientes e projetar uma medicina personalizada.
Desafios e oportunidades com xenotransplantes
Apesar de todas as melhorias no xenotransplante, obstáculos significativos ainda permanecem para o uso clínico generalizado. A complexidade da compatibilidade imunológica significa que a dependência exclusiva da engenharia genética pode não ser capaz de prevenir a rejeição de órgãos. Há também desafios técnicos e éticos a serem abordados, nomeadamente potenciais infecções e diferenças nos tamanhos dos órgãos, bem como questões sobre consentimento e bem-estar animal.
A comunidade médica também precisa entender as implicações de longo prazo do xenotransplante e ter uma estrutura regulatória consistente e robusta para orientar os esforços futuros. Devido a esses desafios, o xenotransplante ainda é considerado uma linha experimental de tratamento com inúmeras barreiras a serem superadas.
No entanto, os avanços na engenharia genética que levaram a melhorias tangíveis proporcionam um impulso inegável a este campo. Com as descobertas importantes na edição de genes e na compreensão imunológica, o xenotransplante pode oferecer esperança para milhares ou até milhões de pacientes que precisam de órgãos e tecidos.