Más de 100 000 personas en Estados Unidos están en lista de espera para un trasplante de órganos. En 2024 se llevaron a cabo casi 48 000 trasplantes de órganos y, aunque esa cifra representa un crecimiento impresionante de estas intervenciones que salvan vidas, sigue estando muy por debajo de la necesidad global. A medida que la población mundial envejece, este descuadre entre los órganos disponibles y los pacientes que los necesitan seguirá aumentando.
Sin embargo, los órganos de donantes animales podrían ser la solución. Este procedimiento, conocido como xenotrasplante, tiene una larga historia que se remonta a principios del siglo XX, pero los problemas inmunitarios y los rechazos de órganos impidieron que estos trasplantes tuvieran éxito. Con la llegada de la tecnología de edición genética, específicamente CRISPR-Cas, los investigadores son cada vez más capaces de resolver los problemas de inmunocompatibilidad. Están cada vez más cerca de conseguir que corazones, riñones y otros órganos y tejidos de donantes animales puedan ser trasplantados a receptores humanos, como se ha visto en varios trasplantes revolucionarios entre 2022 y 2024. Estas innovaciones podrían aportar una nueva esperanza a muchos miles de pacientes que necesitan órganos que les salven la vida.
¿Qué es el xenotrasplante?
Según la FDA, «xenotrasplante es cualquier procedimiento que implique el trasplante, el implante o la infusión en un receptor humano de: a) células, tejidos u órganos vivos de origen animal no humano, o b) fluidos, células, tejidos u órganos del cuerpo humano que hayan tenido contacto ex vivo con células, tejidos u órganos vivos de animales no humanos».
Los médicos comenzaron a experimentar con el xenotrasplante a principios del siglo XX, pero no fue hasta mediados de siglo, cuando se desarrollaron los fármacos inmunosupresores, que mejoraron las tasas de éxito de los trasplantes. El Premio Nobel de Fisiología o Medicina de 1960 fue otorgado a Peter Medawar por su trabajo pionero en la inmunidad de los trasplantes.
Lista de acontecimientos clave en la historia del xenotrasplante
Presentados por año, órgano que se intentó trasplantar, animales donantes o acontecimiento, y referencia.
- 1906: Riñón, cerdo y cabra.
Rodger, D. y Hurst, D. J. Xenotransplantation 2022, 29, e12765 - 1910: Riñón, macaco
Unger, E. Berliner Klinische Wochenschrift. 1910, 47, 573-578 - 1913: Riñón, Mono
Morel, L. y Papin, E. Biologie Médicale 1913, 11, 397 - 1923: Riñón, Cordero
Neuhof, H. D. El trasplante de tejidos 1923, 260 - 1963: Riñón, babuino
Hitchcock, C. et al. JAMA 1964, 189, 934-937 - 1963: Riñón, mono rhesus
Reemtsma, K. et al. Science 1964, 143, 700-702 - 1963: Corazón, chimpancé
Hardy, J. et al. JAMA 1964, 188, 1132-1140 - 1964: Riñón, chimpancé
Reemtsma, K. et al. Ann. Surg. 1964, 160, 384-408 - 1970: Hígado, babuino
Bertoye, A. et al. Lyon Chir. 1969, 222, 347-354 - 1971: Hígado, babuino
Pouyet, M. y Berard, P. Lyon Chir. 1971, 67, 288-291 - 1974: Hígado, chimpancé
Starzl, T. et al. Transplant Proc. 1974, 6, 129-139 - 1977: Corazón, chimpancé y babuino
Barnard, C. et al. S. Afr. Med. J. 1977, 52, 1035-1038 - 1984: Corazón, babuino
Bailey, L. et al. JAMA 1985, 254, 3321-3329 - 1992: Corazón, cerdo
Czaplicki, J. J. Heart Lung Transplant. 1992, 11, 393-397 - 1992: Hígado, babuino
Starzl, T. et al. Lancet 1993, 341, 65-71 - 1993: Hígado, cerdo
Makowka, L. et al. Transplantation 1995, 59, 1654-1659 - 1993: Hígado, Babuino
Starzl, T. et al. Immunol. Rev. 1994, 141, 213-244 - 1996: Corazón, cerdo
Jayaraman, K. Nature 1997, 385, 378 - 2002: α-Gal en cerdos KO
Lai, L. et al. Science 2002, 295, 1089-1092 - 2009: Intentos de inhibir la replicación de PERV en cerdos
Shi, M. et al. Antivir. Res. 2009, 83, 201-204 - 2013: Tecnología CRISPR/Cas utilizada para la edición genética de células eucariotas
Cong, L. et al. Science 2013, 339, 819-823 - 2015: Uso de la tecnología CRISPR/Cas para erradicar PERV
Yang, L. et al. Science 2015, 350, 1101-1104 - 2017: Generación de cerdos libres de PERV
Niu, D. et al. Science 2017, 357, 1303-1307 - 2021: Riñón porcino (modificado genéticamente) en sujeto humano con muerte cerebral
Cooper, D.K.C. Xenotransplantation 2021, 28, e12718 - 2021: Riñón porcino (genéticamente modificado) en un sujeto humano con muerte cerebral
Porrett, P.M. et al. Am. J. Transplant. 2022, 22, 1037-1053 - 2022: Corazón porcino (modificado genéticamente) en receptor humano vivo
Wang, W. et al. The Innovation 2022, 3, 100223 - 2023: Corazón porcino (modificado genéticamente) en receptor humano vivo
Griffith, B.P. et al. Nat. Med. 2025, 31, 589-598 - 2024: Riñón porcino (modificado genéticamente) en receptor humano vivo
https://hms.harvard.edu/news/first-genetically-edited-pig-kidney-transplanted-human - 2024: Riñón y timo, porcino (modificado genéticamente) en receptor humano vivo
https://nyulangone.org/news/first-ever-combined-heart-pump-gene-edited-pig-kidney-transplant-gives-new-hope-patient-terminal-illness - 2025: El ensayo clínico de UKidney™ de United Therapeutics está programado para comenzar
NCT06878560
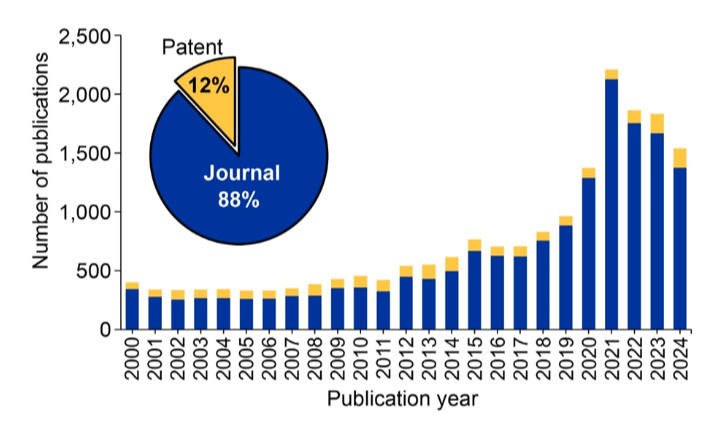
El desarrollo de la tecnología CRISPR/Cas ha dado lugar a nuevos avances y experimentos clínicos, por lo que toda una serie de xenotransplantes se han dado a conocer entre 2022 y 2024. Examinamos la CAS Content CollectionTM, el mayor repositorio de información científica catalogada por humanos, y encontramos un crecimiento constante en las publicaciones relacionadas con xenotransplantes (véase la figura 1).
Las publicaciones alcanzaron su punto álgido en 2021, justo antes de que comenzaran los últimos trasplantes genéticamente modificados. El predominio de las publicaciones en revistas especializadas y el número relativamente reducido de patentes muestran que esta tecnología aún está lejos de una comercialización generalizada, si bien la investigación sigue siendo constante.
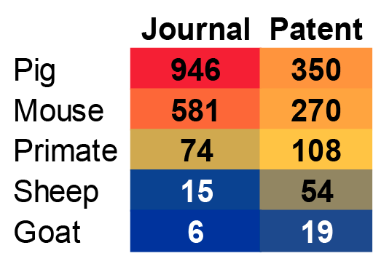
Las especies animales más estudiadas y utilizadas en el xenotrasplante se muestran en la figura 2. Los cerdos son, con diferencia, el animal elegido para estos estudios y, como veremos, los órganos de cerdo han experimentado los mayores avances en ingeniería genética y trasplantes.
Hay varias razones por las que los cerdos son el animal preferido para el xenotrasplante, entre ellas:
- Similitudes anatómicas al ser humano (tamaño de los órganos).
- Similitudes fisiológicas con los seres humanos.
- Coste relativamente menor debido a la facilidad de cría y la rápida reproducción.
- Relativa facilidad y alta compatibilidad con las modificaciones genéticas.
- Menor riesgo de enfermedades zoonóticas.
Barreras para el xenotrasplante
Los órganos xenotransplantados pueden sufrir varios tipos de rechazo: hiperagudo (que se produce casi inmediatamente, en cuestión de minutos u horas), agudo (que se produce semanas o meses después del trasplante) y crónico (que se produce meses o años después del trasplante).
El rechazo de órganos está mediado por muchos factores, entre ellos la inmunidad innata y adaptativa (véase la tabla 1). La inmunidad innata está controlada por anticuerpos naturales que se unen y reconocen las glicoproteínas porcinas (a menudo denominadas xenoantígenos). Algunos de los xenoantígenos identificados son la galactosa-α-1,3-galactosa (α-Gal), el ácido N-glicolilneuramínico (NeuGc) y el SDa.
Desde la década de 1990, se ha dedicado un considerable trabajo de investigación a la creación de cerdos con los genes de estas proteínas eliminados para evitar el rechazo hiperagudo. La eliminación de α-Gal en cerdos se consideró un hito importante en el avance de los xenotransplantes. En los últimos años, los cerdos con triple eliminación (TKO) son cada vez más frecuentes.
|
Innato |
Adaptativo |
|
|
Definición |
(Presente desde el nacimiento y considerado «la primera línea de defensa del organismo») |
Se desarrolla en respuesta a la exposición a sustancias extrañas, patógenos o células |
|
Características |
No específico Inmediato |
Específico Respuesta adaptada Memoria inmunitaria |
|
Componentes |
Barreras físicas Células NK |
Linfocitos B Linfocitos T |
Tabla 1: Principales diferencias entre el sistema inmunitario innato y el adaptativo.
Otros componentes del sistema inmunitario innato que desempeñan un papel en el rechazo de órganos incluyen macrófagos y células natural killer (NK). Los primeros desempeñan un papel en el rechazo al mediar la inflamación (liberación de citocinas proinflamatorias, especies reactivas de oxígeno, etc.) y fagocitar células. El CD47, proteína transmembrana expresada en células inmunitarias como los linfocitos T y B, interactúa con la proteína reguladora de señales α (SIRPα), que son receptores inhibidores expresados en macrófagos y células NK, para prevenir la fagocitosis. El CD47 porcino no parece interactuar con la SIRPα de forma similar al CD47 humano y, por lo tanto, no puede impedir la fagocitosis. En los últimos años, varios estudios han explorado la viabilidad de expresar el CD47 humano en órganos porcinos para reducir el rechazo de órganos. Sin embargo, el CD47 tiene muchas otras funciones además de su interacción con la SIRPα, y la expresión del CD47 humano en órganos porcinos podría tener consecuencias no deseadas.
Al igual que los macrófagos, las células NK también pueden provocar el rechazo de órganos, ya sea de forma directa o indirecta. Al igual que los macrófagos, las células NK también expresan receptores inhibidores y activadores en su superficie que interactúan con sus socios de unión y modulan su actividad. Se cree que la unión de las moléculas HLA de clase I a los receptores similares a la inmunoglobulina de las células killer (KIR), un tipo de receptor inhibidor de las células NK, previene la activación de estas células.
A diferencia de la inmunidad innata, la inmunidad adaptativa se produce en respuesta a la exposición a sustancias extrañas mediante el uso de linfocitos B y T. Los receptores de linfocitos B son anticuerpos unidos a la membrana que se expresan en la superficie de los linfocitos B, reconocen los antígenos y dan lugar a la activación de los linfocitos B y a una respuesta inmunitaria. Un artículo de 2012 comunicó una prolongación de 2,5 veces de la supervivencia de los xenoinjertos cardíacos porcinos en babuinos mediante la incorporación de anticuerpos contra el CD20, proteína expresada en la superficie de los linfocitos B, en el régimen inmunosupresor. Otros también han informado del uso de anticuerpos contra el CD40, receptores de la superficie celular que se encuentran en los linfocitos B, los macrófagos y otras células inmunitarias, en combinación con otros agentes inmunosupresores para prolongar la supervivencia de los xenoinjertos de islotes porcinos en primates no humanos.
Los linfocitos T son otro tipo de glóbulos blancos similares a los linfocitos B, pero los linfocitos T se someten a un mayor desarrollo y maduración en el timo. La activación de los linfocitos T por la interacción de los receptores de linfocitos T (TCR) con las células de histocompatibilidad mayor (MHC) en las células presentadoras de antígenos en presencia de moléculas coestimuladoras desencadena una compleja cascada de señales intracelulares y la generación de subtipos de linfocitos T.
Las pruebas sugieren que, en el xenotrasplante de cerdo a humano, las moléculas MHC porcinas denominadas antígenos leucocitarios porcinos (SLA) se unen al TCR de los linfocitos T humanos, lo que provoca su activación y da lugar a una respuesta inmunitaria. Se sigue trabajando en la obtención de cerdos donantes con una expresión reducida de SLA para disminuir la activación de los linfocitos T.
Además del rechazo de órganos mediado por la respuesta inmunitaria, la inflamación y la disfunción coagulativa son obstáculos importantes para el éxito del xenotrasplante. El hígado desempeña un papel clave en la síntesis de muchos factores de coagulación. Aunque existen similitudes entre los sistemas de coagulación humano y porcino, también hay diferencias fundamentales que contribuyen a provocar incompatibilidades en la coagulación y complicaciones hemorrágicas.
La inflamación se considera una respuesta fisiológica normal tras la exposición a estímulos perjudiciales, que se atenúa una vez que se aborda el estímulo. Sin embargo, cada vez hay más pruebas de que puede producirse una inflamación sistémica tras el xenotrasplante y que esta respuesta inflamatoria sistémica contribuye a problemas de coagulación y respuesta inmunitaria, lo que en conjunto contribuye al fracaso del xenoinjerto/xenotrasplante.
Teniendo en cuenta las complejas interconexiones entre los sistemas inflamatorio y de coagulación, es probable que el control de la inflamación sistémica ayude a reducir la disfunción de la coagulación y, por lo tanto, contribuya a prolongar la supervivencia tras el xenotrasplante, ya sea mediante el uso de fármacos antiinflamatorios o mediante la expresión de proteínas como la hemooxigenasa-1 (HO-1) y otras con efectos antiinflamatorios en los cerdos donantes.
Por último, se ha informado de que virus como los retrovirus endógenos porcinos (PERV) y el citomegalovirus porcino (CMVP) se transmiten entre especies, incluidos los seres humanos, en ensayos y experimentos de xenotransplante. Un factor potencial que ha contribuido al reciente fracaso del xenotransplante puede haber sido una reacción al CMVP latente.
Estos retos demuestran lo complejo que es el xenotrasplante y por qué la edición genética es tan prometedora en este campo.
Por qué CRISPR podría ser la clave para el éxito del xenotrasplante
CRISPR (repeticiones palindrómicas cortas agrupadas y espaciadas regularmente), parte del mecanismo de defensa bacteriano, es una tecnología de edición genética revolucionaria cuya primera terapia basada en CRISPR/Cas9, Casgevy, obtuvo la autorización de la FDA de EE. UU. en 2023.
Las principales vías para las que se utiliza la tecnología CRISPR/Cas en el contexto del xenotrasplante incluyen:
- Eliminar los genes porcinos que codifican proteínas que actúan como antígenos y cuya ausencia ayuda a superar el rechazo hiperagudo y a disminuir en general el rechazo del órgano xenotransplantado.
- Aumentar la inmunocompatibilidad de los órganos donados trasplantados mediante la expresión de transgenes humanos.
- Reducir el riesgo de enfermedades zoonóticas como PERV mediante la eliminación de los genes asociados.
- Controlar el tamaño de los órganos donados.
Existen dos vías comunes a través de las cuales se pueden crear cerdos modificados genéticamente utilizando la tecnología CRISPR/Cas. La primera incorpora ARNm para la nucleasa Cas9 y ARN guía (gRNA) en células primarias porcinas mediante transfección, seguida de sucesivas rondas de cultivo celular y transferencia nuclear de células somáticas, una técnica utilizada para transferir el núcleo de una célula somática a óvulos, y finalmente la cría para dar lugar a cerdos modificados genéticamente. La otra vía consiste en microinyectar cigotos porcinos con nucleasa Cas9 y vectores de expresión de ARN guía o ARN, seguido de la cría para producir cerdos modificados genéticamente.
En la tabla 2 se enumeran los genes que se han modificado utilizando la tecnología CRISPR/Cas en la investigación sobre xenotransplantes. La mayoría de los cerdos modificados genéticamente utilizados en la investigación sobre xenotransplantes suelen tener más de una modificación genética, por ejemplo, cerdos con doble, triple y cuádruple knockout (KO).
Genes porcinos (knocked out) y proteínas relacionadas
- GGTA1: Glicoproteína α-galactosiltransferasa 1
- CMAH: ácido N-glicolilneuramínico
- β4GALNT2: β-1,4-acetil-galactosaminiltransferasa
- A3GALT2: α-1,3-galactosiltransferasa 2
- PERV: retrovirus endógenos porcinos
- GHR: receptor de la hormona del crecimiento
- β2M: β2-microglobulina
- CIITA: transactivador del complejo mayor de histocompatibilidad de clase II
- SLA: antígeno leucocitario porcino
Genes humanos (knocked in) y proteínas relacionadas
- CD39: ectonucleósido trifosfato, difosfohidrolasa 1
- CD46: proteína cofactor de membrana
- CD47: proteína asociada a la integrina
- CD55: factor acelerador de la desintegración
- CD59: proteína inhibidora del MAC
- β2M: B-2-microglobulina
- HLA-E: complejo mayor de histocompatibilidad, clase I, E
- THBD: trombomodulina
- TFPI: inhibidor de la vía del factor tisular
- HO1: heme oxigenasa-1
- EPCR: Receptor de proteína C endotelial
Tabla 2: Lista de genes que han sido modificados para el xenotrasplante utilizando la tecnología CRISPR/Cas.
Los informes sugieren que los corazones porcinos continúan creciendo después del trasplante en primates no humanos, lo que conduce al fracaso. Esto también requiere la administración de fármacos que puedan reducir este crecimiento, como el inhibidor de mTOR, temsirolimus y otros. Una forma de superar este problema de crecimiento continuo es eliminar (knock out) el receptor de la hormona del crecimiento en los cerdos, lo que da como resultado cerdos y órganos más pequeños en general. Por el momento, este problema se limita a los modelos preclínicos de primates no humanos para el xenotrasplante, aunque el control del tamaño de los órganos xenotransplantados puede ser importante en el caso de los xenotrasplantes pediátricos.
Como se ha señalado, la tecnología CRISPR/Cas ha dado lugar a varios avances clave en el campo del xenotrasplante en los últimos años. Entre ellos se incluyen:
- Trasplante de corazón de cerdo a un receptor humano vivo en 2022. El corazón porcino se modificó genéticamente de forma exhaustiva para aumentar las posibilidades de supervivencia. Las modificaciones genéticas incluyeron la eliminación de los genes de tres xenoantígenos (galactosa-α-1,3-galactosa, antígeno del grupo sanguíneo Sda y ácido N-glicolilneuramínico), la eliminación de los genes del receptor de la hormona del crecimiento para controlar el tamaño del órgano y la introducción de un total de seis genes humanos con el fin de humanizar el corazón porcino y mejorar la compatibilidad (CD46, factor acelerador de la descomposición, trombomodulina, receptor de la proteína C de las células endoteliales, CD47 y hemooxigenasa 1). Aunque no hubo pruebas evidentes de rechazo del xenoinjerto, el paciente falleció dos meses después del xenotransplante. Aunque es lamentable, este caso supone un logro/hito notable en este campo.
- Trasplante de corazón porcino a un receptor humano vivo en 2023. Realizado por el mismo equipo de médicos e investigadores que el xenotrasplante de 2022. Se utilizó un corazón porcino modificado genéticamente de forma similar. Al igual que en 2022, el paciente falleció seis semanas después de la cirugía. En ambos casos, durante la autopsia se observó un notable aumento del peso del corazón acompañado de un «engrosamiento miocárdico».
- Trasplante de riñón porcino a un receptor humano vivo en 2024. Al igual que los xenotransplantes de corazón porcino descritos anteriormente, el riñón porcino también fue modificado genéticamente, según se informa, con 69 ediciones genómicas realizadas mediante la tecnología CRISPR/Cas. El paciente falleció casi dos meses después de la cirugía.
- Trasplante de riñón y timo porcino a un receptor humano vivo en 2024. Este procedimiento fue único en cuanto al órgano trasplantado, denominado UThymoKidney™ (United Therapeutics Corporation). Consistía en un riñón porcino combinado con tejido del timo del mismo cerdo implantado en él para disminuir la probabilidad de rechazo, evitando que el sistema inmunitario del receptor reconociera el órgano trasplantado como un objeto extraño. A diferencia de los otros casos, el xenotrasplante se retiró del cuerpo del donante un mes y medio después de la cirugía debido a una insuficiencia orgánica, lo que requirió reanudar la diálisis. El paciente falleció pocas semanas después.
Pese a los continuos retos que plantea la supervivencia posquirúrgica, los ensayos clínicos siguen adelante. Por ejemplo, en 2025, United Therapeutics anunció la autorización por parte de la FDA estadounidense de su solicitud de nuevo fármaco en investigación (IND) para estudiar el UKidney™ en un ensayo clínico. El ensayo clínico de fase I/II está previsto que comience este verano y tiene como objetivo estudiar los efectos del xenotrasplante de 10 riñones modificados genéticamente (UKidney™), resultado de 10 modificaciones genéticas, una combinación de la eliminación de cuatro genes porcinos y la adición de seis genes humanos en pacientes con enfermedad renal terminal.
Más allá de los trasplantes de órganos
Los procedimientos de xenotransplante también pueden abordar otras afecciones, además de la insuficiencia orgánica. Gracias a técnicas de edición genética como CRISPR, las células y los tejidos animales pueden modificarse para tratar otras enfermedades humanas.
Diabetes tipo 1:
El trasplante de islotes de donantes humanos fallecidos a pacientes con diabetes tipo 1 ha sido un área de interés constante, pero la demanda de islotes supera la oferta. En los últimos años, el trasplante de islotes porcinos modificados genéticamente con xenoantígenos eliminados y la humanización mediante la expresión de proteínas humanas en primates no humanos han mostrado resultados prometedores. Sin embargo, siguen existiendo varios retos fundamentales, incluida la reacción inflamatoria e inmunitaria inicial al trasplante (IBMIR), así como las diferencias en la fisiología de los islotes y la secreción de insulina.
Síndrome de ovario poliquístico (SOP)
Recientemente, científicos de la Universidad Médica de Nanjing, en China, han probado el xenotrasplante de tejido adiposo marrón de ratas a ratones para tratar el SOP. El tejido adiposo marrón, comúnmente abreviado como BAT, es un tipo de grasa que interviene en el uso de lípidos y glucosa para la termogénesis y la regulación de la temperatura corporal. El xenotrasplante de BAT de rata a ratones permitió una corrección parcial del SOP y mejoró el rendimiento general de los ovarios en los ratones. Estos primeros estudios experimentales parecen prometedores y son un rayo de esperanza para las personas que padecen SOP, casi seis millones solo en Estados Unidos.
Cáncer
La aplicación del xenotrasplante en el cáncer implica el desarrollo de xenoinjertos derivados de pacientes, que son modelos creados mediante la implantación de tejidos y células cancerosas de pacientes en animales como ratones y ratas. Estos modelos son muy valiosos para comprender la fisiopatología de la enfermedad, probar y evaluar fármacos más eficaces y diseñar medicamentos personalizados.
Retos y oportunidades del xenotrasplante
A pesar de todas las mejoras en el xenotrasplante, siguen existiendo importantes obstáculos para su uso clínico generalizado. La complejidad de la compatibilidad inmunitaria significa que la ingeniería genética por sí sola puede no ser suficiente para prevenir el rechazo de órganos. También hay que abordar retos técnicos y éticos, concretamente las posibles infecciones y las diferencias en el tamaño de los órganos, así como cuestiones relacionadas con el consentimiento y el bienestar de los animales.
La comunidad médica también necesita comprender las implicaciones a largo plazo del xenotrasplante y contar con un marco regulatorio coherente y sólido que oriente los trabajos futuros. Debido a estos retos, el xenotrasplante sigue considerándose una línea de tratamiento experimental con numerosas barreras que superar.
Sin embargo, los avances en ingeniería genética que han dado lugar a mejoras tangibles proporcionan un impulso innegable a este campo. Con los continuos avances en la edición genética y la comprensión inmunitaria, el xenotrasplante podría ofrecer esperanza a miles o incluso millones de pacientes que necesitan órganos y tejidos.







