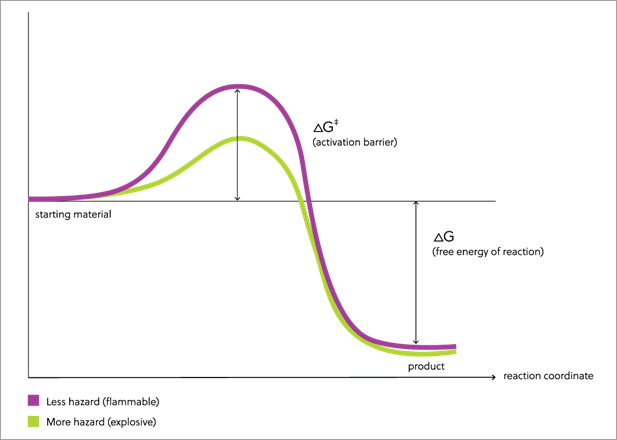
O nitrato de amônio é um composto químico com poder de alimentar bilhões, mas também de devastar. É o fertilizante mais potente, econômico e conveniente do mercado. Por isso, continua a ser armazenado em grandes quantidades nos portos e em outros lugares do mundo. No entanto, a explosão catastrófica ocorrida recentemente em Beirute é um lembrete dos perigos associados ao armazenamento e manuseio incorretos de nitrato de amônio, bem como a necessidade de aplicação cuidadosa de suas regulamentações.
A menos que todos que trabalham com nitrato de amônio, fabricantes, vendedores, usuários, socorristas e reguladores, estejam mais cientes dos perigos e implementem de forma diligente as normas de segurança, acidentes futuros serão inevitáveis.

Baixe este relatório detalhado do CAS Insights para obter informações sobre as propriedades químicas do nitrato de amônio, seus perigos e normas segurança e fornecer um recurso útil para as principais partes interessadas no âmbito desse composto.