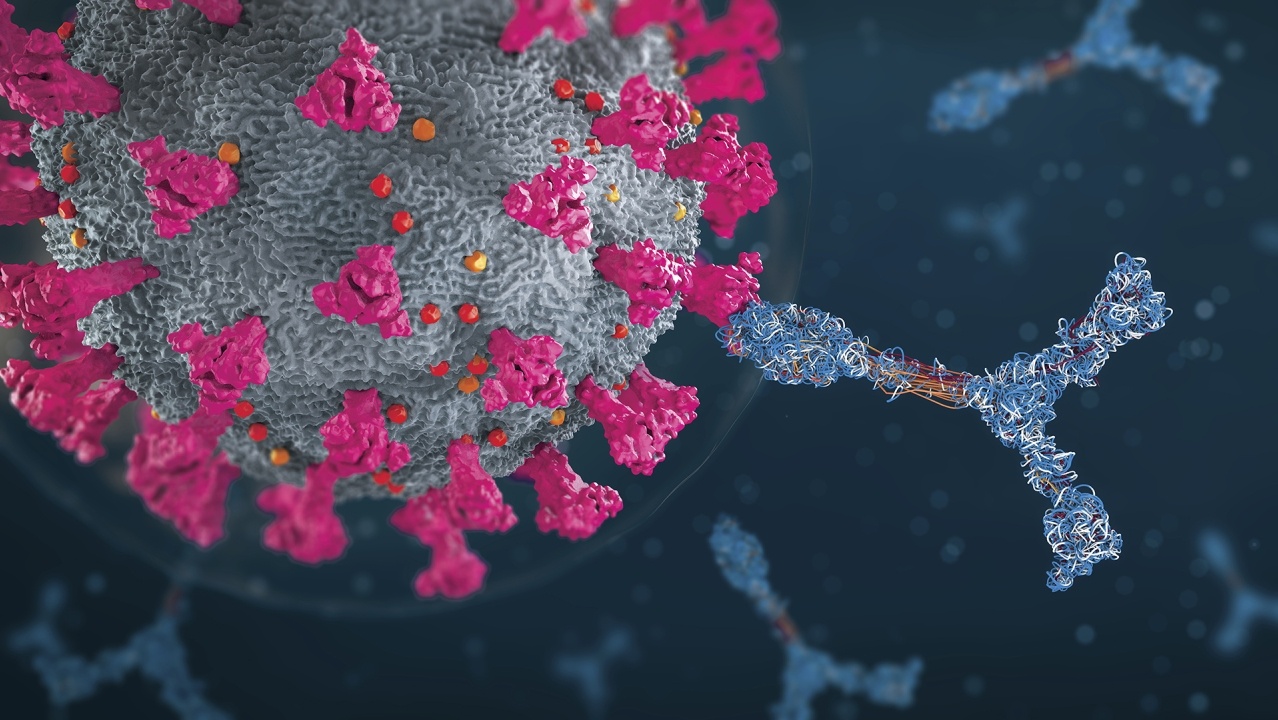
Un sujet récurrent, abordé dans le cadre de la pandémie de COVID-19, est la nécessité d'une disponibilité conséquente de tests de dépistage précis et efficaces pour la détection du SRAS-CoV-2 et des anticorps antiviraux chez les personnes infectées. La possibilité de détecter les cas bénins et asymptomatiques grâce au test permet un diagnostic précoce et la recherche des cas contacts, étapes essentielles pour prévenir la propagation discrète du virus. Afin de répondre à ce besoin, les chercheurs du monde entier s'efforcent de mettre au point des méthodes très précises, efficaces et rentables pour des tests rapides et évolutifs. Pour aider à mieux comprendre et comparer les nombreux tests de dépistage disponibles, le CAS a rédigé un rapport spécial résumant les principes de base des essais moléculaires et sérologiques utilisés dans les tests de dépistage du SRAS-CoV-2. Le rapport met en évidence les progrès récents des technologies de test et fournit une vue d'ensemble de plus de 200 tests de dépistage actuellement disponibles.
La plupart des tests de dépistage précoce de l'ARN du SRAS-CoV-2 reposent sur la réaction en chaîne par polymérase avec transcription inverse, mais les tests d'amplification isotherme des acides nucléiques, y compris l'amplification génique par TMA et les méthodologies basées sur CRISPR, constituent des alternatives prometteuses. L'identification des personnes qui ont développé des anticorps contre le virus SRAS-CoV-2 nécessite des tests sérologiques, notamment le test immuno-enzymatique (ELISA) et l’immunochromatographie La recherche rapide permet d'améliorer constamment la précision des tests, d'augmenter la capacité de traitement et de réduire le délai d'obtention des résultats, tout en offrant une plus grande variété d'analyses délocalisées. Ces progrès sont essentiels pour améliorer l'évolutivité des tests afin de répondre à la demande croissante de santé publique.