2022年のノーベル化学賞は、クリックケミストリーと生体直交化学の発展に貢献したことで、キャロライン・R・ベルトッツィ氏、モルテン・メルダル氏、そしてK・バリー・シャープレス氏の3名に贈られました。 彼らの研究は、環境条件下または生物的条件下で分子を短時間で結合させる反応を表したものです。 この研究は応用範囲が広く、高分子や製薬からはじまり、生物学的メカニズムの研究や新しいバイオ医薬品の開発に至るまでさまざまな場面で使われてきました。
生体直交化学に関するCASのリソース:Insight Report、Bioconjugate Chemistryに掲載されたジャーナル論文、生体直交化学における糖
の役割に関する記事
クリックケミストリーとは
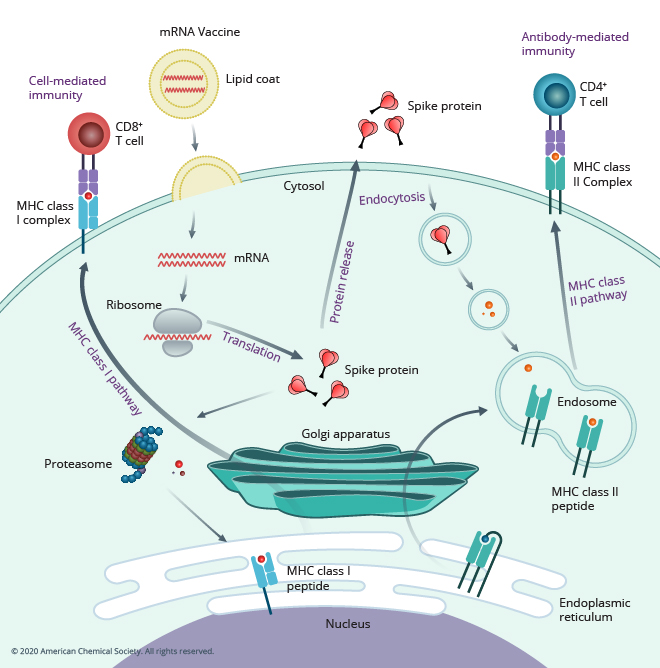
クリックケミストリーは、断片をより複雑な構造に組み立てるための迅速そして特異的な一連の反応です。 クリックケミストリーという用語は、K・バリー・シャープレス教授が、酵素阻害剤を作るために酵素の活性部位に小さな分子を結合させることを思い描いて作った造語です。 同教授とメルダール教授の研究室では、アジドと末端アルキンのヒュースゲン環化で位置選択的な銅触媒を用いたものによる1,2,3-トリアゾールの合成を開発しました。 この方法は容易かつ信頼性が高いため、高分子や抗体、そして医薬品の調製に使用されてきました。 チオール-エン反応やSuFEx反応など、特に高分子への利用で他のクリック反応も開発されています。
CASデータベースに収載されている文献では、その約3万件で「クリックケミストリー」のコンセプトが用いられています。 CASデータベースにおいて「クリックケミストリー」に言及した最も古い文献は1999年(”Click chemistry: a concept for merging process and discovery chemistry” (with H. C. Kolb), Book of Abstracts, 217th ACS National Meeting, Anaheim, Calif., March 21-25 (1999), ORGN-105 Publisher: American Chemical Society, Washington, D.C)である一方、当グループによるアジド-アルキン環化付加反応に関する最も早い文献は2002年でした。 クリックケミストリーに関するシャープレス博士のグループの文献で最も引用されているのは、”Click chemistry: diverse chemical function from a few good reactions” で、11,000回以上引用されています。
生体直交化学とは
生体直交化学(1990年代後半にキャロライン・ベルトッジ氏が初めて使用した用語)は、生物学的条件下(室温とそれに近い温度で水溶液中の、生体分子の存在下、しかも低濃度)で急速に起こる反応を記述したものです。 細胞内にはさまざまな官能基を持つ分子が多数存在しており、単一の官能基と選択的に行われる反応は、生体系の挙動を理解する上で有用であると考えられます。
キャロライン・ベルトッジ氏の研究グループは、生体系内の炭水化物の研究に用いるため、エステル置換トリアリールホスフィンとアジドのシュタウディンガー反応を最初に開発しました。 ただ、アジド・アルキン環化付加を室温の生物学的条件下で迅速に行うために必要な銅触媒は、細胞に対して毒性があります。 そこでベルトッジ氏の研究室では、1960年代初頭にウィッティングとクレブスが行った研究をもとに、歪環状アルキンの開発を行いました。 この環状アルキンは、無触媒かつ室温で歪み促進型アジド-アルキン付加環化(SPAAC)を起こすため、生細胞での利用が可能です。 SPAACは、生細胞内の生物学的プロセスを観察し、理解するうえで重要な役割を担っています。 その他、様々な生体直交反応が開発されています。
CASデータベース内の約3,000件の文献で「生体直交化学」という用語が使用されていますが、その中で最も早期に言及があったのは、 ベルトッジ教授の研究室の博士課程の学生だったG. A. Lemieuxの博士論文でした。 ベルトッジ教授の研究室による生体直交反応の開発は、"From Mechanism to Mouse: A Tale of Two Bioorthogonal Reactions" で紹介されています。 生体直交反応の概要については、別のレビューで述べられていますが、これは生体直交化学を論じたベルトッジ研究グループの論文では2400回と、最も多く引用されています。
ノーベル賞受賞までの道のりとはどんなものなのか
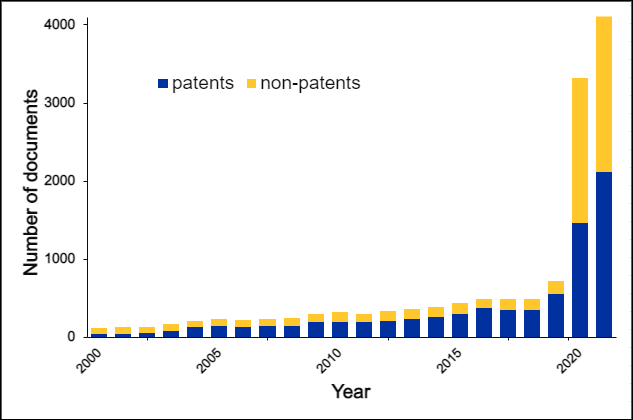
生体直交化学は、この20年間で目覚ましく発展し、近年では、より広範囲に使用されるようになっています。 この分野で注目すべき進展や応用を、こちらの年表にまとめます。
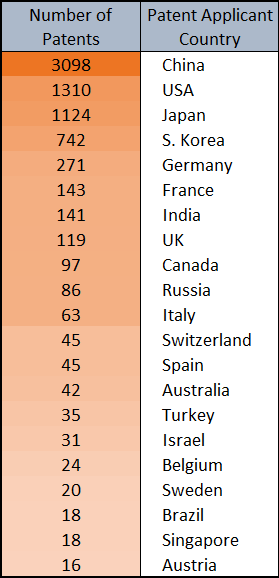
さらに、CAS コンテンツコレクションを分析して、生体直交の用語の文献数の増加と生体直交化学の応用の増加を比較しました。
これでわかるのは、2010年から2020年にかけて生体直交化学で最も利用されたのはイメージングであり、次いで製薬への応用であることです。 生体直交化学をラベリングに利用する方法は、創薬への利用とほぼ同じ文献数で報告されていますが、ラベリングは、それ例外では特徴付けることのできない多様な利用をも指している可能性があります。 また、メカニズム解析や質量分研究用のハイドロゲルまたは診断薬に生体直交化学を使用した文献数も同程度に存在しています。
生体直交化学の今後の可能性
これらのアプローチにより、イメージング、診断、薬物送達の分野は多大な変化を遂げましたが、さらに以下の分野でも大きなチャンスが存在しています。
- 生物学的安定性を向上させた反応性の高いパートナー開発の探求、または触媒の必要性を排除(毒性の低減)することによる方法の簡素化
- 複数のラベリングにより生物学的メカニズムの探求を容易にすることでより信頼性の高い診断薬の獲得
- 光活性化学物質の改良により、生体へのダメージを最小限に抑え、生体のより深部からのイメージングの実現
これらの方法のお陰で、より簡単で信頼性の高い合成や、生物学的メカニズムに対するさらなる理解、そしてより効果的で選択的な治療法の開発が可能になりました。 その結果として、化学、生物学、医学の各分野における進歩が実現し、ほかの方法では不可能だったことが可能になったのです。 この分野での活動状況をまとめたものが以下にありますので、ご参照ください。過去のトレンドに基づき、生体直交化学の今後の可能性に焦点を当てています。CASのInsights Reportをダウンロードするか、または査読付きの文献でお読みください。