Le prix Nobel de chimie 2022 a été décerné à Carolyn R. Bertozzi, Morten Meldal et K. Barry Sharpless pour le développement de la chimie click et de la chimie bioorthogonale. Leurs travaux décrivent les réactions qui peuvent être utilisées pour connecter rapidement les molécules dans des conditions ambiantes ou biologiques. Ces recherches possèdent de larges applications et ont été utilisées à partir de polymères et de produits pharmaceutiques pour étudier les mécanismes biologiques et développer de nouvelles biothérapeutiques.
CAS Ressources sur la chimie bioorthogonale : rapport Insight, article de journal dans Bioconjugate Chemistry, article sur le rôle des sucres en chimie bioorthogonale
Qu'est-ce que la chimie click ?
La chimie click est un ensemble de réactions rapides et spécifiques permettant d'assembler des fragments pour obtenir des structures plus complexes. Le terme chimie click a été inventé par le professeur K. Barry Sharpless, qui a imaginé la formation d'inhibiteurs des enzymes en associant de plus petites molécules sur le site actif d'une enzyme. Son laboratoire et celui de Morten Meldal ont développé des versions régiosélectives catalysées par le cuivre de la cycloaddition d'azides et d'alkynes terminaux pour former des 1,2,3-triazoles. Cette méthode a été utilisée pour préparer des polymères, des anticorps et des produits pharmaceutiques, en raison de sa simplicité et de sa fiabilité. D'autres réactions click, comme les réactions thiolène et SuFEx, ont également été développées, en particulier pour une utilisation dans les polymères.
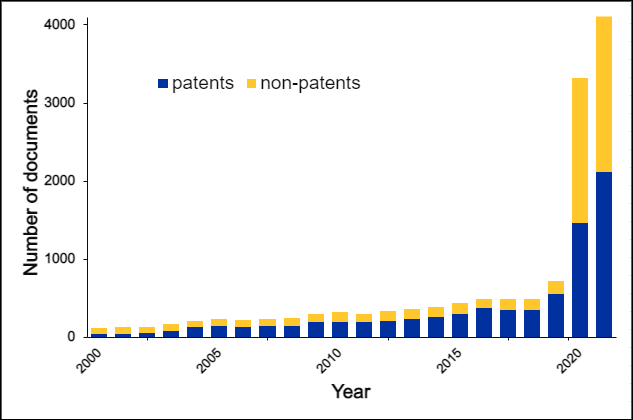
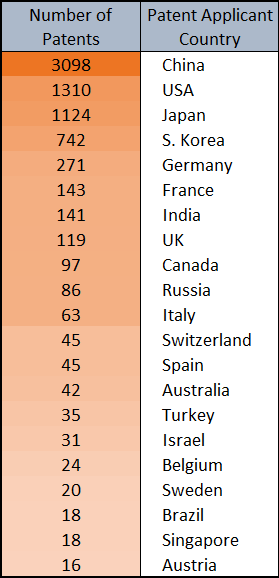
Environ 30 000 documents des bases de données CAS ont utilisé le concept de « chimie click ». La première référence à la « chimie click » dans les bases de données CAS remonte à 1999 (« Click chemistry: a concept for merging process and discovery chemistry » (Chimie click : un concept de fusion de la chimie des processus et de la recherche) (avec H. C. Kolb), Book of Abstracts, 217e réunion nationale de l'ACS, Anaheim, Californie, 21-25 mars (1999), ORGN-105 Éditeur : American Chemical Society, Washington, D.C.) tandis que la première référence à la réaction de cycloaddition d'alkynes à l'azide du groupe date de 2002. Le document le plus cité par le groupe Sharpless sur la chimie click, « Click chemistry: diverse chemical function from a few good reactions » (Chimie click : fonction chimique diverse à partir de quelques bonnes réactions) a été cité plus de 11 000 fois.
Qu'est-ce que la chimie bioorthogonale ?
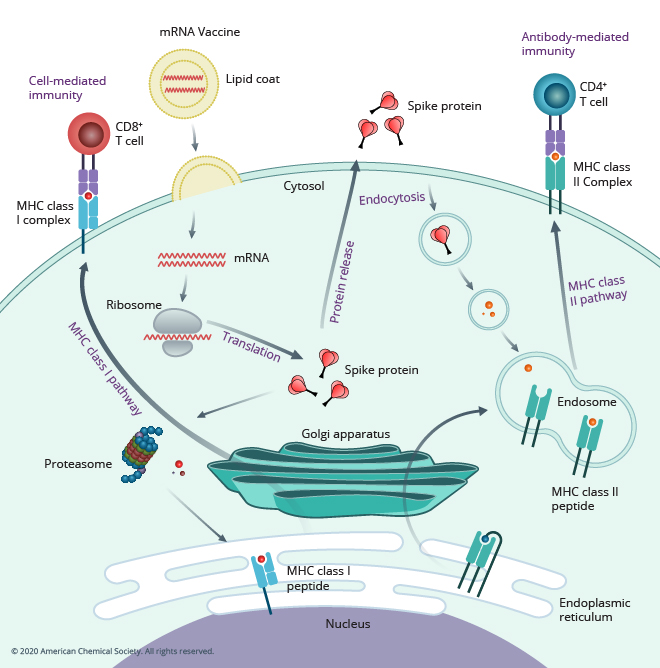
La chimie bioorthogonale (un terme utilisé pour la première fois par Carolyn Bertozzi à la fin des années 1990) décrit les réactions qui se produisent rapidement dans des conditions biologiques (à température ambiante ou une température proche, dans des solutions aqueuses, en présence de molécules biologiques et à faibles concentrations). De nombreuses molécules appartenant à des groupes fonctionnels différents sont présentes dans les cellules et des réactions sélectives avec un seul groupe fonctionnel seraient utiles pour comprendre le comportement des systèmes biologiques.
Carolyn Bertozzi et son groupe de chercheurs ont développé pour la première fois les réactions de Staudinger d'azides avec des triarylphosphines substitués par des esters pour une utilisation dans l'étude des hydrates de carbone dans les systèmes biologiques. Les catalyseurs du cuivre nécessaires à la fabrication rapide de cycloadditions d'alkyne à l'azide dans des conditions biologiques à température ambiante sont toxiques pour les cellules. Le laboratoire Bertozzi a développé des alkynes cycliques contraints à partir des travaux réalisés par Wittig et Krebs au début des années 1960. Les alkynes cycliques subissent des cycloadditions d'alkynes à l'azide favorisées par la contrainte (SPAAC) sans catalyseur et à température ambiante et par conséquent, peuvent être utilisés dans des cellules vivantes. La réaction SPAAC était importante pour visualiser et comprendre les processus biologiques dans les cellules vivantes. Un certain nombre d'autres réactions bioorthogonales ont été développées.
Environ 3 000 documents des bases de données CAS ont utilisé le terme « chimie bioorthogonale », dont la première référence concerne la thèse de doctorat de G.A. Lemieux, un étudiant en doctorat du laboratoire du professeur Bertozzi. Le développement de réactions bioorthogonales par le laboratoire du professeur Bertozzi est évoqué dans « From Mechanism to Mouse: A Tale of Two Bioorthogonal Reactions » (Du mécanisme à la souris : description de deux réactions bioorthogonales). Un aperçu des réactions bioorthogonales est fourni dans une révision distincte, laquelle est aussi l'article le plus cité par le groupe Bertozzi discutant la chimie bioorthogonale, avec plus de 2 400 citations.
À quoi ressemble le parcours vers un prix Nobel ?
La chimie bioorthogonale s'est considérablement développée au cours des vingt dernières années et ses utilisations se sont élargies depuis quelques années. Les développements et applications les plus notables dans ce domaine sont résumés dans cette ligne chronologique.
En outre, CAS Collection de contenus a été analysée afin de comparer la hausse des publications de termes bioorthogonaux et l'augmentation des applications de la chimie bioorthogonale.
Cette figure indique que l'imagerie était la plus importante utilisation de la chimie bioorthogonale de 2010 à 2020, suivie des applications pharmaceutiques. L'utilisation de la chimie bioorthogonale dans l'étiquetage a été rapportée dans pratiquement autant de documents que son utilisation dans les produits pharmaceutiques, même si l'étiquetage représente probablement une variété d'utilisations non caractérisées par ailleurs. Des nombres similaires de documents évoquaient la chimie bioorthogonale dans les hydrogels ou les agents diagnostics pour des études de mécanistique ou de spectrométrie de masse.
Quelles sont les perspectives d'avenir de la chimie bioorthogonale ?
Les domaines de l'imagerie, des diagnostics et de l'administration de médicaments ont été transformés par ces approches, mais d'autres opportunités se présenteront dans les secteurs suivants :
- Explorer le développement de partenaires réactifs avec des stabilités biologiques améliorées, ou simplifier les méthodes en éliminant le besoin de catalyseurs (en réduisant la toxicité)
- L'étiquetage multiple pourrait faciliter l'exploration des mécanismes biologiques et d'agents diagnostiques plus fiables
- Des chimies améliorées activées par la lumière pourraient minimiser les dommages aux organismes et permettre une imagerie depuis un lieu encore plus profond dans les organismes vivants
Ces méthodes ont permis une synthèse plus facile et plus fiable, une meilleure compréhension des mécanismes biologiques et le développement de traitements plus efficaces et plus sélectifs. Leurs travaux ont permis de réaliser des progrès en chimie, en biologie et en médecine, permettant des travaux qui n'auraient pas été possibles autrement. Pour bénéficier d'une vue unique du paysage dans ce domaine, téléchargez notre rapport Insight qui s'appuie sur les tendances historiques pour présenter les opportunités futures pour la chimie bioorthogonale, ou consultez l'article révisé par des pairs.