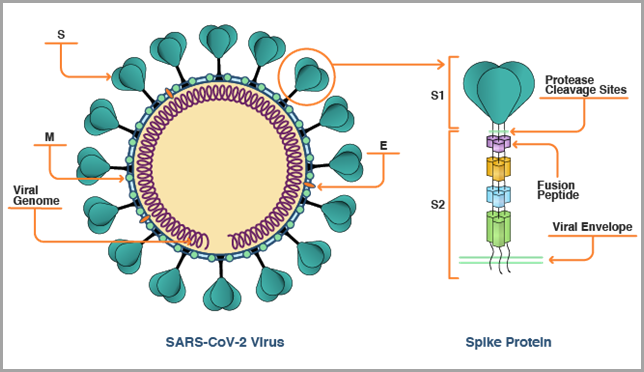
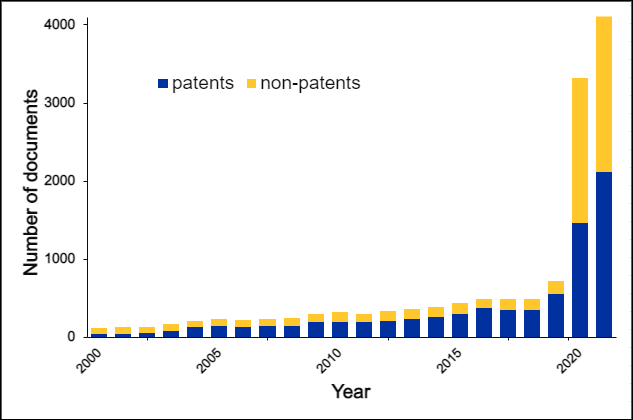
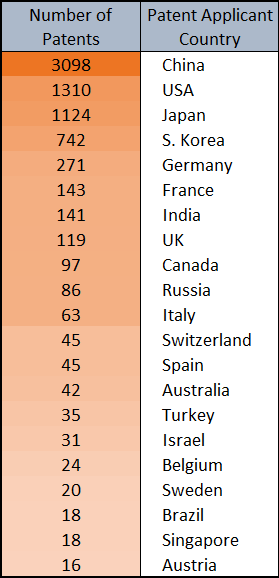
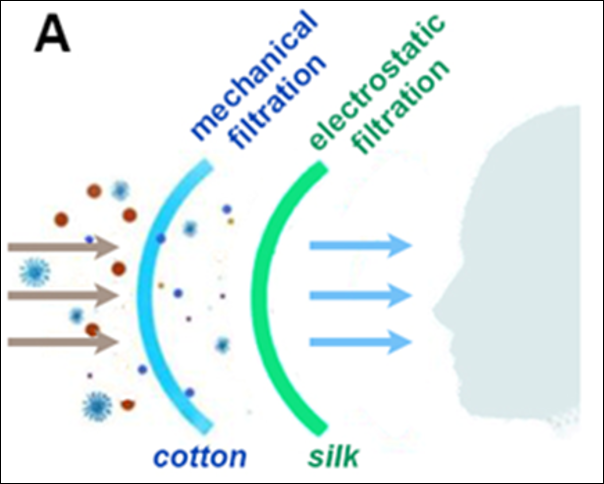
Los pegamentos moleculares y los degradadores de proteínas diana están transformando el panorama del descubrimiento de medicamentos. Con este método, las proteínas de interés se “pegan” a las ligasas de ubiquitina E3 del sistema ubiquitina-proteosoma, que participa en la renovación de proteínas y elimina las proteínas sobrantes o dañadas del organismo. Obtenga más información sobre su auge en el tratamiento de enfermedades oncológicas, inflamatorias e inmunitarias y sobre aspectos como sus tendencias, dianas proteínicas, mecanismos científicos y mucho más en nuestro artículo más reciente.
Una perspectiva experta de la ponente Janet Sasso
Este seminario web moderado por Angela Zhou se celebró en directo el 5 de octubre de 2022 con la participación de varios expertos externos:
La sección introductoria se centró en el análisis del panorama, las tendencias de investigación, las principales ligasas usadas como dianas y una vista más conectada de los actores emergentes y las áreas terapéuticas. Puede obtener más información en el informe detallado publicado en CAS Insights.
Momentos destacados del seminario web
El Dr. Ebert empezó analizando algunos de los pegamentos moleculares naturales, como la ciclosporina y los pegamentos moleculares que no usan la ligasa E3 para la destrucción de las proteínas, como FK-506. También habló en profundidad de los análogos de la talidomida que se están explorando en la práctica y en Dana-Farber. Además, repasó algunos de los desafíos prácticos del uso de las bibliotecas y los cribados genéticos para identificar y entender los mecanismos de estas nuevas estructuras.
El Dr. Chamberlain inició su presentación hablando del mecanismo por el que los pegamentos moleculares confieren una función neomórfica a la maquinaria celular del organismo. Se centró en los análogos de la talidomida como prototipos de pegamentos y en los desafíos de desarrollarlos ante la resistencia de la especie al factor de transcripción IKZF1 y la identificación de SALL4 como principal impulsor de la teratogenia. Por último, compartió algunas conclusiones prácticas derivadas de las lecciones aprendidas sobre el diseño, el cribado y la validación de bibliotecas específicas en el ámbito de los pegamentos moleculares.
Para terminar, los asistentes formularon una amplia gama de preguntas: desde preguntas básicas sobre la formación de pegamentos moleculares a otras más avanzadas sobre los modelos. En suma, fue un interesante panel que puso de relieve las oportunidades futuras relacionadas con los pegamentos moleculares, los degradadores de proteínas diana y el tratamiento de enfermedades con importantes necesidades no resueltas. Puede ver la grabación del seminario web y las diapositivas complementarias aquí.