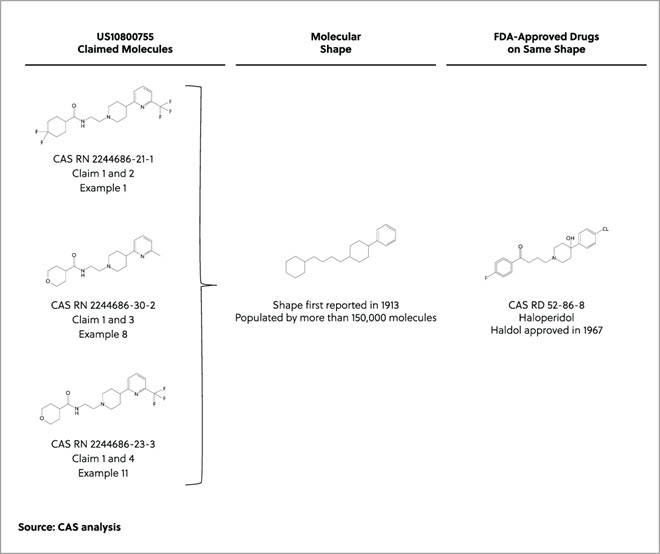
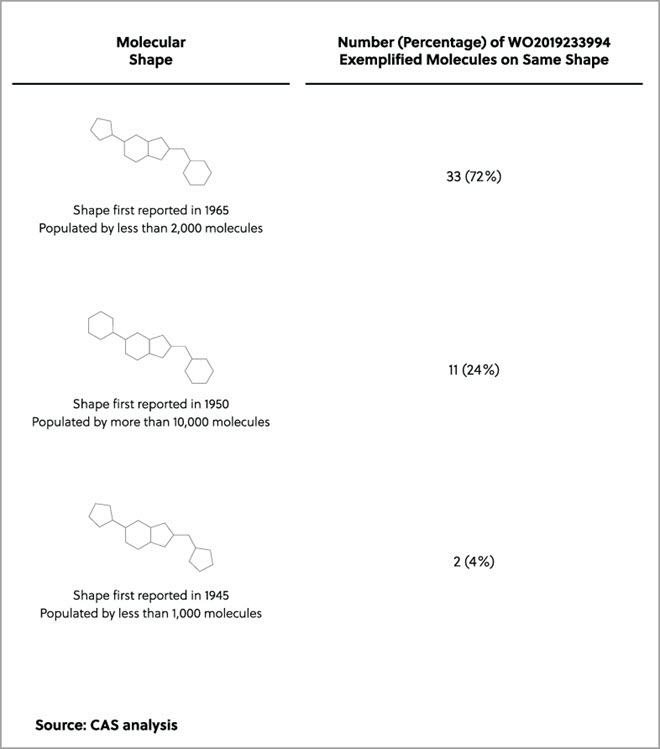
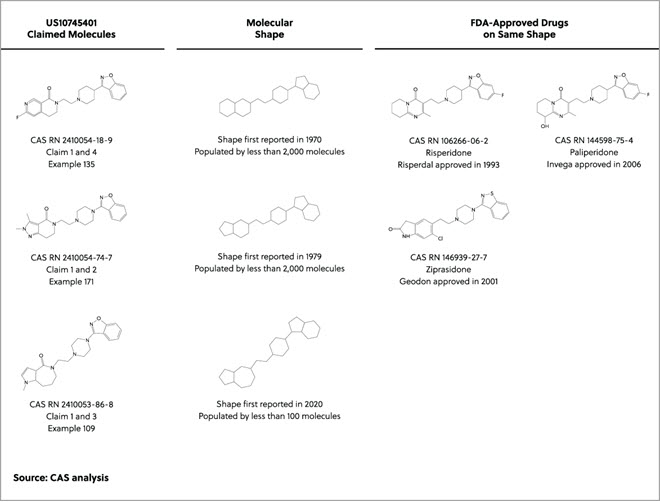
海面上昇と気候変動が世界中のコミュニティーに影響している現在、工業国はアウトプットを管理し、環境への影響を削減するプロセスを探しています。 1990年代から躍進を遂げているアプローチにグリーンケミストリーがあります。これは「有害物質の使用や発生を低減あるいは廃絶する化学製品やプロセスの発明、設計、そして応用」に注目した科学分野です。
1998年、ポール・アナスタス氏とジョン・ワーナー氏がその共著の中で、化学製造による人体と環境への影響を削減するさまざまな方法など、グリーンケミストリーの基盤を形作る12の原則を設定しました。 ところが、業界によっては、グリーンケミストリーの実行導入は採算性の意味で正当化できない妥協になる、と見るところもあります。
グリーンケミストリーで製薬業界に波を起こす
ACS Green Chemistry Instituteは、次のように述べています。「グリーンケミストリーとエンジニアリングにおいて、あれだけ研究の進歩が見られたのに、主流の化学業界ではまだその技術を完全には受け入れていません。 現在、有機化学物質の98%がまだ石油から作られているのです。」グリーンケミストリー運動が政策や商行為、そして消費者の認識などに影響を与え続けて行く中、企業は収益を維持しながらも「グリーン化」できる新しい方法を模索する必要が出てきています。 これは、特に製薬業界に言えることです。
ACS Green Chemistry Instituteは、「製薬業界におけるグリーンケミストリーとグリーンエンジニアリングの統合を加速させつつ、イノベーションを促進する」ために、ACS GCI Pharmaceutical Roundtableを結成しました。この円卓会議には、アストラゼネカ、バイエル、イーライリリー、 グラクソ・スミスクライン、メルク、 ノバルティス、ファイザー、武田、そしてその他各社が参加しています。
製薬業界では、歴史的に実績のある製造法や研究方法を変えることに抵抗を示してきました。その意味で今回、これほど多くの有名な製薬会社が関わっていることは心強い限りです。 各種規制や知的財産、フェイルファスト要件などですでに課題を抱えている産業にとっては、グリーンケミストリーという原則を採用することはさらなるハードルになるとみなされがちです。しかし製薬会社は、それがもたらす効率性や経費削減に気付き始めています。
グリーンケミストリーの原子経済の原則(つまりプロセスで使用される材料はすべて使い切って最終製品に組み込まれるように合成方法を設計するべきであるという原則)を製薬R&Dに適用することで、 副産物は減り、ひいては保管や廃棄コストが最小限に抑えられます。コストには、溶媒も大きく影響します。化学オペレーションの標準バッチの50%〜80%が典型的に溶媒であり、エネルギー消費の大部分も占めているほか、プロセス安全上でも最大の懸念事項になっています。
例えば、メルク社ではCOVID-19の治療薬の抗ウイルス剤、モルヌピラビルの製造において、より環境に配慮した方法を開発しました。 その結果、溶剤の無駄が省かれ、収率が1.6倍向上し、5つあった工程が3工程に短縮されるなどの利点がありました。 2022年には米国環境保護庁はこの功績を評価し、Greener Reaction Conditions Awardを授与しています。
アムジェン社でも、特定の非小細胞肺がんの治療用新薬であるルマクラーズ™をよりグリーンに合成できる方法を開発しています。 その結果、大量の溶媒廃棄物を発生させていた精製工程を削減することで、年間317万ポンドの節約と、収率の向上といった利点がありました。 米国環境保護庁はこれに対しても、 2022年にGreener Reaction Conditions Awardを授与しています。
グリーンケミストリー運動の先端を行く
どの製薬会社でも、その根本目標は革新的な医薬品を提供して世界中の暮らしを向上させることにあります。 この目標を環境に優しい方法で、しかもサステナブルに達成するためには、製薬会社はその分野での最新の研究へのアクセスが必要になります。 従来の合成プロセスを超えたイノベーションが必要なのです。
1990年代後半ごろ、そしてアナスタス博士とワーナー博士の革新的な共著が出版されたのと時を同じくして、薬剤の設計と合成法におけるグリーンケミストリーの利用に関する研究が劇的に増え始めました。 今では、科学文献にはこの分野に関する210万本を超える雑誌論文が含まれています。
他の新興分野にも言えることですが、科学文献における一貫性のない用語の使用は、最新の発見を利用したい場合の障害になります。 製薬会社では、サステナビリティのための合成方法を最適化するにあたり、よりグリーンな化学、つまり反応や試薬、溶剤そして触媒を研究者が簡単に見つけられるような情報ソリューションが必要とされています。
CASの科学者達は、世界最大の化学洞察のコレクションを収集する際に、グリーンケミストリー関連の情報もインデックス化しています。 この知的情報のインデックス化により、薬剤研究者は必要なグリーンケミストリー情報をすばやく探し出すことができます。この情報には、比類ないCASコンテンツコレクション™に収載された、4万5000件以上もの「グリーン」化学反応も含まれています。
またCASでは、パッケージング開発など、製造の他の側面での最新グリーンケミストリーの動向についての展望も提供しています。 詳細は、『よりグリーンなプラスチック代替品、バイオベースポリマー』を取り上げた、CAS Insight Reportをご覧ください。





 ケーススタディをダウンロード
ケーススタディをダウンロード