Los microARN (miARN/miR) son ARN cortos, de 20-22 nucleótidos, no codificantes, que desempeñan un papel fundamental en la regulación génica, al interactuar con moléculas de ARN mensajero (ARNm) diana. Se estima que los microARN pueden modular hasta el 60 % de los genes codificadores de proteínas del genoma humano a nivel de traducción. Participan en varios procesos fisiológicos, como la diferenciación, la proliferación, la apoptosis y el desarrollo, y su desregulación se ha relacionado con diversos trastornos patológicos.
La importancia del microARN se puso de relieve con el Premio Nobel de Fisiología o Medicina de 2024, otorgado a Victor Ambros y Gary Ruvkun «por el descubrimiento de los microARN y su papel en la regulación genética postranscripcional». Estos científicos publicaron por primera vez su descubrimiento del microARN en 1993 y, en 2000, el grupo de investigación de Ruvkun identificó el let-7, un microARN codificado por el gen let-7, de alta conservación en diversas especies animales. Desde entonces, ha habido un gran interés en desarrollar terapias con microARN.
Los problemas relacionados con la toxicidad y la administración eficaz de estos ácidos nucleicos siguen siendo un reto. Menos de 20 terapias con microARN han llegado a ensayos clínicos, y ninguna de ellas se encuentra en fase III. Aproximadamente la mitad de los ensayos terapéuticos con microARN iniciados tuvieron que suspenderse o interrumpirse debido a la toxicidad del microARN y otros efectos secundarios graves.
Sin embargo, las nuevas investigaciones están avanzando. Los avances en los sistemas de administración de fármacos a nanoescala están abordando los problemas de eficacia y toxicidad, y es posible que las terapias con microARN se utilicen más ampliamente a medida que sigan mejorando los métodos de administración.
Biogénesis del microARN y mecanismo de acción
Los microARN pueden encontrarse como unidades transcripcionales independientes o incrustados en los intrones o exones de otros genes. Existen dos vías de biogénesis del microARN: la vía canónica y la vía no canónica (véase la Figura 1).
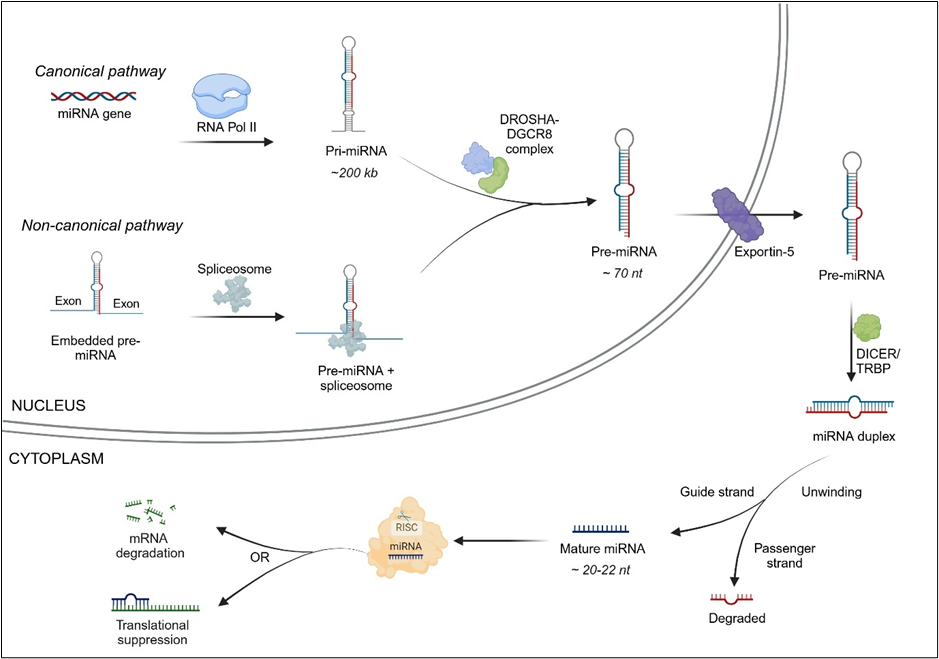
En la vía canónica, los microARN se transcriben a partir de genes de microARN como transcritos primarios largos de microARN (pri-miARN) mediante la ARN polimerasa II (ocasionalmente la ARN polimerasa III). Los pri-miARN pueden tener varias kilobases de longitud, con secuencias flanqueantes en 5' y 3', y pueden contener los bucles de tallo de varios microARN maduros. Los pri-miARN son procesados por la proteína nuclear DGCR8 (región crítica 8 del síndrome de DiGeorge) y la enzima DROSHA en estructuras en forma de horquilla denominadas pre-miARN.
En la vía no canónica, los precursores del microARN situados dentro de los intrones del ARNm se escinden, sin pasar por la etapa DGCR8/DROSHA. A continuación, los pre-miARN se exportan al citoplasma con la ayuda de la exportina-5. Una vez en el citoplasma, la enzima RNasa DICER actúa sobre el bucle en horquilla del pre-miARN y lo escinde para producir un dúplex de microARN maduro. Una cadena del dúplex de microARN (la cadena guía) se asocia con la proteína Argonauta (AGO) en el complejo de silenciamiento inducido por ARN (RISC), mientras que la otra cadena (cadena pasajera) se degrada. Normalmente hay una preferencia por la cadena que se incorpora al RISC en función de factores como la estabilidad termodinámica. Por último, el ARNm diana se degrada o sufre una supresión traductora.
Los métodos de administración mejorados aproximan las innovaciones
Lograr una administración eficaz de los microARN terapéuticos a las células diana es un reto complejo, debido a su inestabilidad y susceptibilidad a la degradación. Las metodologías actuales incluyen sistemas virales (virus adenoasociados, adenovirus y vectores lentivirales) y sistemas no virales (nanopartículas lipídicas, nanopartículas poliméricas, nanopartículas inorgánicas, vesículas extracelulares y péptidos).
La administración de microARN mediada por virus ha demostrado ser eficaz, pero este método también presenta una alta inmunogenicidad. Por el contrario, los vectores no virales muestran una relativa estabilidad y una baja inmunogenicidad. Como resultado, los investigadores están explorando numerosos tipos de nanotransportadores no virales para administrar microARN de forma eficaz a las células.
Las nanopartículas basadas en lípidos (LNP) son los vectores habitualmente utilizados, dado que protegen el microARN y tienen una buena biocompatibilidad. Recientemente se han desarrollado LNP a partir de lípidos catiónicos ionizables para lograr una administración más eficaz del microARN. Las LNP también pueden incluir «lípidos coadyuvantes» como el colesterol o la dioleoilfosfatidiletanolamina (DOPE) para mejorar la estabilidad y reducir la toxicidad. Se ha demostrado que la incorporación de polietilenglicol (PEG) reduce la agregación de las nanopartículas y aumenta el tiempo de circulación.
También se están produciendo avances importantes con portadores basados en polímeros, como el ácido poliláctico-co-glicólico (PLGA). Los investigadores desarrollaron una estrategia de inhibición del microARN-210 con ácidos nucleicos peptídicos gamma antisentido (γPNA) con eficacia de unión al ARN mejorada y los encapsularon en nanopartículas de PLGA. El PLGA ha recibido la aprobación de la FDA como vehículo de administración y se encuentra en fase II de ensayos para terapias con ARN pequeño interferente.
Las nanopartículas inorgánicas, como el oro y la sílice, también muestran potencial como portadores de microARN, pero las preocupaciones actuales sobre su toxicidad, en particular en el caso del oro, pueden limitar su uso clínico.
Diferentes estrategias para el uso de microARN como terapia
Hemos examinado la Colección de contenidos CASTM, el mayor repositorio de información científica catalogada por expertos, para comprender mejor el panorama de la investigación sobre el microARN. En los últimos años se ha producido un notable aumento de las publicaciones relacionadas con el microARN, aunque las publicaciones en revistas están disminuyendo ligeramente. Sin embargo, las publicaciones de patentes siguen aumentando, lo que sugiere un interés comercial sostenido en este ámbito (véase la Figura 2).

El objetivo de las terapias con microARN es alterar y, en el mejor de los casos, restaurar los patrones de expresión anormales o patológicos del microARN. Actualmente existen dos enfoques para lograrlo: los estimuladores o potenciadores del microARN y los inhibidores del microARN. El primer grupo incluye principalmente miméticos de microARN, mientras que el segundo grupo comprende oligonucleótidos antiMIR (AMO), máscaras, esponjas y señuelos de microARN. Como se observa en la figura 3, la mayoría de las publicaciones se refieren a inhibidores de microARN (67,7 %). Entre estas publicaciones, los AMO son los más comunes.
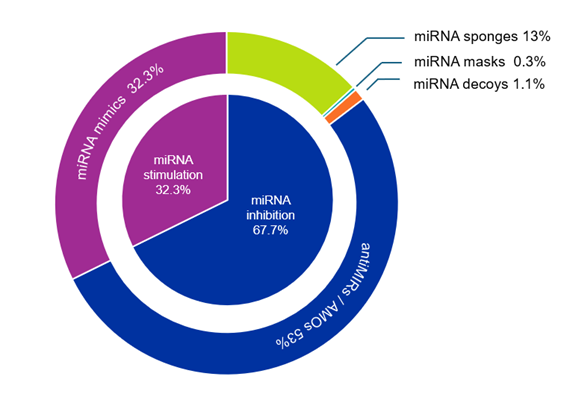
Estas diversas estrategias funcionan de la siguiente manera:
- Miméticos de microARN: moléculas sintéticas de ARN pequeño de doble cadena que coinciden con la secuencia de microARN correspondiente, imitando la acción del microARN sintetizado de forma natural. El objetivo es reponer funcionalmente la expresión de microARN perdida o disminuida en condiciones patológicas.
- antiMIR/AMO/antagomiR: pequeñas moléculas de ARN sintético monocatenario basadas en oligonucleótidos antisentido de primera generación, que pueden presentar modificaciones químicas (por ejemplo, los antiMIR con una modificación 2-O-metoxietilo también se denominan antagomiR). Se unen funcionalmente a los microARN con secuencias complementarias e impiden su interacción con el ARNm diana, lo que finalmente aumenta su expresión.
- Esponjas de microARN: microARN artificiales que contienen repeticiones en tándem de secuencias de oligonucleótidos con sitios de unión de microARN (MBS) para formar un microARN maduro de interés. Secuestran los microARN endógenos diana, dejando libres los MBS en los ARNm diana, lo que conduce a su regulación al alza. Los circmiR son esponjas de microARN circulares con el mismo mecanismo de acción, pero más estables.
- Señuelos de microARN: variante de las esponjas de microARN que se caracteriza por estructuras de tallo y bucle (el bucle contiene MBS).
- Máscaras de microARN: oligonucleótidos monocatenarios con modificación 2ʹ-O-metoxietilo (u otra modificación química). Son perfectamente complementarios a los MBS en el 3'UTR del ARNm diana, lo que dificulta la interacción entre el microARN y el ARNm y aumenta los niveles de expresión del ARNm.
Explorar el potencial de los microARN como agentes terapéuticos
El microARN podría tratar diversas enfermedades debido a su amplia gama de funciones en la expresión génica. Según nuestro análisis de la Colección de contenidos CAS, el cáncer es el área terapéutica más investigada (67,5 %), seguida de los trastornos cardiovasculares (10,2 %), las infecciones (4,5 %), la diabetes (4,4 %) y los trastornos neurodegenerativos (4,3 %) (véase la Figura 4).

Cáncer
Los miARN oncogénicos (oncomiR) influyen considerablemente en el desarrollo del cáncer, al participar en muchas vías de señalización, incluida la supresión de genes supresores de tumores y la activación de oncogenes. La familia miR-34 (miR-34a, miR-34b, miR-34c), que está bajo control de la regulación del gen supresor de tumores TP53, regula a la baja varios genes, como la ciclina D1, E2, CDK4, CDK6, BCl2 y Myc, lo que provoca la detención del ciclo celular y la apoptosis, y restringe el crecimiento tumoral. El grupo MiR-17-92, comúnmente denominado «oncomir-1», se dirige e inhibe supresores tumorales como PTEN, p21 y E2F, lo que da lugar a un aumento de la proliferación celular, la supervivencia y la angiogénesis. El MiR-21 se dirige principalmente al PTEN, PDCD4 y TIMP3, y activa vías que favorecen la supervivencia, como PI3K/Akt y MAPK, lo que promueve aún más el crecimiento, la invasión y la metástasis del tumor. Los microARN también desempeñan un papel crucial en la modulación de la resistencia a los fármacos de las células cancerosas, además de regular los supresores tumorales y los oncogenes.
Enfermedades cardiovasculares
Estudios recientes de perfilado han identificado muchos microARN que se expresan de forma diferencial en las enfermedades cardiovasculares (ECV) de manera espaciotemporal, lo que apunta a un nuevo enfoque para regular afecciones como el infarto de miocardio, la aterosclerosis, la insuficiencia cardíaca, el ictus y la hipertensión, entre otras. Algunos ejemplos son el miARN-29 en la fibrosis cardíaca, el miARN-21 y el miR-155 en la miocardiopatía, y el miARN-34 en el infarto de miocardio. El miR-21 y el miR-29 también desempeñan un papel crucial en el depósito de la matriz extracelular durante la remodelación cardíaca patológica. Dicer, una enzima necesaria para la maduración de todos los microARN, muestra una expresión anómala durante la insuficiencia cardíaca. Estudios funcionales han demostrado que la eliminación específica de Dicer en el corazón provoca cardiomiopatía progresiva, insuficiencia cardíaca y muerte en ratones. Los datos disponibles sugieren en conjunto que Dicer/microARN desempeñan un papel fundamental en las funciones cardíacas normales, así como en condiciones patológicas, y se están investigando como dianas terapéuticas en las ECV.
Infecciones
Los microARN se están investigando en las interacciones entre el hospedador y el patógeno en más de 50 infecciones (bacterianas, víricas, fúngicas y parasitarias). Los microARN pueden ayudar a combatir las enfermedades infecciosas de múltiples maneras. Regulan proteínas específicas implicadas en las vías inmunitarias innatas y adaptativas, lo que ayuda a ajustar la respuesta inmunitaria a las infecciones. Pueden utilizarse para atacar genes patógenos e inhibir su replicación. Por ejemplo, tratamientos como el RG-101 y el miravirsen (inhibidores del miR-122) se dirigen a los microARN del hospedador para combatir la infección por hepatitis C. Los microARN también se están investigando para crear vacunas atenuadas mediante la incorporación de elementos de respuesta a los microARN en los genomas de las vacunas virales. Algunos patógenos, como el ébola, producen sus propios microARN, que pueden establecerse como diana para reducir su patogenicidad y mejorar los resultados del tratamiento.
Diabetes
Las pruebas emergentes sugieren que los microARN desempeñan un papel clave en las funciones de las células beta (supervivencia, proliferación, diferenciación y secreción de insulina) y en la modulación de la resistencia o sensibilidad a la insulina. Pueden influir en las respuestas inflamatorias, que suelen estar intensificadas en los pacientes diabéticos. Al reducir la inflamación, los microARN pueden ayudar a controlar las complicaciones asociadas con la diabetes. Varios ensayos preclínicos y estudios in vitro destinados a encontrar terapias basadas en microARN para la diabetes han mostrado resultados prometedores.
Enfermedades neurodegenerativas
Los microARN pueden regular la expresión de genes implicados en enfermedades neurodegenerativas, reducir la neuroinflamación y proteger las neuronas frente a la apoptosis. Algunos ejemplos son el miR-124 y miR-132, que favorecen la salud y función neuronal, y las familias miR-29 y miR-34, que se dirigen a genes asociados con la producción de beta amiloide en la enfermedad de Alzheimer. Los microARN también pueden promover la neurogénesis, que es crucial para la reparación cerebral, y se sabe que el miR-9 y el miR-124 desempeñan roles importantes en la neurogénesis. La desregulación de los microARN puede provocar un deterioro neurológico y el desarrollo de enfermedades neurodegenerativas. Por lo tanto, la modulación de estos microARN ofrece una nueva vía para el tratamiento de estas afecciones.
Hemos representado los microARN más frecuentes en el conjunto de datos de la bibliografía y hemos visualizado su distribución en las cinco áreas terapéuticas principales como parte de nuestro análisis (véase la Figura 5).
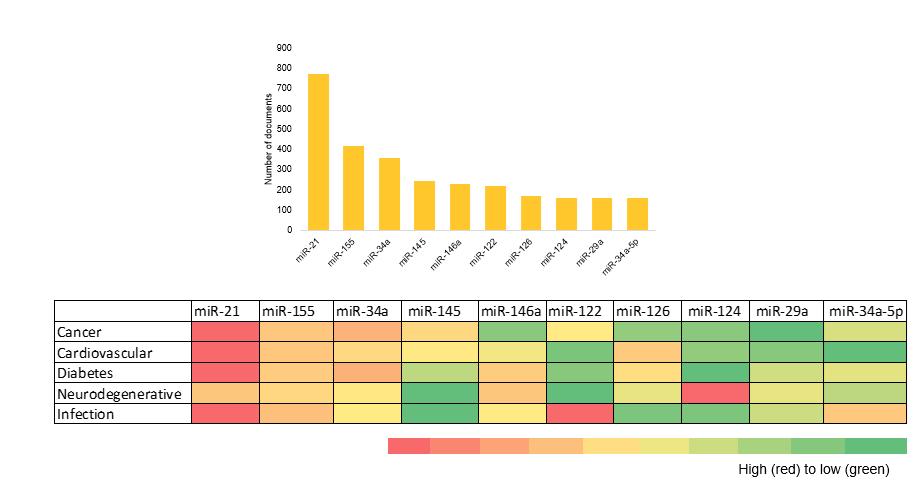
También llevamos a cabo un análisis de coocurrencia para determinar qué tipos de terapias con microARN están más estrechamente asociadas con las cinco afecciones principales en la bibliografía (vea la Figura 6).

Perspectivas de las terapias con microARN
Hemos observado nuevos avances prometedores en las terapias con microARN. Sin embargo, aún quedan retos por superar antes de que estos tratamientos puedan utilizarse en la práctica clínica. Es necesario realizar ensayos clínicos para confirmar la seguridad y la eficacia de las diferentes estrategias y métodos de administración del microARN. La respuesta inmunitaria no deseada, la acumulación tisular inespecífica y la degradación endosómica son otras complicaciones significativas en el desarrollo de terapias basadas en microARN.
Investigaciones recientes demuestran que se están produciendo avances y que el futuro de estas terapias es prometedor. Las tecnologías avanzadas como CRISPR/Cas para dirigirse a los genes de microARN y los modelos basados en inteligencia artificial para predecir las dianas del microARN ofrecen interesantes oportunidades para desarrollar terapias con microARN.
Las terapias con microARN podrían transformar pronto la atención a los pacientes con numerosas enfermedades gracias a la innovación continua.