microRNA(miRNA/miR)는 20~22개의 짧은 뉴클레오타이드 비코딩 RNA로, 표적 메신저 RNA(mRNA) 분자와 상호 작용하여 유전자 조절에 중요한 역할을 합니다. microRNA는 인간 게놈의 단백질 코딩 유전자를 번역 수준에서 최대 60%까지 조절할 수 있는 것으로 추정됩니다. 분화, 증식, 세포 사멸 및 발달과 같은 여러 생리적 과정에 참여하며, microRNA의 조절 장애는 다양한 병리학적 장애와 관련이 있습니다.
Victor Ambros and Gary Ruvkun의 "microRNA의 발견과 전사 후 유전자 조절에서의 역할"에 2024년 노벨 생리의학상이 수여되면서 microRNA의 중요성이 강조된 바 있습니다. 이 과학자들은 1993년 microRNA 발견을 처음 발표했고, 2000년까지 Ruvkun의 연구 그룹은 다양한 동물 종에서 고도로 보존되어 있는 let-7 유전자에 의해 암호화되는 microRNA인 let-7을 발견했습니다. 그 이후로 microRNA 치료제 개발에 대한 관심이 크게 높아졌습니다.
이러한 핵산의 독성 및 효과적인 전달 문제는 여전히 해결해야 할 과제로 남아 있습니다. 임상시험에 진입한 microRNA 치료제는 20개 미만이며, 그 중 3상 단계에 있는 치료제는 없습니다. microRNA 독성 및 기타 심각한 부작용으로 인해 시작된 microRNA 치료제 임상시험의 약 절반이 중단되거나 종료되어야 했습니다.
하지만 새로운 연구가 진전을 보이고 있습니다. 나노 크기의 약물 전달 시스템의 발전으로 효능과 독성 문제가 해결되고 있으며, 전달 방법이 계속 개선됨에 따라 microRNA 치료제가 더 널리 활용될 수 있습니다.
microRNA의 생합성과 작용 메커니즘
microRNA는 독립적인 전사 단위로 존재하거나 다른 유전자의 인트론 또는 엑손에 포함될 수 있습니다. microRNA 생물발생에는 표준 경로와 비표준 경로의 두 가지 경로가 있습니다(그림 1 참조).
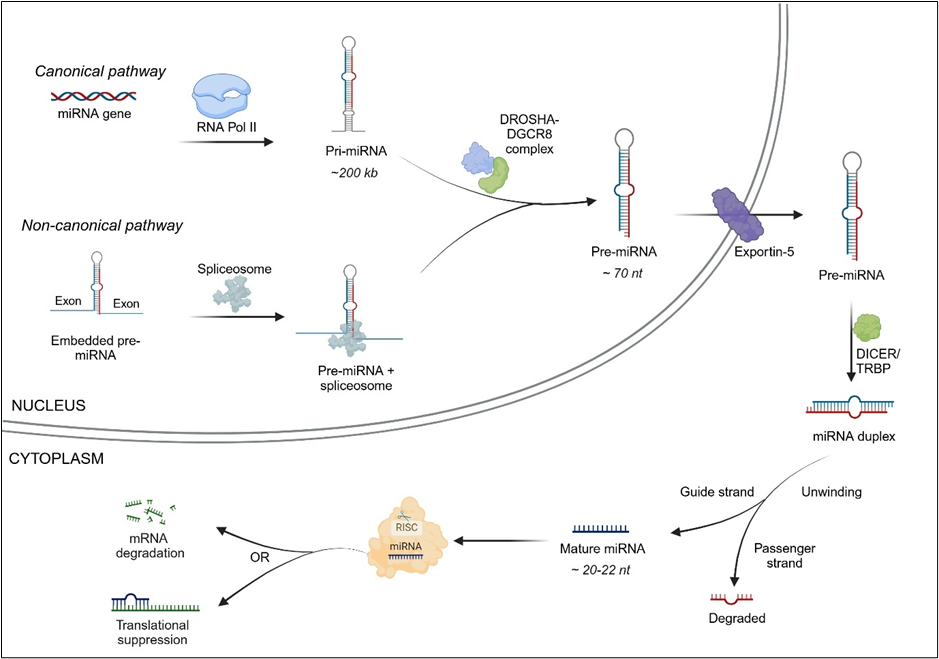
표준 경로에서 microRNA는 RNA 중합효소 II(때때로 RNA 중합효소 III)에 의해 microRNA 유전자에서 긴 1차 microRNA 전사체(pri-miRNA)로 전사됩니다. Pri-miRNAs는 5’ 및 3’ 플랭킹 서열을 가진 수 킬로베이스 길이일 수 있으며 여러 성숙한 microRNA의 줄기-루프를 포함할 수 있습니다. Pri-miRNA는 핵 단백질 DGCR8(디조지 증후군 임계 영역 8)과 효소 DROSHA에 의해 처리되어 pre-miRNA 전사체라고 불리는 헤어핀 모양의 구조로 전환됩니다.
비표준 경로에서는 mRNA 인트론 내에 위치한 microRNA 전구체가 스플라이싱되어 DGCR8/DROSHA 단계를 우회합니다. 그런 다음 Pre-miRNA는 익스포틴-5의 도움을 받아 세포질로 내보내집니다. 세포질에 들어가면 RNase 효소인 DICER가 Pre-miRNA 헤어핀 루프에 작용하여 이를 절단하여 성숙한 microRNA 듀플렉스를 생성합니다. microRNA 이중 가닥의 한 가닥(가이드 가닥)은 RNA 유도 침묵 복합체(RISC) 내의 아르고노트(AGO) 단백질과 결합하고, 다른 가닥(승객 가닥)은 분해됩니다. 일반적으로 열역학적 안정성과 같은 요소에 따라 RISC에 통합되는 가닥에 대한 선호가 있습니다. 마지막으로, 표적 mRNA는 분해되거나 번역 억제를 겪습니다.
개선된 전달 방법으로 더 가까워진 혁신
microRNA 치료제를 표적 세포에 효과적으로 전달하는 것은 그들의 불안정성과 분해되기 쉬운 특성 때문에 복잡한 도전 과제입니다. 현재 방법론에는 바이러스 시스템(아데노 관련 바이러스, 아데노바이러스, 렌티바이러스 벡터)과 비바이러스 시스템(지질 기반 나노입자, 고분자 나노입자, 무기 나노입자, 세포외 소포, 펩타이드)이 포함됩니다.
바이러스 매개 microRNA 전달은 효과가 입증되었지만, 이 방법은 높은 면역원성을 나타냅니다. 반대로 비바이러스 벡터는 상대적으로 안정적이며 면역원성이 낮습니다. 그 결과, 연구자들은 세포에 microRNA를 효과적으로 전달하기 위해 다양한 유형의 비바이러스성 나노 운반체를 탐구하고 있습니다.
지질 기반 나노입자(LNP)는 microRNA를 보호하고 생체 적합성이 뛰어나기 때문에 가장 일반적으로 사용되는 운반체입니다. LNP는 최근 microRNA의 보다 효율적인 전달을 위해 이온화 가능한 양이온 지질에서 개발되었습니다. LNP는 안정성을 높이고 독성을 줄이기 위해 콜레스테롤이나 디올로일포스파티딜에탄올아민(DOPE)과 같은 '보조 지질'을 포함할 수 있습니다. 폴리에틸렌 글리콜(PEG)을 포함하면 나노입자의 응집이 줄어들고 순환 시간이 증가하는 것으로 나타났습니다.
폴리(락틱-코-글리콜산)(PLGA)를 포함한 폴리머 기반 운반체에서도 새로운 혁신이 나타나고 있습니다. 연구자들은 RNA 결합 효능이 향상된 안티센스 γ 펩타이드 핵산(γPNA)을 사용하여 microRNA-210 억제 전략을 개발하고, 이를 PLGA 나노입자에 캡슐화했습니다. PLGA는 전달체로서 FDA 승인을 받았으며, 작은 간섭 RNA(siRNA) 치료를 위한 2상 임상시험 중입니다.
금과 실리카 같은 무기 나노입자는 microRNA 운반체로서의 가능성을 보여주지만, 특히 금에 대한 지속적인 독성 우려로 인해 임상적 사용이 제한될 수 있습니다.
microRNA를 치료제로 활용하는 다양한 전략
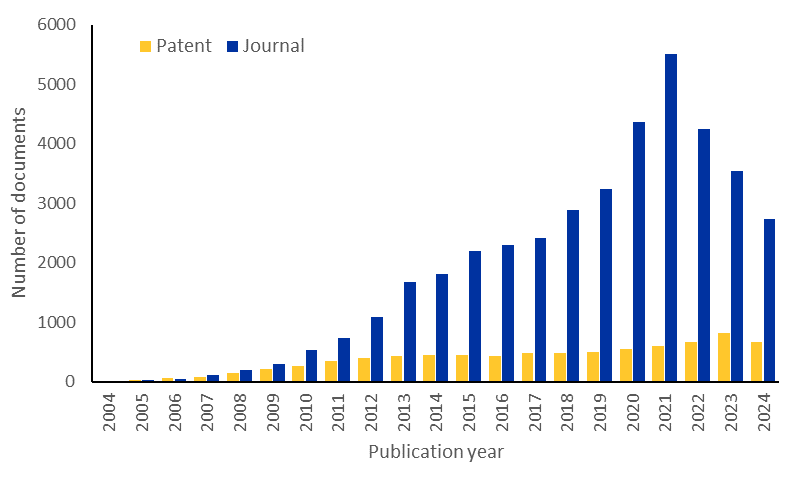
microRNA의 연구 동향을 더 잘 이해하기 위해 전문가가 엄선한 최대 규모의 CAS 과학 정보 저장소인 CAS 컨텐츠 컬렉션TM을 조사한 결과, 최근 몇 년 동안 microRNA 관련 간행물이 눈에 띄게 증가했지만, 학술지 간행물은 현재 약간 감소하고 있습니다. 그러나 특허 출간물이 계속 증가하고 있어 이 분야에 대한 상업적 관심이 지속되고 있음을 시사합니다(그림 2 참조).
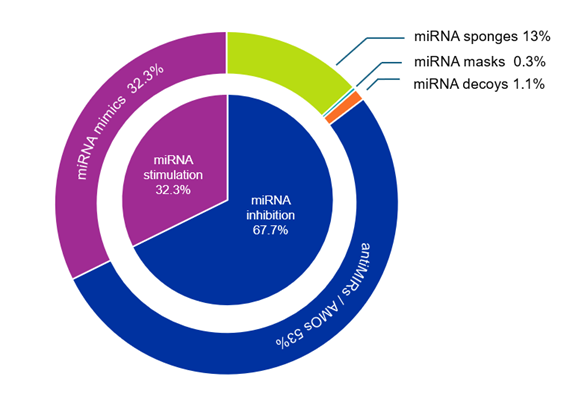
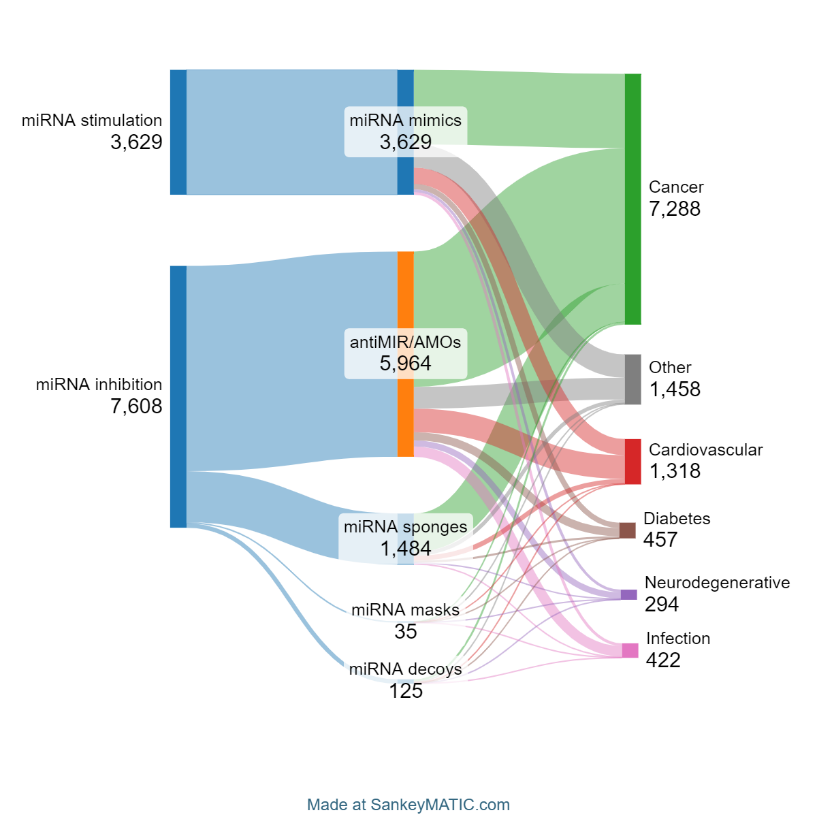
microRNA 치료제의 목표는 비정상적이거나 병적인 microRNA 발현 패턴을 수정하고 이상적으로 복원하는 것입니다. 현재 이를 달성하기 위한 두 가지 접근 방식, 즉 microRNA 자극제 또는 인핸서와 microRNA 억제제가 있습니다. 첫 번째 그룹에는 주로 microRNA 모방체가 포함되며, 두 번째 그룹에는 antiMIR 올리고뉴클레오티드(AMO), microRNA 마스크, 스펀지, 미끼가 포함됩니다. 그림 3에서 볼 수 있듯이, 대부분의 논문은 microRNA 억제제(67.7%)와 관련이 있습니다. 이러한 논문 중 AMO가 가장 일반적입니다.
이러한 다양한 전략은 다음과 같이 작동합니다.
- microRNA 모방: 해당 microRNA 서열과 일치하는 합성 이중 가닥 작은 RNA 분자로, 자연적으로 합성된 microRNA의 작용을 모방합니다. 병리학적인 조건에서 손실되거나 감소된 microRNA 발현을 기능적으로 보충하는 것이 목표입니다.
- antiMIRs/AMOs/anatagomiRs: 1세대 안티센스 올리고뉴클레오티드를 기반으로 하며, 화학적 변형이 있을 수 있는 합성 단일 가닥의 작은 RNA 분자입니다(예: 2-O-메톡시에틸 변형이 있는 antiMIR은 antagomiR이라고도 함). 이들은 기능적으로 상보적인 염기서열을 가진 microRNA에 결합하여 표적 mRNA와의 상호작용을 방지하고 결국 발현을 증가시킵니다.
- microRNA 스폰지: 관심 있는 성숙한 microRNA를 위한 microRNA 결합 부위(MBS)와 올리고뉴클레오티드 염기서열의 탠덤 반복을 포함하는 인공 microRNA입니다. 표적 내인성 microRNA를 격리하여 표적 mRNA의 MBS를 자유롭게 하여 상향 조절을 유도합니다. CircmiR은 동일한 작용 메커니즘을 가지지만 더 안정적인 원형 microRNA 스펀지입니다.
- microRNA 미끼: 줄기 및 루프 구조(루프에 MBS 포함)를 특징으로 하는 microRNA 스펀지의 변형입니다.
- microRNA 마스크: 2ʹ-O-메톡시에틸 변형(또는 기타 화학적 변형)이 있는 단일 가닥 올리고뉴클레오타이드입니다. 표적 mRNA의 3'UTR에 있는 MBS를 완벽하게 보완하여 microRNA-mRNA 상호 작용을 방해하고 mRNA 발현 수준을 증가시킵니다.
치료제로서의 microRNA의 잠재력 살펴보기
microRNA는 유전자 발현에서 다양한 기능을 수행하여 다양한 질병을 해결할 수 있습니다. CAS 컨텐츠 컬렉션 분석에 따르면, 암은 가장 두드러진 연구 치료 분야로 나타났으며(67.5%), 그 뒤를 심혈관 질환(10.2%), 감염(4.5%), 당뇨병(4.4%), 신경퇴행성 질환(4.3%)이 잇습니다(그림 4 참조).
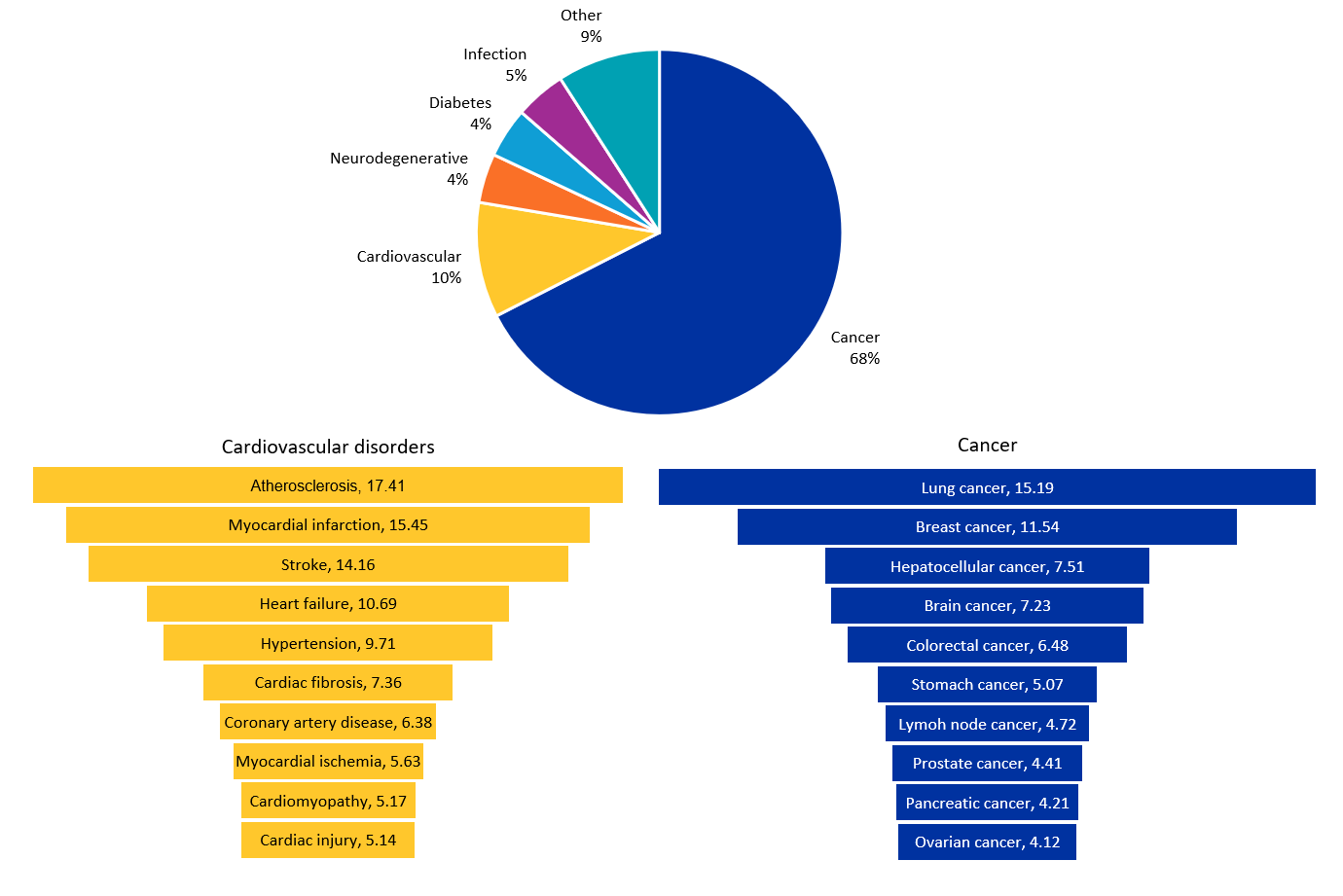
암
발암성 miRNAs(oncomiRs)는 종양 억제 유전자의 억제와 종양 유전자의 활성화를 포함한 여러 신호 전달 경로에 참여하여 암 발달에 상당한 영향을 미칩니다. TP53 종양 억제 유전자의 조절 하에 있는 miR-34 계열(miR-34a, miR-34b, miR-34c)은 Cyclin D1, E2, CDK4, CDK6, BCl2, Myc와 같은 여러 유전자를 하향 조절하여 세포 주기 정지와 세포 사멸을 유도하고 종양 성장을 제한합니다. MiR-17-92 클러스터는 일반적으로 “oncomir-1”로 불리며, PTEN, p21, E2F와 같은 종양 억제제를 표적으로 삼아 억제하여 세포 증식, 생존 및 혈관신생을 증가시킵니다. MiR-21은 주로 PTEN, PDCD4, TIMP3를 표적으로 삼고 PI3K/Akt 및 MAPK와 같은 생존 지원 경로를 활성화하여 종양의 성장, 침습, 전이를 더욱 촉진합니다. microRNA는 종양 억제 인자와 종양 유전자를 조절하는 것 외에도 암 세포의 약물 저항성을 조절하는 데 중요한 역할을 합니다.
심혈관 질환
최근 프로파일링 연구에 따르면 심혈관 질환(CVD)에서 시공간적으로 차별적으로 발현되는 많은 microRNA가 확인되어 심근경색, 죽상경화증, 심부전, 뇌졸중, 고혈압 등의 질환을 조절하는 새로운 접근 방식이 제시되고 있습니다. 예를 들어 심장 섬유증에서 miRNA-29, 심근병증에서 miRNA-21 및 miR-155, 심근경색에서 miRNA-34가 있습니다. miR-21과 miR-29도 병적 심장 리모델링 과정에서 세포외 기질 침착에 중요한 역할을 합니다. 모든 microRNA의 성숙에 필요한 효소인 다이서는 심부전 중에 비정상적인 발현을 보입니다. 기능 연구에 따르면 다이서의 심장 특이적 녹아웃은 쥐에서 진행성 심근병증, 심부전 및 사망에 이르는 것으로 나타났습니다. 이용 가능한 데이터를 종합해 볼 때, Dicer/microRNA는 정상적인 심장 기능뿐만 아니라 병리적 조건에서도 중요한 역할을 하며, CVD의 치료 타깃으로 연구되고 있습니다.
감염
microRNA는 50개 이상의 감염(세균성, 바이러스성, 진균성, 기생충성)에서 숙주-병원체 상호작용을 연구하는 데 사용되고 있습니다. microRNA가 감염병을 퇴치하는 데 도움말이 되는 방법은 여러 가지가 있습니다. 선천적 및 후천적 면역 경로에 관여하는 특정 단백질을 조절하여 감염에 대한 면역 반응을 미세 조정하는 데 도움을 줍니다. 병원체 유전자를 표적으로 하여 그들의 복제를 억제하는 데 사용할 수 있습니다. 예를 들어, RG-101 및 미라비르센(miR-122 억제제)과 같은 치료제는 C형 간염 감염을 퇴치하기 위해 숙주 microRNA를 표적으로 삼습니다. microRNA는 또한 microRNA 반응 요소를 바이러스 백신 게놈에 통합하여 약독화 백신을 생성하는 연구가 진행되고 있습니다. 에볼라와 같은 일부 병원체는 병원성을 감소시키고 치료 결과를 개선하기 위해 표적으로 삼을 수 있는 자체 microRNA를 생성합니다.
당뇨병
새로 나온 증거에 따르면 microRNA는 베타 세포 기능 (생존, 증식, 분화, 인슐린 분비)과 인슐린 저항성이나 민감도 조절에 중요한 역할을 합니다. 이는 일반적으로 당뇨병 환자에서 고조되는 염증 반응에 영향을 미칠 수 있습니다. 염증을 줄임으로써, microRNA는 당뇨병과 관련된 합병증 관리에 기여할 수 있습니다. microRNA 기반 당뇨병 치료제 개발을 목표로 한 여러 전임상 시험과 체외 연구에서 유망한 결과를 보여주었습니다.
신경퇴행성 질환
microRNA는 신경퇴행성 질환에 관여하는 유전자의 발현을 조절하고, 신경 염증을 줄이며, 신경세포를 세포자멸사로부터 보호할 수 있습니다. 예를 들어 신경 건강과 기능을 지원하는 miR-124 및 miR-132, 그리고 알츠하이머병의 아밀로이드 베타 생성과 관련된 유전자를 표적으로 하는 miR-29 및 miR-34 계열이 있습니다. microRNA는 뇌 회복에 중요한 역할을 하는 신경 생성을 추가로 촉진할 수 있으며, miR-9과 miR-124는 신경 생성에 중요한 역할을 하는 것으로 알려져 있습니다. 조절 장애가 있는 microRNA는 신경학적 기능 저하와 신경 퇴행성 질환의 발병으로 이어질 수 있습니다. 따라서 이러한 microRNA를 조절하는 것은 이러한 질환을 치료하기 위한 새로운 방향을 제공합니다.
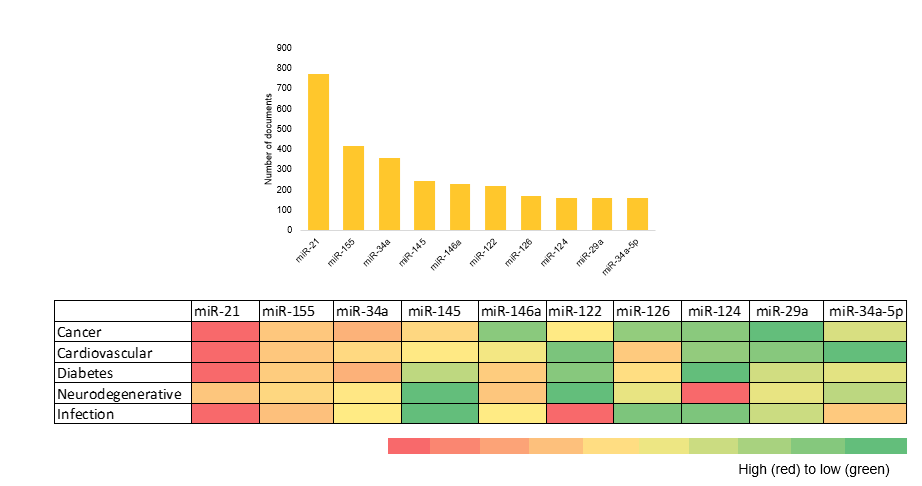
분석의 일환으로 문헌 데이터 세트에서 가장 흔히 발생하는 microRNA를 플로팅하고 상위 5개 치료 영역에 걸쳐 그 분포를 시각화했습니다(그림 5 참조).
또한 문헌에 나타난 5가지 주요 질환과 가장 밀접한 관련이 있는 microRNA 치료 유형을 확인하기 위해 동시 발생 분석을 실시했습니다(그림 6 참조).
microRNA 치료제의 전망
microRNA 치료제에서 유망한 새로운 발전이 이루어지고 있습니다. 하지만 이러한 치료제가 임상에서 사용되기까지 극복해야 할 과제가 남아 있습니다. 다양한 microRNA 전략과 전달 방법의 안전성과 효능을 확인하려면 임상시험이 진행되어야 합니다. 원치 않는 면역 반응, 비특이적 조직 축적, 엔도솜 분해는 microRNA 기반 치료제를 개발하는 데 있어 또 다른 중요한 과제입니다.
최근 연구에 따르면 획기적인 발전이 이루어지고 있으며 이러한 치료제의 미래는 밝습니다. microRNA 유전자를 표적으로 하는 CRISPR/Cas와 같은 첨단 기술과 microRNA 표적을 예측하는 인공지능 기반 모델은 microRNA 치료제를 개발할 수 있는 흥미로운 기회를 보여줍니다.
microRNA 치료제는 지속적인 혁신을 통해 수많은 질병에 대한 환자 치료를 곧 변화시킬 수 있습니다.