Proteínas RAS, um alvo incerto?
Cerca de um em cada cinco tipos de câncer humano tem pelo menos uma forma de mutação RAS (K-RAS, H-RAS e N-RAS), tornando o RAS a família de genes com mutação mais frequente em cânceres humanos. As proteínas RAS, localizadas na membrana plasmática da célula, atuam como um interruptor molecular, que enviam sinais para o crescimento celular. No entanto, mutações nas proteínas RAS podem fazer com que elas fiquem constantemente ativas e enviem sinais de crescimento de forma incontrolável, o que leva à proliferação celular anormal e à formação de câncer.
Apesar de sua prolificidade, há uma nítida falta de terapias que tenham as proteínas RAS como alvo. Os inibidores do RAS vêm sendo investigados para o tratamento do câncer há mais de três décadas, mas as proteínas RAS passaram a ser conhecidas como “intratáveis” devido ao seu potencial inibitório incerto – isto é, até recentemente. No início deste ano, a FDA aprovou o sotorasibe (desenvolvido pela Amgen e comercialmente conhecido como Lumakras™) para o tratamento do câncer de pulmão – o primeiro inibidor do RAS aprovado como terapia.
A aprovação do sotorasibe é um passo importante na inibição do RAS, e os esforços de pesquisa e desenvolvimento na descoberta de outros inibidores do RAS se intensificaram. Aqui, exploramos como está sendo preenchida a lacuna das proteínas RAS – que antes eram consideradas alvos incertos e intratáveis, agora surgem como um tratamento promissor contra o câncer.
K-RAS: a mutação mais comum dos genes RAS
Os genes RAS codificam proteínas que existem em quatro isoformas: K-RAS4A, K-RAS4B, N-RAS e H-RAS. As isoformas do RAS mutantes, códons e substituição de aminoácidos variam de acordo com o tecido e o tipo de câncer, mas as mais comuns são as mutações na isoforma K-RAS, encontrada em aproximadamente 22% dos cânceres com mutação de RAS. Oitenta por cento (80%) das mutações do K-RAS ocorrem na posição 12 do aminoácido, da glicina a outros resíduos, incluindo cisteína (G12C, 14%), ácido aspártico (G12D, 36%) e valina (G12V, 23%) (Figura 1).1
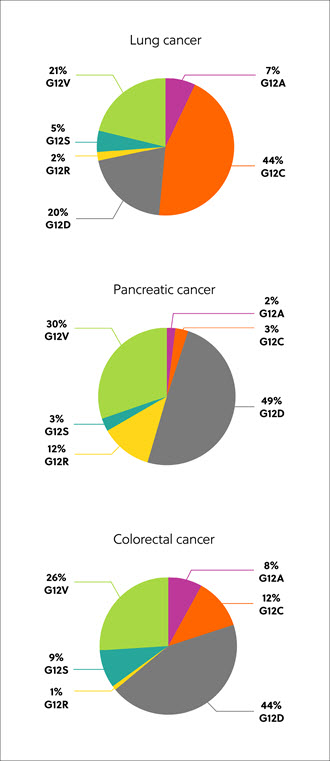
Descoberta das proteínas RAS como candidatas para o tratamento do câncer
Os inibidores do RAS podem ser identificados por meio de cristalografia de raios X. Com esse método, as estruturas da proteína RAS podem ser examinadas para identificar possíveis regiões de ligação para pequenas moléculas ocuparem o interior das células cancerígenas humanas. Esse tipo de abordagem (projeto de medicamentos baseado em estrutura) possibilita a descoberta de centenas de substâncias químicas que podem se ligar em regiões específicas. Os possíveis inibidores do RAS geralmente consistem em um esqueleto estrutural que é ligeiramente modificado com uma variedade de grupos funcionais para aumentar a atividade, a seletividade e diminuir a toxicidade. Isso resulta em compostos promissores, que podem ser analisados, melhorados e testados com a esperança de avaliá-los em ensaios clínicos de câncer humano.
Para se ter uma compreensão mais profunda do cenário atual de inibidores do RAS, revisamos as patentes e publicações relacionadas a inibidores do RAS na Coleção de Conteúdo do CAS™. A análise revelou 26.958 substâncias químicas com funções terapêuticas ou farmacológicas no espaço inibitório direto do RAS. O número de substâncias químicas e patentes nesse espaço aumenta a cada ano, reforçando como o interesse de pesquisa e os esforços para a descoberta de inibidores do RAS estão acelerando (Figura 2).

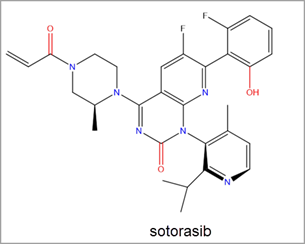
A aprovação recente do sotorasibe da Amgen pela FDA levou a um aumento significativo nos esforços de pesquisa para a descoberta do inibidor do RAS. O sotorasibe é um inibidor covalente do KRAS G12C por meio da região Switch-II. Foi o primeiro inibidor do KRAS a ser aprovado para uso no tratamento do câncer humano e para tratar o câncer de pulmão de células não pequenas (NSCLC) com mutação KRAS G12C (Figura 3).2
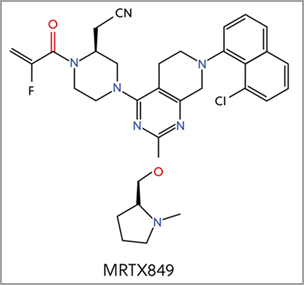
Quatro inibidores adicionais da KRAS-G12C estão atualmente em ensaios clínicos, incluindo o MRTX849, que é baseado em uma estrutura central semelhante ao sotorasibe (Figura 4)2. Diferentes grupos funcionais resultaram em diferentes mecanismos de ligação a elementos-chave da região Switch II. Em junho de 2021, o MRTX849 recebeu a designação de terapia inovadora (Breakthrough Therapy) da FDA para o tratamento do câncer de pulmão de células não pequenas (CPNPC) positivo para a KRAS G12C.
A jornada continua: expansão da amplitude dos alvos diretos dos inibidores do RAS
À medida que mais moléculas que se ligam ao RAS são descobertas, mais superfícies nas isoformas do RAS e proteínas RAS são identificadas como possíveis alvos de pequenas moléculas.
Como as isoformas mutantes do RAS, os códons e as substituições de aminoácidos variam conforme o tecido e o tipo de câncer, são necessárias abordagens variadas além dos atuais inibidores de G12C para ampliar o leque de terapias contra o câncer. As oportunidades futuras incluem a expansão do tipo de aminoácidos que podem ser alvo de inibidores, como o G12D e o G12V, o que pode ampliar os tipos de câncer que podemos tratar.
A porta de entrada agora está aberta para a inibição do RAS e, ao obter uma melhor compreensão da estrutura da oncoproteína RAS e da configuração da região de ligação para alvos de pequenas moléculas, poderão ser desenvolvidos e aprimorados novos inibidores do RAS para uma atividade ideal em cânceres com mutação do RAS.
Leia nosso white paper para saber mais sobre a jornada contínua na descoberta de alvos do RAS, incluindo uma visão geral mais detalhada do cenário atual de estruturas químicas de inibidores do RAS e oportunidades futuras.
Referências
1. H. Chen et al., Small-molecule inhibitors directly targeting KRAS as anticancer therapeutics. J. Med. Chem. 63 (2020) 11404–14424. doi: 10.1021/acs.jmedchem.0c01312.
2. L. Goebel et al., KRASG12C inhibitors in clinical trials: a short historical perspective. RSC. Med. Chem. 11 (2020) 760. doi: 10.1039/d0md00096e.







