Proteínas RAS: ¿objetivos esquivos?
Alrededor de uno de cada cinco cánceres humanos tiene al menos una forma de mutación de RAS (K-RAS, H-RAS y N-RAS), lo que convierte a las proteínas RAS en la familia de genes que muta con más frecuencia en el cáncer humano. Las proteínas RAS, localizadas en la membrana plasmática de las células, actúan como interruptores moleculares que envían señales para activar el crecimiento celular. Sin embargo, algunas mutaciones en las proteínas RAS pueden hacer que permanezcan activas constantemente y transmitan señales de crecimiento de forma incontrolada, lo que causa una proliferación celular anómala y el desarrollo de cáncer.
A pesar de su abundancia, hay una falta evidente de tratamientos centrados en estas proteínas RAS. La investigación de los inhibidores de RAS en el tratamiento del cáncer se remonta a hace más de tres décadas y, sin embargo, hasta hace bien poco, se consideraba que las proteínas RAS no eran objetivos viables debido a su esquivo potencial inhibidor. A principios de este año, la FDA aprobó el sotorasib (desarrollado por Amgen y comercializado con el nombre Lumakras™) para el tratamiento del cáncer de pulmón. Es el primer inhibidor de RAS aprobado para el uso terapéutico.
La aprobación del sotorasib constituye un gran avance en el campo de la inhibición de RAS y ha impulsado las iniciativas de investigación y desarrollo destinadas a descubrir otros inhibidores de RAS. En esta entrada del blog analizamos cómo se está estrechando el cerco en torno a las proteínas RAS: las que antes se consideraban objetivos esquivos con una nula afinidad para los fármacos se perfilan ahora como un prometedor tratamiento del cáncer.
K-RAS: la mutación más frecuente en los genes RAS
Los genes RAS codifican las proteínas, que existen en cuatro isoformas: K-RAS4A, K-RAS4B, N-RAS y H-RAS. Las isoformas RAS mutadas y la sustitución de codones y aminoácidos varían en función del tejido y el tipo de cáncer, pero las más comunes son las mutaciones en la isoforma K-RAS, presentes en aproximadamente el 22 % de los cánceres con mutaciones de RAS. El 80 % de las mutaciones de K-RAS se producen en la posición aminoacídica 12, donde la glicina se sustituye por otros residuos, como cisteína (G12C, 14 %), ácido aspártico (G12D, 36 %) y valina (G12V, 23 %) (figura 1)1.
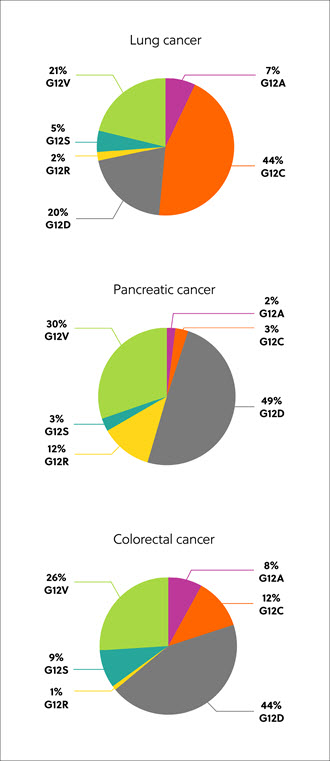
Descubrimiento de las proteínas RAS como posibles agentes para el tratamiento del cáncer
Los inhibidores de RAS se pueden identificar mediante cristalografía de rayos X. Con este método, es posible examinar la estructura de las proteínas RAS para identificar posibles bolsillos de unión que puedan ocupar moléculas pequeñas dentro de las células cancerosas humanas. Este enfoque —el diseño de fármacos basado en la estructura— sin duda hará posible el descubrimiento de cientos de sustancias químicas con capacidad de unión en bolsillos específicos. Por lo general, los posibles inhibidores de RAS se componen de una estructura de andamiaje ligeramente modificada con diversos grupos funcionales para aumentar la actividad y la especificidad y reducir la toxicidad. Así se obtienen compuestos básicos que pueden someterse a análisis, mejoras y pruebas adicionales con miras a evaluarlos en ensayos clínicos sobre el cáncer en humanos.
Para conocer con más detalle el panorama actual de los inhibidores de RAS, hemos revisado las patentes y publicaciones relacionadas con los inhibidores de RAS en la CAS Content Collection™. En este análisis se identificaron 26 958 sustancias químicas con funciones terapéuticas o farmacológicas en el ámbito de la inhibición de RAS directa. El número de sustancias químicas y patentes en este ámbito ha aumentado año tras año, lo que corrobora que el interés y los esfuerzos de investigación dirigidos al descubrimiento de inhibidores de RAS cada vez cobran más fuerza (figura 2).

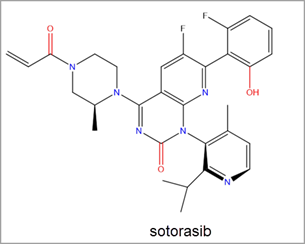
La reciente aprobación por parte de la FDA del fármaco de Amgen denominado sotorasib ha favorecido un notable repunte de las iniciativas de investigación para el descubrimiento de inhibidores de RAS. El sotorasib es un inhibidor de KRAS G12C que se une de forma covalente al bolsillo Switch-II. Fue el primer inhibidor de KRAS aprobado para su uso en el tratamiento del cáncer humano y para tratar el cáncer de pulmón no microcítico (CPNM) con mutación KRAS G12C (figura 3).2
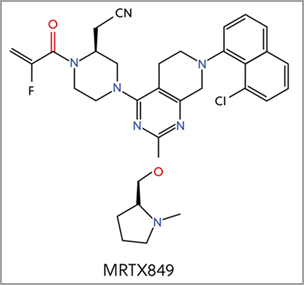
Cuatro inhibidores adicionales de KRAS G12C están actualmente en fase de ensayo clínico, incluido MRTX849, cuya estructura básica es similar a la del sotorasib (figura 4)2. El uso de diferentes grupos funcionales dio lugar a distintos mecanismos de unión a elementos fundamentales del bolsillo Switch-II. En junio de 2021, la FDA concedió a MRTX849 la designación de «terapia innovadora» para el CPNM con mutaciones KRAS G12C.
El proceso sigue: ampliación del alcance de los objetivos de inhibidores directos de RAS
A medida que se descubren más moléculas con capacidad de unión a RAS, también se identifican más superficies de las isoformas y proteínas RAS como posibles objetivos de moléculas pequeñas.
Puesto que las isoformas RAS mutadas, el codón y la sustitución de aminoácidos varían según el tejido y el tipo de cáncer, es preciso investigar los inhibidores actuales de KRAS G12C desde distintos puntos de vista para ampliar la diversidad de los tratamientos contra el cáncer. Una de las futuras oportunidades es la ampliación del tipo de aminoácidos a los que pueden dirigirse los inhibidores, como G12D y G12V, lo que podría aumentar los tipos de cáncer que podemos tratar.
Ya se ha abierto la puerta a la inhibición de RAS. El paso siguiente es conocer mejor la estructura de la oncoproteína RAS y la configuración del bolsillo de unión para los objetivos de moléculas pequeñas, con el fin de desarrollar y perfeccionar nuevos inhibidores de RAS, de modo que ofrezcan una actividad óptima en los cánceres con mutaciones RAS.
Lea el informe técnico para obtener más información sobre el proceso continuo de descubrimiento de dianas RAS, incluida una descripción más detallada del panorama actual de los inhibidores de RAS, sus estructuras químicas y las oportunidades futuras.
Referencias
1. H. Chen et al., Small-molecule inhibitors directly targeting KRAS as anticancer therapeutics. J. Med. Chem. 63 (2020) 11404–14424. doi: 10.1021/acs.jmedchem.0c01312.
2. L. Goebel et al., KRASG12C inhibitors in clinical trials: a short historical perspective. RSC. Med. Chem. 11 (2020) 760. doi: 10.1039/d0md00096e.







