RAS 蛋白:难以攻克的靶点?
大约五分之一的人类癌症具有至少一种 RAS 突变形式(K-RAS、H-RAS 和 N-RAS),这使 RAS 成为了人类癌症中最常发生突变的基因家族。RAS 蛋白位于细胞质膜上,充当分子开关,负责发送细胞生长信号。然而,RAS 蛋白的突变可能会使细胞持续处于活化状态并不受控地发送生长信号,从而导致细胞异常增殖,形成癌症。
尽管 RAS 蛋白数量众多,但针对这些蛋白的治疗方法却明显不足。关于将 RAS 抑制剂用于癌症治疗的研究已有 30 余年,但由于 RAS 蛋白的抑制潜力难以捉摸,其一直被认为“不可成药”——这直到最近才有所改变。今年早些时候,FDA 批准 sotorasib(由安进公司 (Amgen) 开发,商用名为 Lumakras™)可用于治疗肺癌,这是第一个被批准用于治疗的 RAS 抑制剂。
Sotorasib 的获批是 RAS 抑制领域发展的重要一步,目前人们已加强研发工作以发现更多的 RAS 抑制剂。本文将探索 RAS 蛋白的研发如何一步步取得突破,这一曾经被认为难以攻破、不可成药的靶点如今正在发展成为一种前景光明的癌症疗法。
K-RAS:RAS 基因中最常见的突变
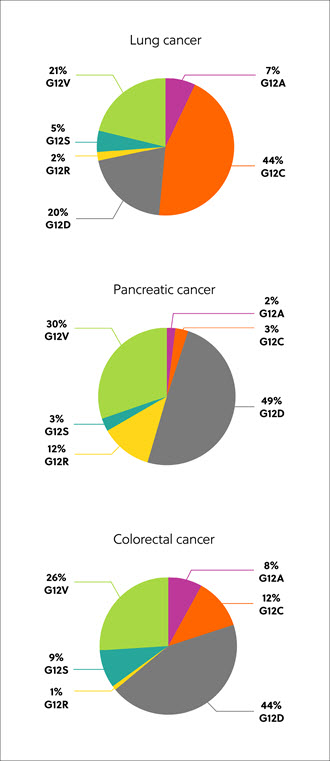
RAS 基因编码的蛋白质有四种异构体:K-RAS4A、K-RAS4B、N-RAS 和 H-RAS。突变的 RAS 异构体、密码子和氨基酸置换因组织和癌症类型而异,但最常见的是 K-RAS 异构体突变,约 22% 的 RAS 突变癌症中都存在这种突变。从甘氨酸到其他氨基酸(包括半胱氨酸 (G12C, 14%)、天门冬氨酸 (G12D, 36%) 和缬氨酸 (G12V, 23%)),80% 的 K-RAS 突变发生在第 12 位氨基酸(图 1)。1
发现 RAS 蛋白作为癌症治疗候选药物
RAS 抑制剂可利用 X 射线晶体学进行鉴定。借助这种方法,我们可以检查 RAS 蛋白结构,以确定小分子在人类癌细胞中占据的潜在结合口袋。使用此类基于结构的药物设计方法可发现数百种可能结合在特定口袋中的化学物质。潜在 RAS 抑制剂通常由支架结构组成,该支架结构经过多种官能团的轻微改性,以增强活性、选择性并降低毒性。由此产生的先导化合物可以进一步分析、增强和测试,并有望在人类癌症临床试验中进行评估。
为了更深入地了解 RAS 抑制剂的当前形势,我们在 CAS 内容合集™ 中查看了 RAS 抑制剂相关专利和出版物。据分析,有 26958 种化学物质在直接 RAS 抑制领域中具有治疗或药理作用。该领域的化学物质和专利数量每年都在增加,这表明人们对 RAS 抑制剂研发的兴趣和投入正在加速增长。(图 2)。

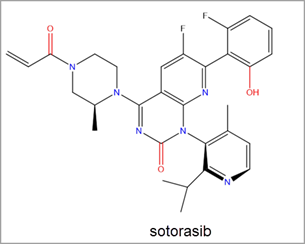
最近,安进公司 (Amgen) 的 sotorasib 获得 FDA 批准,促使 RAS 抑制剂发现的研究工作大幅增加。Sotorasib 是一种通过 Switch-II 口袋与 KRAS G12C 共价结合的抑制剂。它是首个获准用于人类癌症治疗的 KRAS 抑制剂,可用于治疗 KRAS G12C 突变的非小细胞肺癌 (NSCLC) (图 3)。2
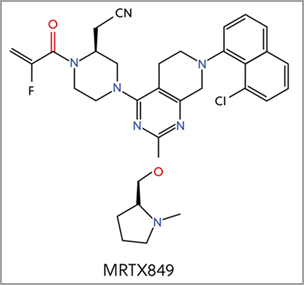
另外四种 KRAS-G12C 抑制剂目前仍处于临床试验阶段,包括 MRTX849,其核心结构与 sotorasib 相似(图 4)2。官能团不同,与 Switch II 口袋关键元件的结合机制也不同。FDA 已于 2021 年 6 月授予 MRTX849 突破性疗法认定,用于治疗 KRAS G12C 阳性 NSCLC。
研究之旅仍在继续:扩展直接 RAS 抑制剂靶点的广度
随着越来越多与 RAS 结合的分子被发现,越来越多的 RAS 异构体和 RAS 蛋白表面被确定为潜在的小分子靶点。
由于突变的 RAS 异构体、密码子和氨基酸置换因组织和癌症类型而异,因此我们需要采用与当前 G12C 抑制剂不同的方法以增加癌症疗法的范围。未来研究可专注于扩展可作为抑制剂靶点的氨基酸类型,例如 G12D 和 G12V,以扩大我们能够治疗的癌症类型范围。
现在,RAS 抑制通道的大门已经打开,通过进一步了解 RAS 癌蛋白结构和小分子靶点的结合口袋配置,我们可以开发和增强新型 RAS 抑制剂,以在治疗 RAS 突变癌症时实现最佳活性。
阅读我们的白皮书,进一步了解发现 RAS 靶点的持续研究旅程,包括对当前 RAS 抑制剂化学结构现状及未来机遇的更详细概述。
参考文献
1. H. Chen et al., Small-molecule inhibitors directly targeting KRAS as anticancer therapeutics.J. Med. Chem. 63 (2020) 11404–14424. doi: 10.1021/acs.jmedchem.0c01312.
2. L. Goebel et al., KRASG12C inhibitors in clinical trials: a short historical perspective. RSC. Med. Chem. 11 (2020) 760. doi: 10.1039/d0md00096e.