Gain new perspectives for faster progress directly to your inbox.
世界卫生组织 (WHO) 将经过适当疗程后仍未被杀死/灭活的微生物定义为具有“耐药性”,而耐药菌的增加是由多种因素造成的。 根据美国疾病控制和预防中心 (CDC) 的数据,每年发生的抗生素耐药菌感染超过 280 万例,导致 35,000 多人死亡。 令人担忧的是,世界银行预测,到 2050 年,死亡人数可能会增加到每年 1,000 万人。
因此,WHO 宣布抗生素耐药性是十大首要健康问题之一,亟需新的解决方案。
抗生素耐药性与多种因素有关
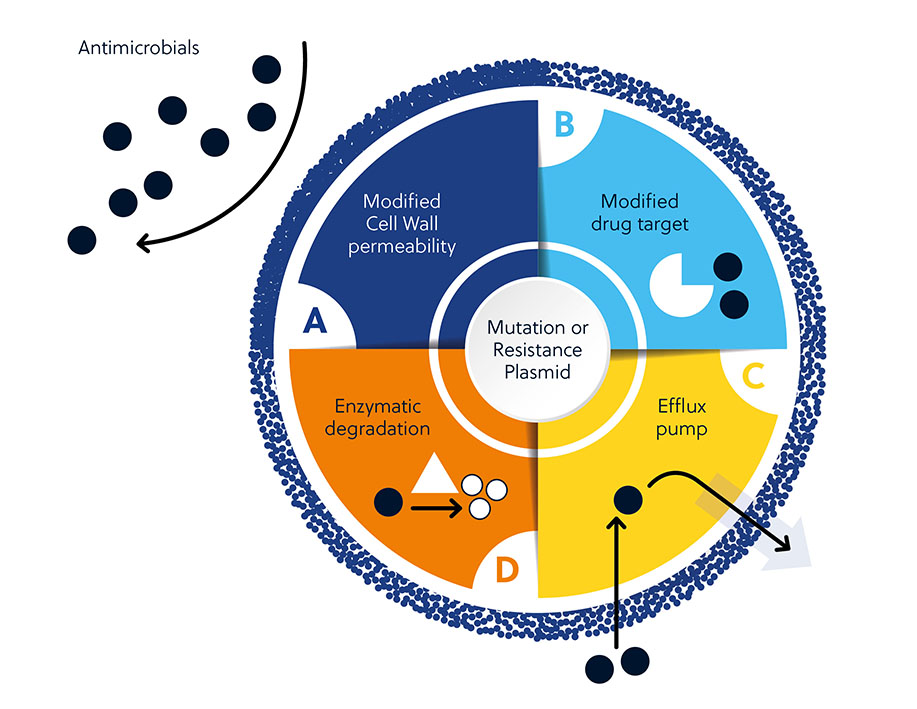
抗生素耐药性可由内在因素和后天因素造成。 内在因素包括细胞壁的渗透性、药物靶点的修饰、外排泵的激活以及抗生素的酶促降解。 后天获得的耐药性是由于细菌基因组中获得了新的遗传物质或发生了突变,通过介导得以存活。
对新型抗菌治疗的需求
抗生素有许多不同的类别。 每种抗生素都是根据其结构和对抗体内细菌的方式来进行分类的。
| 抗生素类别 | 结构 |
| 氨基糖苷类(如 streptomycin, 57-92-1) | |
| 内酰胺类(如 penicillin, 61-33-6) | 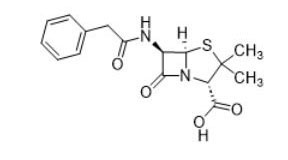 |
| 磺酰胺类(如 sulfadiazine, 68-35-9) | 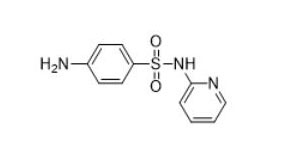 |
| 酰胺醇类(如 chloramphenicol, 56-75-7) | |
| 多黏菌素类(如 polymixin B, 1404-26-8) | |
| 四环素类(如 tetracycline, 60-54-8) | |
| 大环内酯类(如 clarithromycin, 81103-11-9) | |
| 嘧啶类(如 sulfadiazine 68-35-9) | 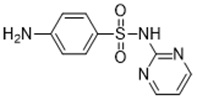 |
| 利福霉素类(如 rifampicin, 13292-46-1) | |
| 喹诺酮类和氟喹诺酮类(如 nalidixic acid, 389-08-2) | |
| 链阳菌素类(如 quinupristin, 120138-50-3) | |
| 林可酰胺类(如 lincomycin, 154-21-2) | |
| 截短侧耳素类(如 lefamulin, 1061337-51-6) | |
| 恶唑烷酮类(如 linezolid, 165800-03-3) |
表 1. 不同类别的抗生素。
尽管有上述成熟的治疗方案,但许多感染正在对现有的抗生素治疗产生耐药性。 随着相关死亡人数预计会逐渐增加,迫切需要重新思考如何应对细菌感染。
新型抗生素面临的挑战
虽然抗生素耐药性的增加与多个方面有关,但与抗生素耐药性的发展速度相比,新型治疗方案的开发速度较慢,由此使得情况更加复杂。
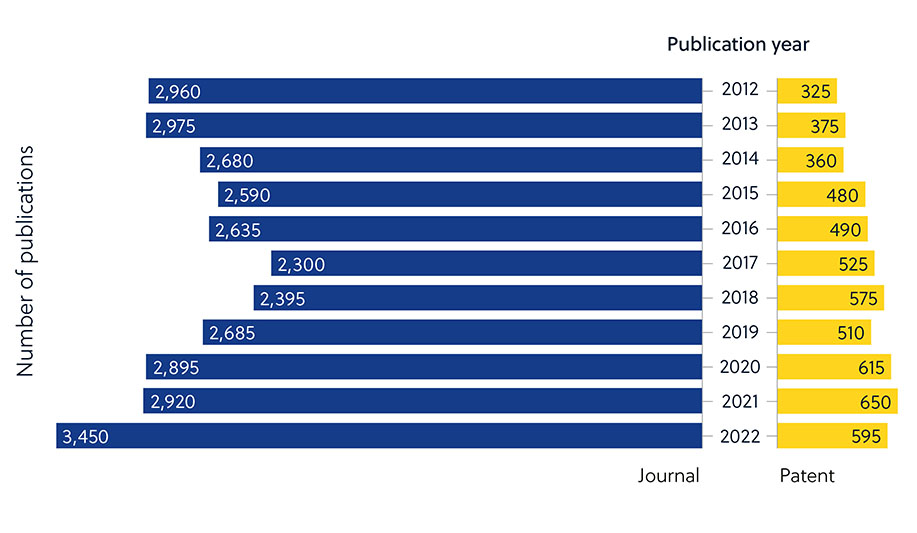
观察有关抗生素耐药性的期刊出版物数量与较低的专利比例,可以明显反映出这一情况(图 2)。 这表明,学术界的研究人员在开发新型抗生素方面发挥着更加重要的作用,而这些努力必须转化为可购买的商业化疗法。
导致抗生素研发面临挑战的因素有很多。 除了微生物可用于抵抗抗生素的许多先天或后天机制(图 1)外,还有一些更广泛的因素导致开发工作困难重重(图 3)。
细菌对抗生素的耐受能力,加上高昂的开发成本和漫长的时间周期(图 3),导致尽管市场迫切需要抗生素,但近几十年来进入市场的抗生素却寥寥无几。
生物膜
细菌在生物膜或细胞层中生长,使其可以抵抗抗生素的渗透。 生物膜可在导管、心脏起搏器、关节假体、假牙、隐形眼镜、人工心脏瓣膜和植入物上生长。 细菌在生物膜或细胞层中生长,使其可以抵抗抗生素的渗透。 生物膜可在导管、心脏起搏器、关节假体、假牙、隐形眼镜、人工心脏瓣膜和植入物上生长。
革兰氏阴性菌的外层
由于革兰氏阴性菌的双层外膜对许多药物具有不透性,因此它们对影响革兰氏阳性菌的各种药物具有天然的耐药性。
投资回报
候选药物分子的成功率较低,加上投资回报率较低,这些都是主要挑战。
时间周期
从最初的分子发现到可行的抗生素上市,可能需要 10 到 15 年时间。
图 3. 阻碍抗生素开发的因素。
传统抗生素的替代品
将新型抗生素推向市场是一项耗时的挑战(图 3),因此替代品有助于对抗抗生素耐药性。
| 严紧反应抑制 | 细菌在宿主体内长期存活(通常是无症状存活)会导致再活化和再感染。 这些长期存活的细菌被称为“持留菌”。严紧反应是细菌对抗极端饥饿的一种机制,被认为是造成持续性感染的原因。 抑制这一过程可提高细菌对抗生素的敏感性。 |
| 细菌疫苗 | 通过疫苗预防细菌感染可减少抗生素的消耗,并可能有助于解决抗生素耐药性问题。 WHO 2021 年的一份报告详细介绍了分别处于临床和临床前开发阶段的 60 多种和 90 多种疫苗。 |
| 抗菌肽 | 作为小分子抗生素的替代品,抗菌肽越来越受欢迎。 它们通常是短肽(小于 100 个氨基酸),具有广谱抗菌活性。 根据抗菌肽数据库 (Antimicrobial Peptide Database) 的数据,截至 2022 年 11 月,共有 3,000 多种抗菌肽。 |
| 糖肽 | 糖肽类药物通过抑制细胞壁的生物合成,主要对革兰氏阳性细菌具有抗菌活性。 这类药物中常用的有万古霉素、替考拉宁、特拉万星、达巴万星和奥利万星,但还有许多新的选择目前正在进行开发、研究和优化。 |
| 脂肽和脂糖肽 | 达托霉素是目前唯一用于抗革兰氏阳性菌的脂肽,通过破坏细菌细胞膜发挥作用。 所观察到的抗菌效果似乎取决于钙的存在和与钙的结合。 由于脂肽体积较大,口服时吸收较差,通常需要静脉给药。 |
| 噬菌体 | 噬菌体是一种能够感染细菌细胞并通过注入病毒 DNA 杀死细菌的病毒。 病毒在细胞内复制,然后释放出复制体来寻找新的细菌细胞进行感染,进而导致细胞裂解。 然而,要使噬菌体治疗更加可行,仍需应对各种挑战,包括口服给药后针对肠道细菌种类的体内疗效不佳等。 |
表 2. 传统抗生素的替代品
抗生素的未来
通过材料增强的药物递送方式可以提供局部、长时间且依赖刺激的抗菌活性。 除了传统的药物递送方式外,还有几种实现抗生素递送的方法。 植入物和导管等医疗器械可能是感染源,而使用抗菌材料则有可能防止感染。 同样,在人流量大的表面涂上抗菌涂层也能减少微生物的传播,最大限度地降低清洁需求。
水凝胶
与抗生素配合使用,用于药物递送和伤口愈合。 在暴露于体细胞和体液的情况下,水凝胶可在原位发挥作用,使抗菌肽等可扩散或凝胶结合型抗生素制剂得以施用。
纳米颗粒
纳米颗粒体积小,易于有效递送药物。 表面改性可用于针对特定目标和位置对其进行定制,表面化学和成分可以控制活性时间、药物释放和作用持续时间。
复合材料
复合材料结合了多种材料,用于牙科植入物等医疗器械。 各种能够发挥抗菌活性的材料在治疗和预防感染及传播方面的功效已得到证实。
薄膜或涂层
降低医疗器械传播感染的能力是改善医院患者健康和生存状况的有效方法。 利用紫外线或可见光的能力以及产生活性氧化物以防止微生物附着的能力,是有效薄膜和涂层的两个例子。
支架和植入物
这类材料通常具有较高的表面积与体积比,比水凝胶更具持久性,可用于伤口和骨骼愈合。 含有阳离子聚合物、纳米铜颗粒或一氧化氮释放剂的植入物已显示出良好的疗效。
图 4. 可减少抗生素用量的材料和解决方案
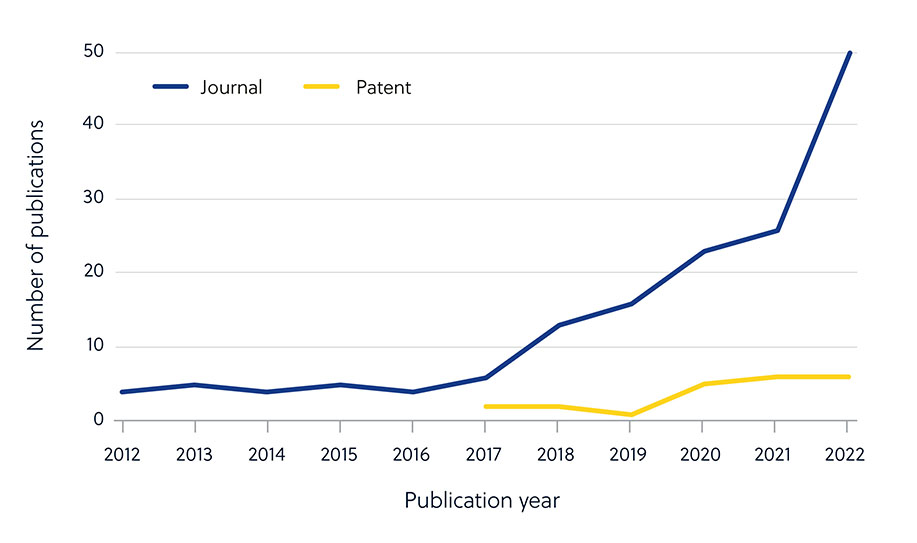
人工智能 (AI) 的进步加速了利用算法识别潜在新分子的抗生素药物开发工作。 虽然期刊出版物数量稳步增长,但专利申请量并未相应激增,这表明大多数抗生素人工智能研究仍处于学术阶段(图 5)。
多重性耐药菌的增加对人类健康构成了令人担忧的威胁,因此开发新型抗生素和抗菌材料迫在眉睫。 尽管人工智能的广泛应用仍处于起步阶段,但其有望简化和缩短未来工作的时间周期。 在我们的洞察报告中,您将进一步了解有关人工智能对化学的影响、大型语言模型的兴起以及如何通过各种新方法将生物材料用于治疗领域。