Gain new perspectives for faster progress directly to your inbox.
La Organización Mundial de la Salud (OMS) define un microorganismo que no muere o se inactiva tras completar un tratamiento como “resistente”, y la proliferación de organismos resistentes se debe a varios factores. Según los Centros para el Control y la Prevención de Enfermedades (CDC) de Estados Unidos, cada año se producen más de 2,8 millones de infecciones bacterianas resistentes a los antibióticos que provocan más de 35 000 muertes. Las preocupantes proyecciones realizadas por el Banco Mundial estiman que este número podría aumentar hasta una tasa de 10 millones de fallecimientos anuales de aquí a 2050.
Por este motivo, la OMS ha declarado la resistencia a los antimicrobianos como uno de los diez problemas de salud más importantes, y se necesitan con urgencia nuevas soluciones para hacerle frente.
La resistencia a los antibióticos es multifactorial
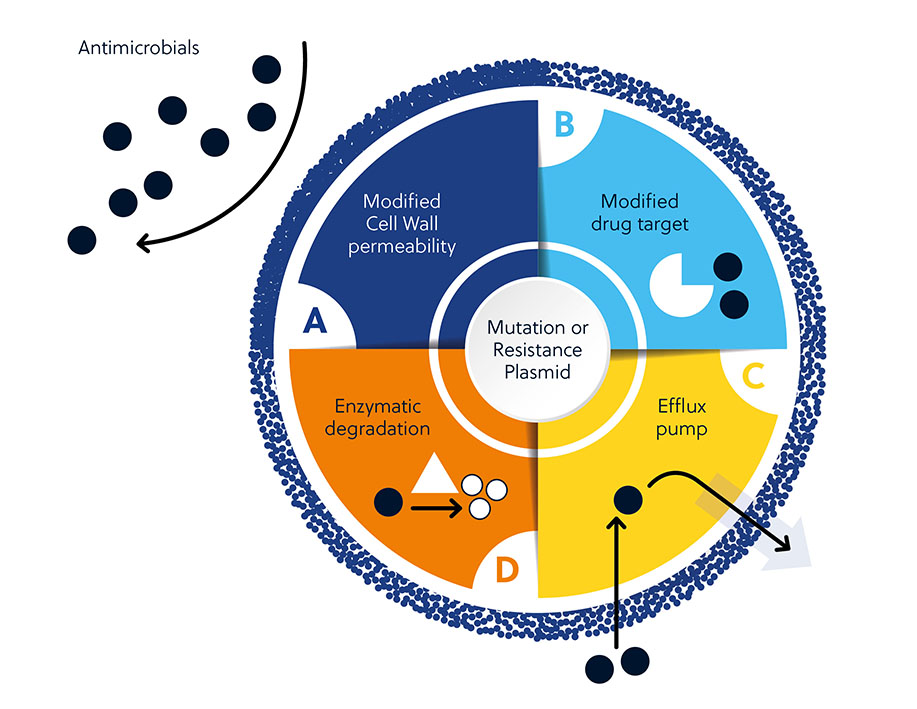
La resistencia a los antibióticos puede ser el resultado de factores tanto intrínsecos como adquiridos. Entre los factores intrínsecos se incluyen la permeabilidad de la pared celular, las dianas farmacológicas modificadas, la activación de bombas de eflujo y la degradación enzimática de los antibióticos. La resistencia adquirida se debe a la aparición en el genoma bacteriano de nuevo material genético o de mutaciones que influyen en la supervivencia.
La necesidad de nuevos tratamientos antibacterianos
Hay muchas clases diferentes de antibióticos. Cada uno de ellos se caracteriza por su estructura y por su manera de actuar sobre las bacterias en el organismo.
| Clase de antibiótico | Estructura |
| Aminoglucósidos (p. ej., estreptomicina, 57-92-1) | |
| Beta-lactamas (p. ej., penicilina, 61-33-6) | 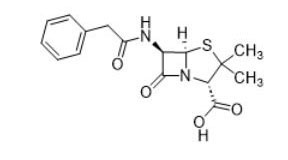 |
| Sulfonamidas (p. ej., sulfadiazina, 68-35-9) | 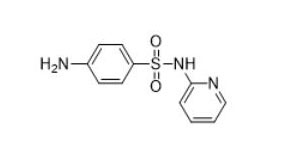 |
| Anfenicoles (p. ej., cloranfenicol, 56-75-7) | |
| Polimixinas (p. ej., polimixina B, 1404-26-8) | |
| Tetraciclinas (p. ej., tetraciclina, 60-54-8) | |
| Macrólidos (p. ej., claritromicina, 81103-11-9) | |
| Pirimidinas (p. ej., sulfadiazina 68-35-9) | 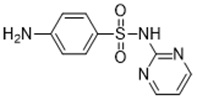 |
| Rifamicinas (p. ej., rifampicina, 13292-46-1) | |
| Quinolonas y fluoroquinolonas (p. ej., ácido nalidíxico, 389-08-2 | |
| Estreptograminas (p. ej., quinupristina, 120138-50-3) | |
| Lincosamidas (p. ej., lincomicina, 154-21-2) | |
| Pleuromutilinas (p. ej., lefamulina, 1061337-51-6) | |
| Oxazolidinonas (p. ej., linezolida, 165800-03-3) |
Tabla 1. Distintas clases de antibióticos.
Pese a contar con estas opciones de tratamiento ya establecidas, muchas infecciones se están volviendo resistentes a los tratamientos con los antibióticos disponibles. Este hecho, sumado al aumento estimado de los fallecimientos relacionados, hace que sea urgente rediseñar nuestra forma de hacer frente a las infecciones bacterianas.
Desafíos a los que se enfrentan los nuevos antimicrobianos
Aunque son varios los factores que influyen en el aumento de la resistencia a los antimicrobianos, el problema se ve agravado por el hecho de que el desarrollo de nuevas opciones de tratamiento avanza a un ritmo más lento que el desarrollo de la resistencia a esos agentes.
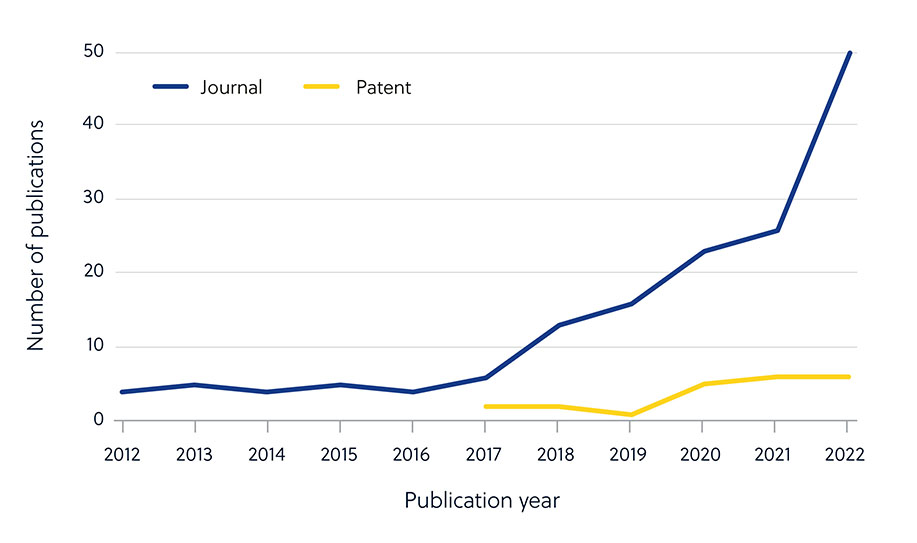
Es algo que resulta evidente cuando se analiza el número de publicaciones de revistas relativas a la resistencia a los antimicrobianos comparándolo con la baja proporción de patentes (figura 2). Esto indica que los investigadores del mundo académico están desempeñando un papel más destacado en el desarrollo de nuevos antimicrobianos y que esas iniciativas se deben convertir en tratamientos disponibles comercialmente.
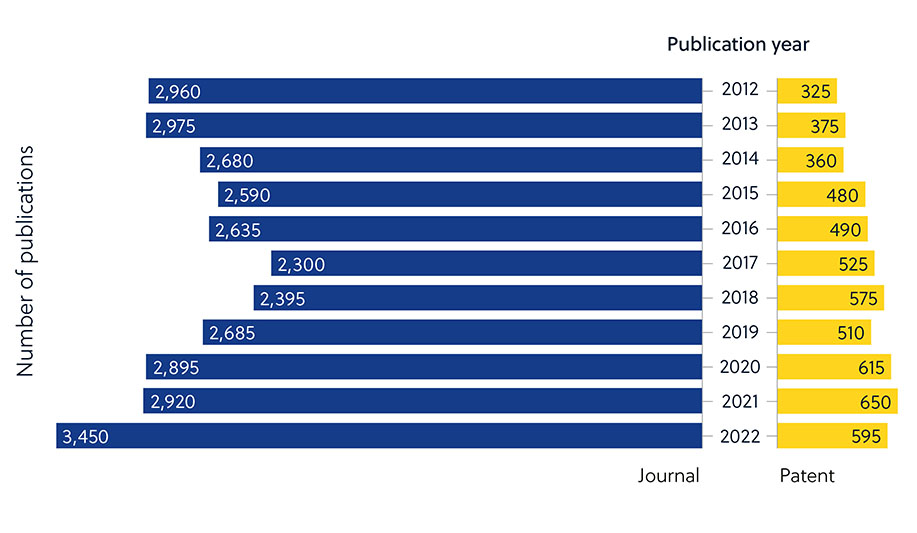
Hay varios factores que dificultan el desarrollo de antimicrobianos y que explican este resultado. Aparte de los mecanismos innatos o adquiridos que los microbios pueden usar para ofrecer resistencia a los antimicrobianos (figura 1), hay otros factores generales que dificultan el desarrollo (figura 3).
La capacidad de las bacterias para tolerar antimicrobianos, combinada con el elevado coste y los amplios plazos del desarrollo (figura 3), ha llevado a que pocos antibióticos lleguen al mercado en las últimas décadas a pesar de ser extremadamente necesarios.
Biopelículas
Desarrollar una biopelícula o capa de células permite a las bacterias resistir la penetración del antibiótico. Las biopelículas pueden crecer en catéteres, marcapasos, prótesis articulares, dentaduras postizas, lentes de contacto, prótesis valvulares e implantes. Desarrollar una biopelícula o capa de células permite a las bacterias resistir la penetración del antibiótico. Las biopelículas pueden crecer en catéteres, marcapasos, prótesis articulares, dentaduras postizas, lentes de contacto, prótesis valvulares e implantes.
Capa exterior de una bacteria gramnegativa
De manera natural, a causa de su membrana exterior de doble capa, que es impenetrable para muchos fármacos, las bacterias gramnegativas son resistentes a diversos medicamentos que sí afectan a las especies grampositivas.
Retorno de la inversión
La baja tasa de éxito de las moléculas con potencial farmacológico, combinada con un retorno inferior de la inversión, es un obstáculo importante.
Plazos de desarrollo
Pueden pasar entre 10 y 15 años entre el descubrimiento de la molécula inicial y la llegada al mercado de un antibiótico viable.
Figura 3. Factores que dificultan el desarrollo de antimicrobianos.
Alternativas a los antibióticos convencionales
Llevar nuevos antibióticos al mercado es complicado y requiere mucho tiempo (figura 3), por lo que se está recurriendo a algunas alternativas que ayudan a combatir la resistencia a los antimicrobianos.
| Inhibición de la respuesta estricta | La supervivencia a largo plazo de las bacterias en el anfitrión, a menudo asintomática, puede llevar a su reactivación y a una reinfección. Estas bacterias que sobreviven a largo plazo se denominan “bacterias persistentes”. Se cree que la respuesta estricta —un mecanismo mediante el cual las bacterias soportan la inanición extrema— contribuye al desarrollo de las infecciones persistentes. Inhibir este proceso podría traducirse en una mayor susceptibilidad de las bacterias a los antibióticos. |
| Vacunas bacterianas | Prevenir las infecciones bacterianas con vacunas reduce el consumo de antibióticos y puede ayudar a combatir la resistencia a estos medicamentos. Un informe de la OMS de 2021 proporcionó detalles de más de 60 vacunas en fase de desarrollo clínico y más de 90 en fase de desarrollo preclínico. |
| Péptidos antimicrobianos | Los péptidos antimicrobianos están ganando popularidad como alternativas a los antibióticos de moléculas pequeñas. Suelen ser péptidos cortos (de menos de 100 aminoácidos) con un amplio espectro de actividad antimicrobiana. Según la Antimicrobial Peptide Database, a fecha de noviembre de 2022 había más de 3000 péptidos antimicrobianos. |
| Glucopéptidos | Los glucopéptidos presentan actividad antibacteriana principalmente contra las bacterias grampositivas mediante la inhibición de la biosíntesis de la pared celular. Entre los medicamentos más usados de este grupo se encuentran la vancomicina, la teicoplanina, la telavancina, la dalbavancina y la oritavancina, pero se están desarrollando, estudiando y optimizando muchas opciones nuevas. |
| Lipopéptidos y lipoglucopéptidos | La daptomicina es el único lipopéptido que se emplea actualmente contra las bacterias grampositivas y funciona modificando la membrana celular bacteriana. El efecto antibacteriano observado parece depender de la presencia de calcio y la unión con él. Debido a su gran tamaño, se absorben con dificultad cuando se toman por vía oral, por lo que se suelen administrar por vía intravenosa. |
| Bacteriófagos | Los bacteriófagos son virus con la capacidad de infectar a la célula de la bacteria y provocar su muerte inyectando en ella ADN vírico. El virus se replica dentro de la célula y causa la lisis celular, momento en el que las réplicas se liberan para buscar una nueva célula bacteriana que puedan infectar. Sin embargo, todavía se deben resolver algunos problemas para mejorar la viabilidad de los tratamientos con bacteriófagos, incluida la baja eficacia in vivo para actuar sobre las especies bacterianas presentes en el intestino tras la administración oral. |
Tabla 2. Alternativas a los antibióticos convencionales
El futuro de los antimicrobianos
Los métodos mejorados de administración de fármacos por medio de materiales pueden proporcionar actividad antibacteriana localizada, prolongada y dependiente de estímulos. Hay varias formas de administrar agentes antimicrobianos que van más allá de la administración tradicional. Algunos dispositivos médicos, como los implantes y los catéteres, pueden ser fuente de infecciones que se podrían prevenir mediante el uso de materiales antimicrobianos. Del mismo modo, los revestimientos antomicrobianos en superficies con un tráfico elevado pueden reducir la transmisión de microbios y minimizar la necesidad de limpieza.
Hidrogeles
Se emplean junto con los antibióticos para la administración de medicamentos y la cicatrización de heridas. Mientras se exponen a las células y los fluidos corporales, los hidrogeles permiten la administración de agentes antibióticos difusibles o unidos al gel, como los péptidos antimicrobianos.
Nanopartículas
El pequeño tamaño de las nanopartículas les permite administrar medicamentos con eficacia. Se puede modificar su superficie para adaptarlas a determinadas dianas y ubicaciones. La química y la composición de la superficie controlan los tiempos de actividad, la liberación del fármaco y la duración de la actuación.
Compuestos
Los compuestos usan diversos materiales combinados y se emplean en dispositivos médicos como los implantes dentales. Diversos materiales con actividad antimicrobiana han demostrado su eficacia para tratar y prevenir la infección y la transmisión.
Películas o revestimientos
Reducir la capacidad de los dispositivos médicos de transmitir infecciones sería una forma eficaz de mejorar la salud y la supervivencia de los pacientes de los hospitales. La capacidad de usar la luz UV o visible y de generar especies reactivas de oxígeno que impiden que los microorganismos se adhieran son dos ejemplos de películas y revestimientos eficaces.
Andamios e implantes
Estos elementos, útiles para la cicatrización de heridas y la reparación de fracturas óseas, suelen tener una relación elevada entre área superficial y volumen y son más persistentes que los hidrogeles. Los implantes con polímeros catiónicos, nanopartículas de cobre o agentes que liberan óxido nítrico han demostrado una eficacia prometedora.
Figura 4. Materiales y soluciones que pueden reducir el uso de antibióticos
Los avances en el campo de la inteligencia artificial (IA) han llevado a una aceleración del desarrollo de medicamentos antimicrobianos mediante el uso de algoritmos para identificar nuevas moléculas con potencial farmacológico. Aunque el número de publicaciones de revistas crece a un ritmo estable, no se ha registrado un aumento proporcional de las solicitudes de patentes, lo que sugiere que la mayor parte de la investigación de IA sobre los agentes antimicrobianos todavía está en la fase académica (figura 5).
La proliferación de bacterias resistentes a diversos medicamentos es una amenaza alarmante para la salud humana, por lo que urge desarrollar nuevos antibióticos y materiales antibacterianos. El uso generalizado de la IA está dando aún sus primeros pasos, pero tiene el potencial de simplificar las iniciativas futuras y reducir sus plazos. En nuestro informe de CAS Insights puede obtener más información sobre el impacto de la IA en la química, sobre el auge de los modelos grandes de lenguaje y sobre el uso de los biomateriales en todo el panorama terapéutico en una amplia gama de estrategias novedosas.