近年来,共价抑制剂类药物越来越受欢迎。FDA批准了一系列针对多种适应症(主要针对癌症治疗)的共价药物。 与更常见的非共价抑制剂相比,共价抑制剂因其独特的作用机制而具备若干优势,使其成为极具前景的治疗药物。
过去,由于安全问题以及设计和生产方面的困难,研究人员一直对共价抑制剂望而却步。 但如今,这种情况发生了改变。
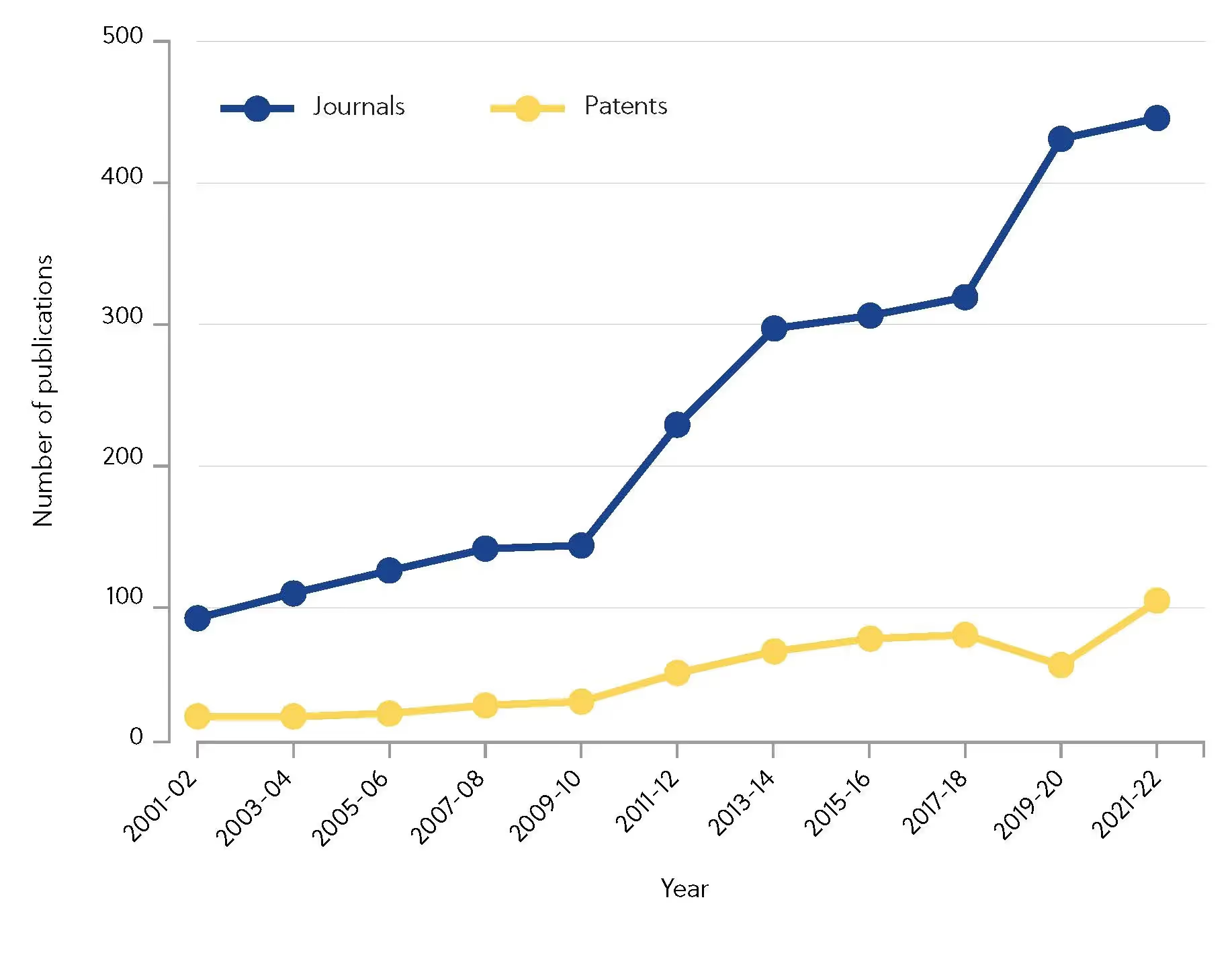
自2000年以来,CAS分析出2000年以来超过10,000篇讨论共价抑制剂的研究论文。 值得注意的是,由于研究力度的不断加强,期刊论文发表数量自2010年以来增加了2倍(图 1)。
这些领域的投资正在得到回报,畅销共价药物伊布替尼 (ibrutinib) 和奥希替尼 (osimertinib) 在 2020 年创造了共计 43.3 亿美元的销售额。 那么共价抑制剂到底是什么?为什么它开始超越非共价抑制剂而受到制药公司和学术研究机构的青睐?
顾名思义,共价抑制剂与其靶蛋白形成共价键,通常对这些靶蛋白进行不可逆的修饰。 与可逆结合的非共价抑制剂不同,共价抑制剂与其靶点建立持久的连接,从而增强了药效,并延长了药效持续的时间。 这可能有利有弊。
共价抑制剂的结构通常由两部分组成:反应活性基团或“弹头”(“warhead”),其与靶蛋白形成共价键;以及“引导系统”,其决定抑制剂对靶点的选择性(图2) 。 可以将它比作热追踪导弹(heat-seeking missile):制导系统定位目标,而弹头“撞击”形成共价键。

共价抑制剂并不是一项新的创新。 事实上,它们于一个多世纪前就已用于疾病治疗,青霉素就是最早的例子之一。 青霉素类抗生素与其靶酶共价结合,从而抑制细菌细胞壁的合成并引起细胞膜破裂。 另一个众所周知的例子是阿司匹林,它使一种合成炎症介质的关键酶发生不可逆乙酰化。 有趣的是,这些药物是在其广泛使用之后,才被发现是通过共价机制发挥的。 事实上,许多主要的共价抑制剂药物都是被偶然发现而非通过合理的药物设计发现的。
共价抑制剂的优势
共价抑制剂具有巨大的潜在优势。 非共价抑制剂可以自由地与酶结合和解离,而共价抑制剂则与其靶点形成牢固、持久的键。 这意味着它们可以在较长时间内有效阻断靶蛋白的活性,从而实现更持久的疗效。 这意味着其可以有效地长时间关闭靶蛋白的活性,从而有可能降低副作用风险、提高依从性并降低治疗成本。
此外,共价抑制剂还能表现出显著的选择性,精准作用于其目标靶点。 这一特性使它们能够靶向通过非共价抑制剂难以靶向的,具有挑战性的蛋白,例如那些没有传统结合口袋的蛋白。 事实上,过去被视为“不可成药”的靶点,例如 KRAS(最常发生突变的致癌基因),现在已经可以使用共价抑制剂成功靶向。 首款 KRAS 抑制剂索托拉西布 (sotorasib) 获批是治疗难治性癌症的一大重要里程碑。
共价抑制剂的缺点
导致共价抑制剂颇具前景的多个特性也给这类药物的研发带来了挑战。 结合的不可逆性要求任何结合都需要具有选择性。 然而,如果弹头没有足够的选择性,药物可能会与非预期蛋白结合,形成脱靶效应,由此导致长期危害。 此外,一些靶蛋白可能会突变或发生结构变化,从而阻止共价抑制剂与其有效结合并对其产生抑制。 这会导致产生抗药性,并降低药物的长期疗效。
鉴于这些挑战,在设计共价抑制剂时,需要仔细考虑各种因素,包括弹头的反应性、结合位点的特异性以及形成的共价键的稳定性。 反应基团必须遵循“金发姑娘原则 (Goldilocks principle)”——它们必须具有足够的反应性,以便在生成复合物的过程中与靶点形成键。 在这些因素之间达到适当的平衡可能既复杂又耗时。
共价抑制剂疗法的兴起
技术进步对加速共价抑制剂的发展起到了至关重要的作用。 该领域的一个关键转折点是,研究人员从共价抑制剂发展之初就开始关注共价性,而不是偶然发现其机制。
研究人员利用两种重要方法来创建有效的共价抑制剂疗法:配体优先和亲电体优先。 配体优先方法包括设计能与靶蛋白中的特定氨基酸残基发生反应的小分子。 相比之下,亲电体优先方法则侧重于药物的弹头部分,识别可与靶蛋白中的亲核残基形成共价键的反应性亲电基团。
迄今为止,全球已有 30 多种共价抑制剂作为治疗药物获得了监管部门的批准(图 3),其中最引人注目的是上文提到的伊布替尼,该药物于 2021 年跻身全球药物销售额前十。 伊布替尼是通过配体优先法发现的几种知名激酶抑制剂之一,其他抑制剂还包括阿法替尼 (afatinib)、达克替尼 (dacomitinib) 和来那替尼 (neratinib)。
此外,共价抑制剂的另一项颇具前景的应用是其抑制病毒蛋白酶的能力。 可逆性共价 SARS-CoV-2 MPRO 抑制剂奈玛特韦(与利托那韦联合用药)已被 FDA 批准用于治疗 COVID-19,为易感染患者提供急需的口服治疗方案。 奈玛特韦采用的是亲电优先法,通过对既往研究过的一种共价抑制剂进行结构引导改良而开发而来。

共价抑制剂的未来发展趋势
共价抑制剂的临床开发管线充满潜力。 目前有几种共价抑制剂正在进行临床试验(图 4),包括 BTK 抑制剂 remibrutinib、第三代 EGFR-TKI 纳扎替尼 (nazartinib) 和选择性 FGFR4 抑制剂 roblitinib。 尽管癌症疗法仍占主导地位,但管线却比较多样化,针对不同的治疗领域的多种靶向蛋白,从自身免疫性疾病(如类风湿关节炎和斑秃)到其他失调症(如肥胖症和骨关节炎)。 这种多样性证明了共价抑制的巨大潜力,而新兴的工具和技术,包括先进的筛选平台和化学蛋白质组学发现,则使之得以实现。 这些技术使研究人员能够对大量的化合物库进行筛选,并直接可视化蛋白质组内的共价相互作用。 这些创新使我们有理由相信未来有望研发出更精确、更有效的共价抑制剂。

共价抑制剂的兴起标志着药物开发的一个转折点。 有了科技进步的加持,共价抑制剂与靶蛋白持久结合的能力将为治疗的新时代奠定基础。 该领域研究的持续蓬勃发展将赋予共价抑制剂无穷潜力,彻底改变各种疾病的治疗方式,并改善患者生活质量。 如需了解有关共价抑制剂的更多信息并聆听专家认为值得关注的主要趋势,请观看我们的网络研讨会或在 ChemRXiV 阅读更多我们的最新出版物。如需了解其他癌症相关主题,请浏览我们对 RAS 抑制剂的深度布局分析,或了解更多有关靶向蛋白降解和分子胶的信息。