合成化学的边界正在被推向极限,促使研究人员从生物学中寻找解决方案。随着合成生物学和人工智能 (AI) 的兴起,科学家正在为药物发现开辟新的可能性,例如设计和生产稀有和新自然分子。通过利用这些工具,研究人员正在开发新的方法来合成复杂分子,优化生产途径和设计生物系统,以实现药物创新。为了深入了解这个快速发展的领域,我们采访了合成生物学和微生物学专家 Graham Hudson 博士,以及人工智能驱动蛋白质设计专家 Nathan Lanclos。详细了解 CAS 如何应对这些挑战。
CAS:对于药物开发创新,合成生物学是合成化学之外的下一个必经之路吗?
从理论上讲,只要结构在化学上是合理的,合成化学就可以利用它。但问题不仅仅在于可行性,还在于效率、成本和可扩展性。从理论上讲,有些化合物是可以合成的,但开发路线所需的工作和控制选择性的难度使其变得不切实际。因此合成生物学真正可以为药物合成提供新的途径。
大自然花了数百万年的时间改进酶学机制,使其能够非常精确地构建这些复杂的分子,通常能够实现化学合成难以达到的区域和立体选择性。以紫杉醇为例,这是一种含有大量立体中心和功能相似基团的分子,要对其进行精确的化学处理,以确保形成正确的产物,难度极大。但是,通过利用自然界的生物合成工具,我们可以利用酶来有效地组装这些分子。
此外,随着计算生物学和机器学习的兴起,我们还可以进一步实现这一目标。人工智能工具让我们能够设计出超越进化所产生的酶,改变酶的结构以催化新的反应或扩大其底物范围。这意味着我们不仅仅是在重新创造天然产物,同时还为可能具有全新生物性质的新自然分子打开大门。
CAS:最近有哪些突破可以帮助科学家将微生物改造成“活体药物工厂”?
酿酒酵母(酵母)和链霉菌(细菌)等微生物已被广泛用于生产从抗生素到抗癌剂等有价值的化合物。关键的挑战在于如何优化这些系统,以高效地提高产量。人工智能、高通量筛选和计算建模方面的进步让我们能够以前所未有的规模设计和优化生物合成途径。
现在,我们可以利用机器学习来预测新陈代谢途径的行为方式,从而对酶表达水平进行微调,优化前体的可用性,甚至改变宿主的新陈代谢,使产出最大化。例如,长期以来,设计大型异源蛋白质复合物的实验以深入了解蛋白质与蛋白质之间的长程相互作用一直是个棘手的问题,但现在我们正在寻找通过增加粒度来实现这一目标的方法。
QS-21(Stimulon,下同)是合成生物学改变药物生产的一个完美例子,它是一种用于疫苗的免疫增强佐剂。从历史上看,QS-21 是从皂皮树 (Quillaja saponaria) 中提取的,但该过程存在几个重大挑战。这些树木的产量极低,因此大规模生产在环境上不具有可持续性,在经济上也不切实际。此外,依赖植物提取意味着供应链容易受到气候变化、森林砍伐和地缘政治因素的影响。
在尝试改造酵母以生产 QS-21 之前,我们首先必须绘制出其完整的生物合成途径,并识别负责其合成的基因。这一过程是一项艰巨的任务,由约翰·英纳斯中心 (John Innes Centre) 的 Anne Osbourn 实验室领导,涉及植物生长周期不同阶段的细致转录组分析。
与微生物生物合成基因簇(通常位于基因组上)不同,植物途径分散在多个染色体上,基因之间通常存在非编码序列。这种分散性使得途径的发现变得更加复杂,需要进行细致的转录组相关研究,以确定哪些基因在功能上参与了 QS-21 的生物合成。
CAS:将植物来源的生物合成途径应用于微生物生产时,最困难的方面是什么?
最大的挑战之一是糖的生物合成。QS-21 属于皂甙类天然产物,是一种复杂的糖基化三萜类化合物。它的核心结构上附有七种不同的糖,但酵母只自然产生其中一种。这意味着,除了插入 QS-21 的生物合成途径外,我们还必须改造酵母,使其能够合成非天然糖。
另一个主要问题是毒性。像 QS-21 这样的皂苷是膜活性化合物,可以破坏脂质双分子层并封存关键的原生固醇,这也是它们成为有效佐剂的部分原因。然而,这在酵母中造成了一个相当大的问题——QS-21 分子破坏了酵母细胞膜的完整性,导致细胞死亡和生产失败。为了解决这个问题,我们必须修改酵母甾醇组成以防止膜破坏并优化生产条件。
这项工作充分展示了合成生物学的力量。如果没有这些进步,QS-21 的生产仍将被植物提取的瓶颈所限制。利用改造后的生物生产菌株,我们现在拥有一种可扩展、可控且可持续的方式来生产 QS-21。尽管在大规模生产之前还需要进行更多优化,但这项工作为更高效的疫苗配方铺平了道路。
CAS:您在其他哪些领域利用 AI 来加速发现?
人工智能使我们能够以仅靠传统方法无法实现的方式设计和优化生物合成途径。我们可以使用预测模型来确定哪些酶修饰会提高活性,哪些宿主菌株最具兼容性,以及不同的途径成分将如何相互作用,而不是反复试验和试错。
例如,在 Keasling 实验室,我们使用人工智能来设计聚酮合酶 (PKS),它可以产生从抗生素到抗癌药物等多种生物活性化合物。PKS 酶体积庞大,单个模块包含数千个氨基酸。它们的体积和复杂性使传统的蛋白质工程法变得异常困难。而人工智能让我们能够为这些庞大的蛋白质建模,预测修饰如何影响功能,并设计出具有更高活性的新型酶变体。
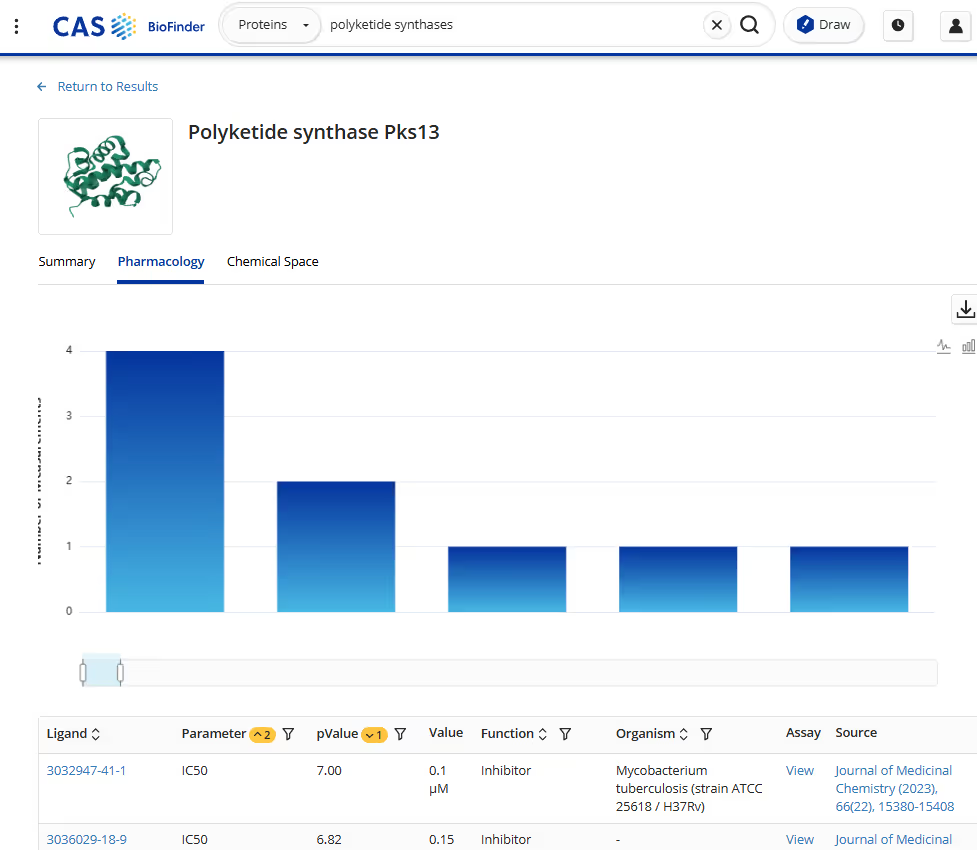
人工智能正在改变我们的方法的另一个领域是酶的多样性和特异性。酶对其底物具有天然的选择性,但我们常常需要它们在非天然底物上发挥作用,以产生新的衍生物。人工智能模型可以帮助我们预测哪些突变可以在不牺牲效率的情况下扩大酶的活性。
CAS:您在工作中遇到的最大数据相关瓶颈是什么?
最大的挑战是数据质量和标准化。人工智能模型的好坏取决于我们为其提供的数据,而从历史上看,生物学研究尚未针对大规模机器学习进行构建。实验数据通常以不同的格式存储,缺乏元数据,或没有完善的注释,因此难以进行大规模整合和分析。
目前我花费了太多时间在整理和清理数据上。为生物、化学信息学和人工智能生成的数据构建统一的结构,将大大加快发现的速度。
另一个问题是仪器和数据提取。我们的许多分析技术(无论是 LC-MS、HPLC 还是 GC-MS)仍然需要手动进行数据处理。仪器制造商通常使用专有格式,这让我们难以自动提取和分析结果。如果我们拥有标准化和机器可读的数据格式,我们就可以将相当一部分工作流程自动化,让人工智能模型直接从实验结果中学习。
CAS:来自不同背景的研究人员开展合作是否变得至关重要?
在伯克利,我们亲眼目睹了跨学科合作是多么混乱,但又是多么宝贵。我们的生物工程系包括来自合成生物学、计算机科学、硬件工程和微流体领域的人员。这种多样性让我们能够解决任何单一学科都无法单独解决的复杂问题。
这种合作至关重要的一个领域是扩大人工智能驱动的工程设计。例如,在 JBEI,我们的微流体实验室正在开发用于优化高通量菌株工程的新型设备。他们的工作让我们能够在短至几周的工程周期内测试数千种不同的蛋白质设计。
合作的挑战在于研究历来是孤立的。化学家、生物学家和计算机科学家通常在不同的领域开展工作,使用不同的术语和框架。我们需要更好的交流和共享的知识平台,才能真正整合这些领域。仅此一项就能大大加速进步。
CAS:如果您有一根魔杖可以改变药物发现过程中的任何事情,您会改变什么?
我的回答有些哲学性,但我会改变科学研究的估值和资助方式,尤其是在生物技术领域。目前,初创企业和学术实验室采用高风险、高回报的模式运作,许多有前景的想法因为不符合传统的资助结构而无法得到充分发展。如果我们想发挥尖端科学的潜力,就需要对基础研究进行长期投资,而不仅仅投资短期的利润驱动型项目。
我会创建一个系统,让所有先前的研究能够在结构化和机器可读的数据库中即时访问。我们面临的最大障碍是,大量有价值的数据被锁定在 PDF 中,并分散在不同的存储库中。如果我们能立即提取并分析所有已发表的关于特定途径的内容,我们就能成倍地加快发现的速度。
Graham Hudson 博士毕业于圣路易斯大学,获得生物化学学士学位,期间研究了 RNA 碱基对热力学如何支持治疗设计。他师从 Douglas A. Mitchell,在伊利诺伊大学厄巴纳-香槟分校获得博士学位,主要研究 RiPP 天然产物——重建硫肽生物合成,发现了两类新型物质 (ranthipeptides 和 pyritides),并揭示了硫代酰胺化的酶学基础。目前,他是加州大学伯克利分校 Jay D. Keasling 实验室的博士后研究员,研究皂苷天然产物的酶学和生物合成。他还为业界提供天然产物研究方面的咨询服务。
Nathan Lanclos 拥有南佛罗里达大学分子生物学理学学士学位和经济学学士学位,期间他与 Vladimir Uversky 合作研究癌症中的蛋白质功能,并与 Ramon Gonzalez 合作设计细菌的 C1 代谢。他目前是加州大学旧金山分校/加州大学伯克利分校联合生物工程项目的博士生。2022 年,他创立了一家咨询公司,为生物科技初创公司提供市场营销策略和数据建模支持。他主要研究用于蛋白质设计和高通量蛋白质工程的机器学习,重点关注用于化学和治疗生产的多结构域复合物,例如聚酮合酶 (PKS)。




