En los últimos años, se ha hecho cada vez más hincapié en el microbioma intestinal y su papel en la salud humana en general. En relación con ello, la salud animal se entiende cada vez más a través de la lente de este complejo ecosistema de microorganismos que desempeña un papel fundamental en la digestión, la inmunidad y la resistencia a las enfermedades. La gente está preocupada por el uso de antibióticos en el ganado que se convierte en nuestra fuente de alimentos, así como por el bienestar animal y la salud de nuestras mascotas, todo ello relacionado con el microbioma intestinal.
Como resultado, los investigadores están explorando formas de proteger y mejorar la salud animal mediante estrategias alimentarias y terapéuticas, algunas de las cuales son similares a las del mercado de ayudas al microbioma humano, y otras novedosas para el reino animal.
La base de la salud animal
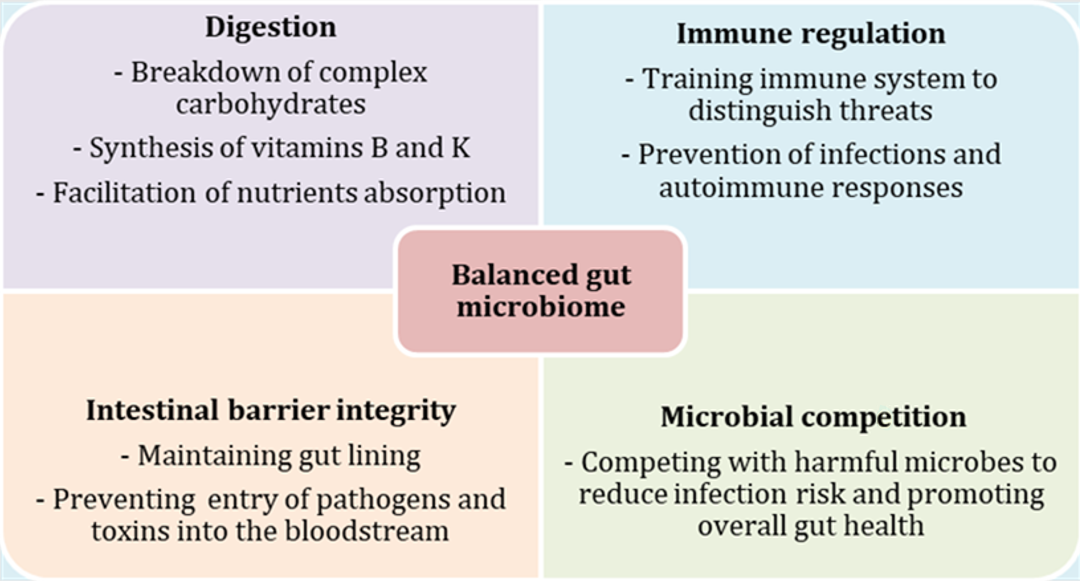
El microbioma intestinal comprende billones de microorganismos, entre bacterias, arqueas, virus y hongos, que residen en el tubo digestivo. Estos microbios desarrollan papeles esenciales en la digestión de nutrientes, el desarrollo del sistema inmunitario y la protección frente a patógenos. Un microbioma equilibrado favorece la eficiencia alimentaria, el crecimiento y la resistencia del ganado y los animales de compañía (véase la figura 1). Las alteraciones del equilibrio microbiano, conocidas como disbiosis, están relacionadas con trastornos gastrointestinales, enfermedades metabólicas y una menor productividad.
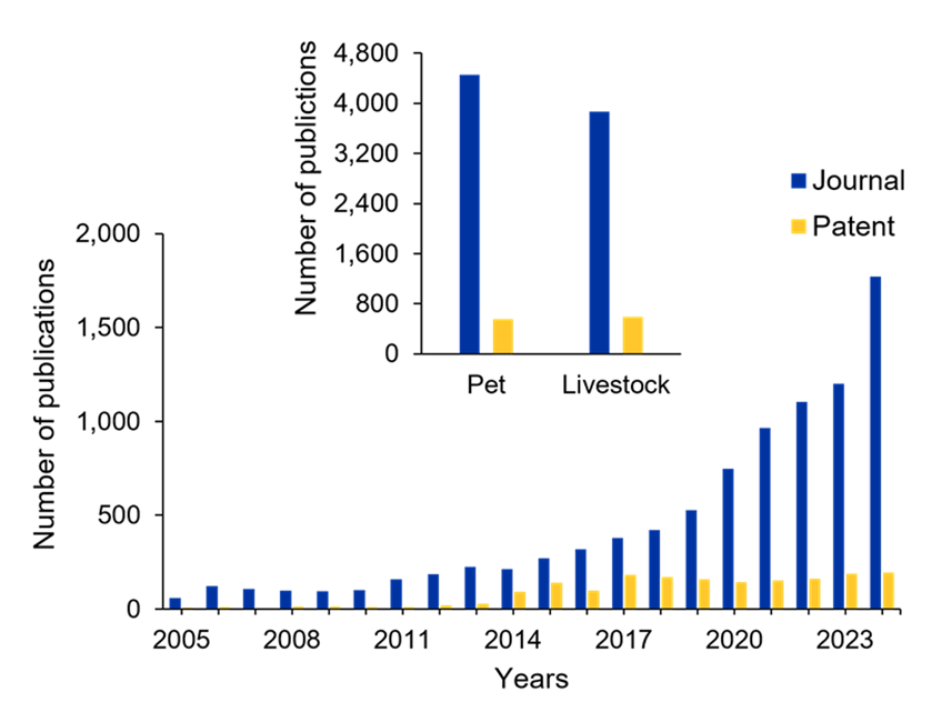
Hemos analizado la CAS Content CollectionTM, el mayor repositorio de información científica curado por humanos, y hemos hallado una notable evolución en el panorama de la investigación relativa al microbioma intestinal animal. De 2005 a 2024, se ha producido una tendencia ascendente constante en las publicaciones de revistas en este campo (véase la figura 2). La comparación del recuadro muestra que los animales de compañía tienen en conjunto ligeramente más publicaciones que el ganado, y los artículos de revistas superan sistemáticamente en número a las patentes en ambas categorías.
Esto demuestra la mayor atención prestada a la salud de las mascotas en los últimos años y que la mayor parte de la investigación en este campo no ha llegado a comercializarse. Sin embargo, varias estrategias terapéuticas están ganando terreno sobre la base de nuestro análisis. Como vemos en la figura 3A, muchas enfermedades están asociadas a la disbiosis del microbioma intestinal, siendo las afecciones gastrointestinales, metabólicas e inmunológicas las más documentadas. La figura 3B destaca las estrategias terapéuticas dirigidas a restablecer el equilibrio microbiano, siendo los probióticos y los prebióticos los que reciben mayor atención en la investigación. Esta comparación subraya el creciente interés científico por las intervenciones dirigidas al microbioma para diversas afecciones de salud.

Por ejemplo, en el ganado como el vacuno, las aves de corral, los cerdos y los pequeños rumiantes, la salud intestinal está estrechamente relacionada con la eficiencia alimentaria, el aumento de peso, el éxito reproductivo y la resistencia a las enfermedades. En animales de compañía como perros y gatos, el microbioma afecta no solo a la digestión y la inmunidad, sino también al estado de ánimo, el comportamiento, el estado de la piel y la vitalidad general. La disbiosis en los animales de compañía se ha asociado con afecciones crónicas como la obesidad, las alergias, la enfermedad inflamatoria intestinal, el cáncer de intestino y la ansiedad, lo que pone de relieve el amplio impacto del microbioma en la nutrición y la calidad de vida de los animales.
Los enfoques terapéuticos actuales para modular la microbiota intestinal
Cuando el microbioma intestinal se desequilibra debido a factores como el uso de antibióticos, una dieta inadecuada, el estrés o las infecciones, puede provocar disbiosis, que se manifiesta como alteraciones gastrointestinales, inflamación, problemas metabólicos y debilitamiento de la inmunidad. Han surgido varias estrategias terapéuticas para abordar la disbiosis:
Probióticos y prebióticos
Los probióticos —microbios vivos beneficiosos como los lactobacilos, las bifidobacterias y los enterococos— desempeñan un papel vital en la mejora de la salud intestinal de los animales. Ayudan a restablecer el equilibrio microbiano, suprimen los patógenos, mejoran la absorción de nutrientes y reducen las alteraciones gastrointestinales, especialmente durante el estrés, las transiciones dietéticas y el desarrollo temprano. Los estudios efectuados en terneros, lechones y yaks han demostrado que las dietas ricas en probióticos mejoran la morfología intestinal, la diversidad microbiana, las respuestas inmunitarias y el rendimiento del crecimiento, al tiempo que reducen la inflamación y favorecen la digestión. Tales pruebas demuestran el potencial de los probióticos y simbióticos para promover la producción ganadera sin antibióticos y optimizar la microbiota intestinal para la salud general de los animales.
Los prebióticos, como los fructooligosacáridos (FOS), la inulina y los manano-oligosacáridos (MOS), son fibras alimentarias no digeribles que estimulan selectivamente el crecimiento de bacterias intestinales beneficiosas. Su fermentación por los microbios intestinales conduce a la producción de ácidos grasos de cadena corta (AGCC), especialmente butirato, acetato y propionato, que desempeñan un papel fundamental en el mantenimiento de la integridad de la barrera intestinal, la reducción de la inflamación y el apoyo a la salud metabólica.
Postbióticos
Los posbióticos, que son metabolitos o componentes estructurales producidos por los probióticos, como el ácido láctico y los péptidos, ofrecen una alternativa estable y no viva para mejorar la salud animal. Cuando se añaden al pienso, pueden modular las respuestas inmunitarias de la mucosa y sistémicas, favoreciendo la integridad intestinal y reduciendo la inflamación. Un reciente ensayo clínico de Admixture Research Company ha demostrado el potencial de los postbióticos en la salud de los animales de compañía. En perros adultos, la forma postbiótica tratada térmicamente de Bifidobacterium animalis subsp. lactis CECT 8145 (PRIOME® MH) redujo significativamente los niveles posprandiales de glucosa en sangre durante una fase de pérdida de peso, lo que sugiere su papel en el apoyo a la salud metabólica.
Trasplante de microbiota fecal
El trasplante de microbiota fecal (TMF) está ganando reconocimiento como valiosa herramienta terapéutica en medicina veterinaria, con aplicaciones en animales de compañía y de cría. En perros y gatos, el TMF se ha mostrado prometedor en el tratamiento de trastornos gastrointestinales como la diarrea asociada a antibióticos, la diarrea crónica y la enfermedad inflamatoria intestinal (EII), mejorando significativamente los síntomas clínicos y restableciendo el equilibrio microbiano (Ref). En ganadería, el TMF se ha explorado en rumiantes como terneros y vacas lecheras para controlar la diarrea e incluso mejorar la salud de la ubre y la calidad de la leche en casos de mastitis subclínica. En el sector porcino, sobre todo en cerdos jóvenes, el TMF ha sido eficaz para reducir la diarrea posdestete, aumentar la ganancia de peso y mejorar la composición de la microbiota intestinal. Estas aplicaciones ponen de relieve el potencial del TMF para mejorar la salud, la productividad y el bienestar de los animales.
Terapia con fagos
La terapia con bacteriófagos es una alternativa emergente a los antibióticos en el tratamiento de las infecciones bacterianas debido a sus múltiples ventajas como fármacos adaptativos. Entre ellas, su alta especificidad y su capacidad para evolucionar y multiplicarse en el lugar de las infecciones. Entre sus prometedoras aplicaciones se encuentran la prevención de la mastitis en el ganado vacuno causada por Staphylococcus aureus, la mitigación de la salmonelosis en el ganado porcino debida a Salmonella enteritidis y el control de Campylobacter jejuni y Salmonella Gallinarum en las aves de corral. Los recientes avances en ingeniería genética, en particular la integración de los sistemas CRISPR/Cas9, han mejorado aún más la precisión y la eficacia de la terapia con fagos.
Terapéutica de nueva generación: hacer frente a la resistencia a los antimicrobianos
Como se observa en los enfoques terapéuticos actuales, como los prebióticos y los probióticos, es importante abordar el uso de antibióticos y la resistencia a los mismos. La resistencia a los antimicrobianos (RAM) afecta a la seguridad alimentaria, la salud humana y la atención veterinaria porque el microbioma intestinal sirve como reservorio clave de genes resistentes a los antimicrobianos (GRA). El mal uso generalizado de los antimicrobianos en el ganado y los animales de compañía ha acelerado la resistencia, y Asia representa el 67 % de las 99 500 toneladas estimadas de uso mundial de antimicrobianos veterinarios en 2020. Se prevé que esta cifra aumente un 8 % para 2030, lo que subraya la necesidad de intervenciones urgentes y coordinadas que tengan en cuenta la compleja interacción entre el uso de antimicrobianos, la alteración del microbioma intestinal y el desarrollo de resistencias.
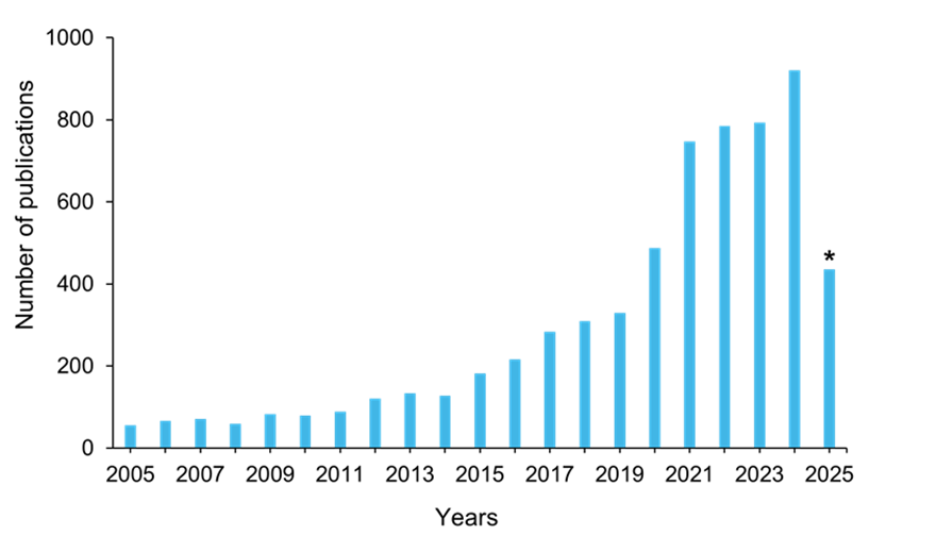
Los trabajos de investigación se han intensificado en respuesta, como se refleja en un aumento constante de las publicaciones relacionadas con la RAM dentro de la CAS Content Collection durante las dos últimas décadas (véase la figura 4). En la actualidad se están desarrollando diversas estrategias innovadoras.
Intervenciones centradas en la sostenibilidad
Los tratamientos centrados en el microbioma pueden mejorar la salud animal y la sostenibilidad medioambiental simultáneamente. Un estudio demostró que ciertas bacterias intestinales podían absorber y eliminar las sustancias perfluoroalquiladas y polifluoroalquiladas (PFAS), una clase de contaminantes medioambientales persistentes. En ratones, estos microbios redujeron los niveles sistémicos de PFAS hasta en un 75 %, lo que sugiere una vía prometedora para las estrategias de desintoxicación en animales.
Otro avance innovador es el uso de la tecnología CRISPR para diseñar probióticos que reduzcan las emisiones de metano en el ganado. Dado que el metano, un potente gas de efecto invernadero, es producido principalmente por arqueas metanogénicas en el rumen, modificar la composición microbiana en las primeras etapas de la vida podría reducir significativamente las emisiones sin afectar a la productividad, ofreciendo una solución sostenible para la industria ganadera. Esta intervención basada en el microbioma ofrece una estrategia sostenible para la industria ganadera, sobre todo teniendo en cuenta que las emisiones del ganado contribuyen aproximadamente en un 14,5 % a las emisiones mundiales de gases de efecto invernadero.
Longevidad
Un estudio reciente examinó los perfiles microbianos intestinales en conejos y descubrió que ciertos microbios, como Akkermansia y Christensenellaceae, se asociaban con una vida reproductiva más larga y una mayor resistencia. Estos hallazgos sugieren que la selección o suplementación basada en microbiomas podría integrarse en los programas de cría para aumentar la longevidad y la productividad. Aprovechando herramientas como CAS Scientific Patent ExplorerTM, identificamos varias patentes que muestran un creciente interés comercial en este campo.
Por ejemplo, una patente reciente cubría formulaciones probióticas estabilizadas para alimentos de mascotas que mejoran la palatabilidad y los resultados sanitarios. Otras patentes se centran en probióticos multicepas y enfoques terapéuticos para corregir la disbiosis en el ganado y los animales de compañía. Otra patente describe una mezcla de microbios y nutrientes diseñada para mejorar la salud intestinal y el rendimiento animal.
Nuevas clases de antibióticos
Descubrimientos recientes introducen nuevos agentes antimicrobianos con actividad de amplio espectro y toxicidad mínima que pretenden preservar la microbiota intestinal beneficiosa al tiempo que atacan a los patógenos. Un ejemplo de ello es la lariocidina, un péptido lazo recientemente identificado que demuestra una potente eficacia en modelos animales y resulta prometedor para superar los mecanismos de resistencia. Del mismo modo, se ha descubierto que una proteína bioactiva de las ostras de roca de Sídney altera las biopelículas bacterianas y mejora la eficacia antibiótica contra el Staphylococcus aureus y la Pseudomonas aeruginosa resistentes a los fármacos sin que se observe toxicidad ni alteraciones importantes del microbioma.
Terapia fotodinámica antimicrobiana
La terapia fotodinámica antimicrobiana (TFDa) es un enfoque novedoso que utiliza un fotosensibilizador activado por la luz en presencia de oxígeno para producir especies reactivas de oxígeno (ERO), que matan eficazmente a los patógenos. En medicina veterinaria, la TFDa se ha mostrado prometedora en el tratamiento de la mastitis en ganado vacuno y ovino, así como en infecciones cutáneas y otitis en pequeños animales. Los estudios han demostrado su eficacia contra diversas bacterias causantes de mastitis y cepas multirresistentes. Sin embargo, entre las limitaciones se incluyen la naturaleza tópica de la aplicación del fotosensibilizador debido a la sensibilidad sistémica a la luz y la posible toxicidad, que requieren más investigación antes de un uso más amplio en sanidad animal.
Péptidos antimicrobianos
Los péptidos antimicrobianos (PAM) están ganando atención como alternativas innovadoras a los antibióticos convencionales en el cuidado del ganado y de los animales de compañía. Estos péptidos, clasificados en tipos sintetizados de forma no ribosómica y ribosómica, muestran una potente actividad bactericida contra numerosos patógenos. Los PAM no ribosómicos como la polimixina y la bacitracina se dirigen a las membranas bacterianas y a la síntesis de la pared celular, mientras que los PAM sintetizados ribosómicamente, incluidas las bacteriocinas como la nisina y la pediocina, interrumpen vías biosintéticas y procesos celulares clave. Su biodegradabilidad, mínimo impacto medioambiental y compatibilidad con otros tratamientos los convierten en atractivos candidatos para aditivos alimentarios y agentes terapéuticos. Sin embargo, a pesar de estas ventajas, persisten retos como los elevados costes de producción, el estrecho espectro antibacteriano, la posible toxicidad y los problemas de estabilidad durante la administración y el transporte. Los avances en ingeniería genética y de proteínas abordan estas limitaciones, allanando el camino para que los PAM desempeñen un papel más destacado en la gestión sostenible de la salud animal.
Estrategias inmunomoduladoras
Potenciar el sistema inmunitario natural de los animales mediante estrategias inmunomoduladoras ofrece una alternativa prometedora a los enfoques antimicrobianos tradicionales. Los métodos clave incluyen el uso de probióticos, prebióticos, posbióticos y simbióticos, que apoyan un microbioma intestinal sano y refuerzan la resistencia a los patógenos dañinos. También se emplean inmunoestimulantes para activar y reforzar las respuestas inmunitarias, reduciendo así la dependencia de los antibióticos. Además, los programas de vacunación selectiva desempeñan un papel crucial en la prevención de infecciones causadas por patógenos resistentes, ofreciendo una protección proactiva y contribuyendo a la salud general del rebaño y a la gestión de las enfermedades.
Fitoquímicos
Los fitoquímicos son compuestos bioactivos de origen vegetal con probados beneficios para la salud. Sus propiedades antimicrobianas, junto con su capacidad para potenciar la absorción de nutrientes, mejorar la salud intestinal y reducir el deterioro, los convierten en prometedoras alternativas naturales a los antibióticos en la producción de rumiantes, cerdos y aves de corral.
Nanopartículas
Las nanopartículas surgen como alternativas prometedoras a los antibióticos en la salud animal debido a sus mecanismos antimicrobianos únicos y a sus propiedades fisicoquímicas. Las nanopartículas de plata, cobre y materiales compuestos han demostrado una gran eficacia in vitro contra los patógenos causantes de mastitis, infecciones uterinas y enfermedades de las pezuñas en el ganado lechero. Su capacidad para alterar las membranas bacterianas, generar especies reactivas de oxígeno y dañar las estructuras intracelulares ofrece un método novedoso para combatir los microbios resistentes a los fármacos. Aunque los primeros estudios sugieren seguridad a bajas concentraciones, las preocupaciones sobre la citotoxicidad y la bioacumulación ponen de relieve la necesidad de más investigación in vivo antes de su aplicación veterinaria generalizada.
Terapia de ozono
La ozonoterapia está cobrando atención como alternativa segura y eficaz a los antibióticos en medicina veterinaria. Sus fuertes propiedades oxidantes le permiten matar bacterias al alterar las membranas celulares y el ADN, al tiempo que ofrece efectos inmunomoduladores y antioxidantes a dosis bajas. Utilizado en bovinos, ovinos, caprinos y equinos, el ozono ha demostrado su eficacia en el tratamiento de la mastitis, la metritis y los trastornos reproductivos sin dejar residuos en la leche o la carne, evitando así los periodos de supresión.
Nutrigenética: Alimentación por diseño
Tanto en humanos como en animales, la dieta está estrechamente vinculada a la salud del microbioma intestinal. La nutrigenética, el estudio del modo en que influyen las variaciones genéticas en la respuesta de un animal a los nutrientes, está transformando los servicios de salud animal, al permitir una nutrición de precisión adaptada a los perfiles genéticos. Esencialmente, este enfoque reconoce que las variaciones genéticas individuales afectan a la forma en que los animales metabolizan los nutrientes y responden a las intervenciones dietéticas, con implicaciones directas para la diversidad del microbioma y la prevalencia de genes de resistencia a los antimicrobianos.
A nivel molecular, los nutrientes interactúan con los genes a través de diversos mecanismos (véase la figura 5). Comprender estos mecanismos permite desarrollar dietas específicas que favorezcan una expresión genética óptima, un rendimiento fisiológico y una composición beneficiosa del microbioma, al tiempo que se reduce la presión selectiva para la resistencia a los antimicrobianos.
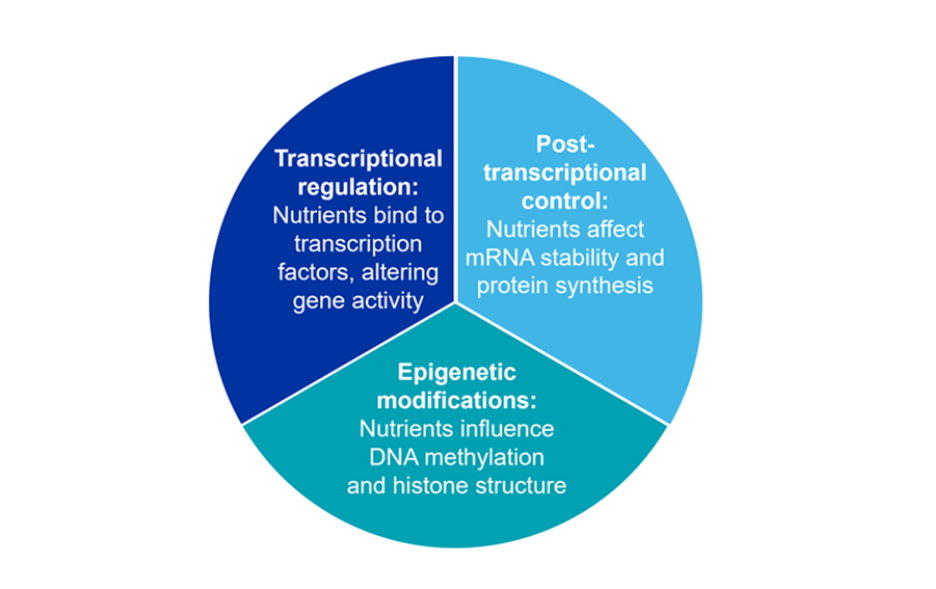
Figura 5: Mecanismos moleculares a través de los cuales los nutrientes interactúan con los genes.
Aplicaciones y beneficios para la salud
- Ganadería: la nutrigenética ha encontrado amplias aplicaciones en el ganado, ofreciendo estrategias nutricionales específicas que se alinean con los perfiles genéticos para mejorar la salud y la productividad. La investigación ha revelado que la genética del huésped puede influir en la composición microbiana intestinal, con variaciones genéticas específicas que afectan a la eficiencia alimentaria a través de vías mediadas por el microbioma. En las aves de corral, la elaboración de perfiles genéticos ha permitido formular piensos que mejoran las tasas de crecimiento, la eficiencia de la conversión alimenticia y la resistencia inmunitaria, al tiempo que promueven comunidades microbianas beneficiosas que resisten la colonización de patógenos. En porcino, los enfoques nutrigenéticos han ayudado a identificar cerdos con rasgos superiores de utilización de nutrientes, permitiendo una alimentación de precisión que favorece el rendimiento reproductivo y reduce el desperdicio. Del mismo modo, en el ganado lechero, se ha demostrado que las dietas basadas en el genotipo mejoran la producción de leche y reducen la incidencia de trastornos metabólicos como la cetosis y la acidosis. Yendo más allá de la ganadería tradicional, las ovejas y las cabras se están estudiando en busca de rasgos nutrigenéticos que influyan en la eficiencia reproductiva, la función inmunitaria y la adaptación a entornos con escasez de nutrientes.
- Equinos: la nutrigenética se está explorando en caballos para gestionar síndromes metabólicos, favorecer el rendimiento en caballos de deporte y prevenir afecciones como la laminitis mediante estrategias de nutrición adaptadas. Estas aplicaciones son relevantes en entornos competitivos y terapéuticos, donde la salud y la recuperación óptimas son esenciales.
- Animales de compañía: la nutrigenética está ganando terreno en la gestión de las condiciones de salud específicas de cada raza en perros y gatos, como la obesidad, las alergias alimentarias y los trastornos metabólicos. Se están desarrollando dietas personalizadas basadas en predisposiciones genéticas para mejorar la longevidad y el bienestar general. Estos enfoques también favorecen la salud inmunitaria y digestiva, lo que contribuye a mejorar la calidad de vida y a reducir las intervenciones veterinarias.
De cara al futuro, el éxito de la integración de la nutrigenética en la nutrición animal dependerá de varias prioridades estratégicas: simplificar los procesos de cribado genético, desarrollar modelos de alimentación escalables y adaptables que tengan en cuenta las interacciones del microbioma, ampliar la investigación para incluir a las especies infrarrepresentadas y establecer marcos normativos claros. Al adoptar estos avances, los productores, veterinarios y propietarios de mascotas pueden pasar de enfoques genéricos de alimentación a estrategias de nutrición de precisión que se ajusten al potencial genético y a las necesidades de salud de cada animal.
La salud intestinal significa el bienestar general del animal
Avanzar en la salud animal requiere un enfoque holístico que integre la ciencia del microbioma intestinal, los conocimientos nutrigenéticos y las alternativas innovadoras a la resistencia a los antimicrobianos. Juntos, estos ámbitos ofrecen poderosas herramientas para mejorar la inmunidad, optimizar la nutrición y reducir la dependencia de los antibióticos. A medida que sigamos comprendiendo la importancia del microbioma intestinal, los nuevos descubrimientos se aplicarán no solo a la salud humana, sino también a las fuentes de alimentos y a los animales de compañía que interactúan con nosotros y nuestro entorno.