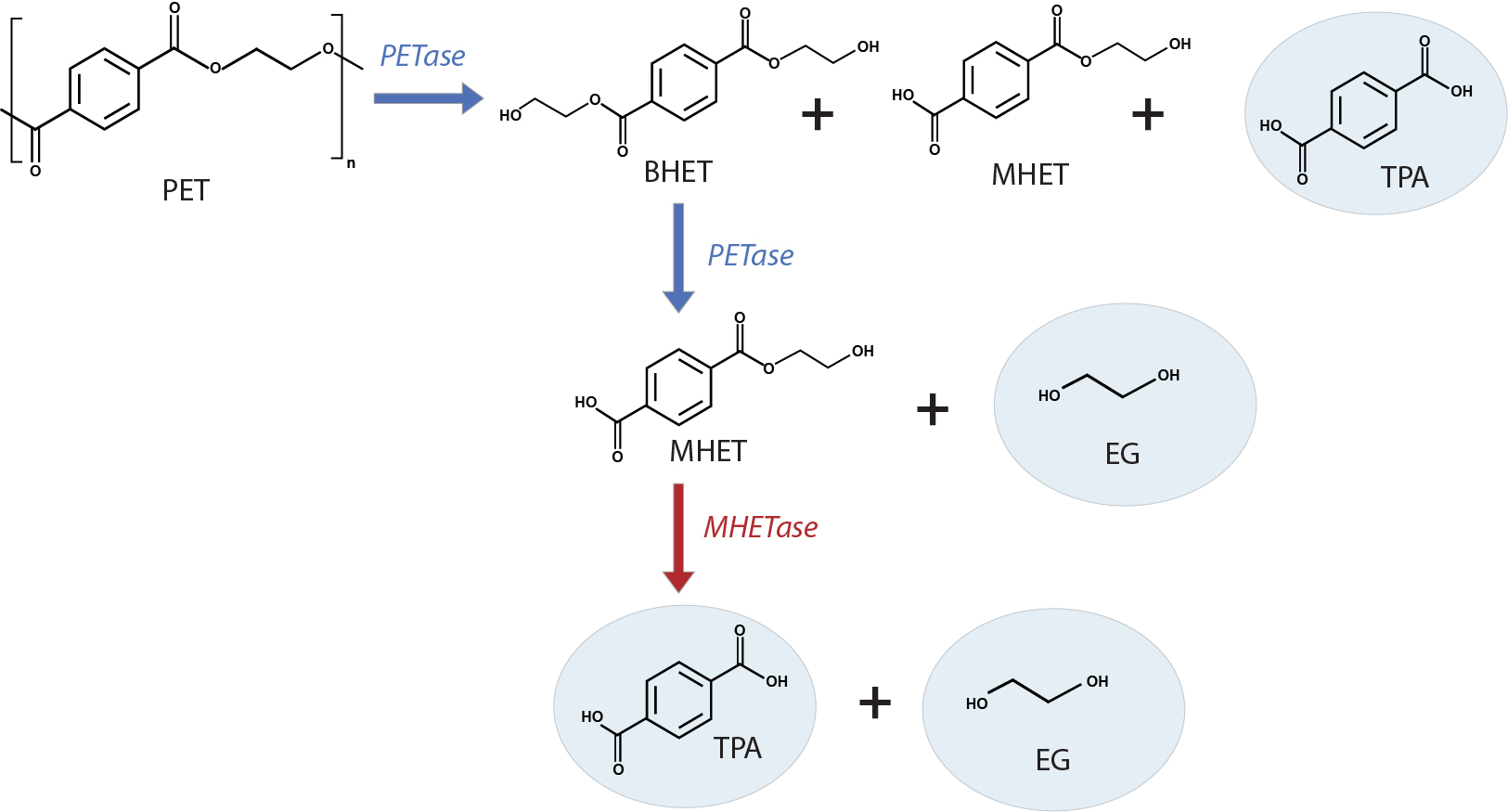
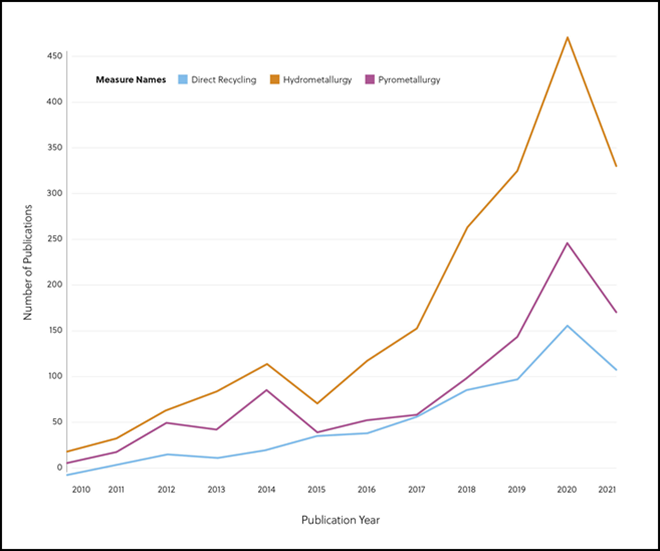
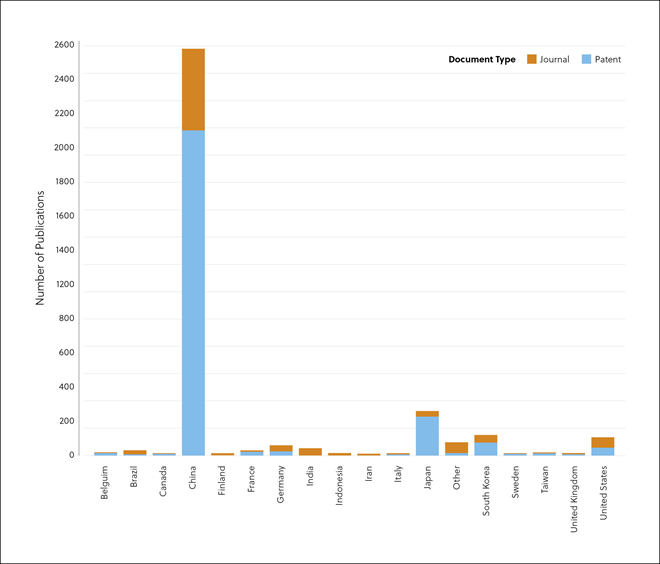
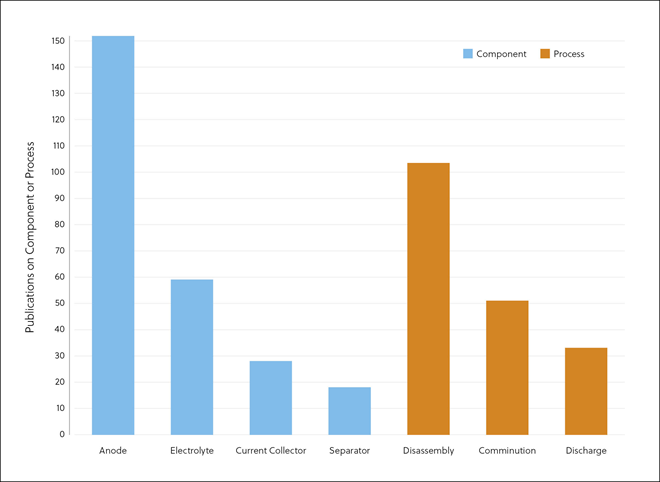
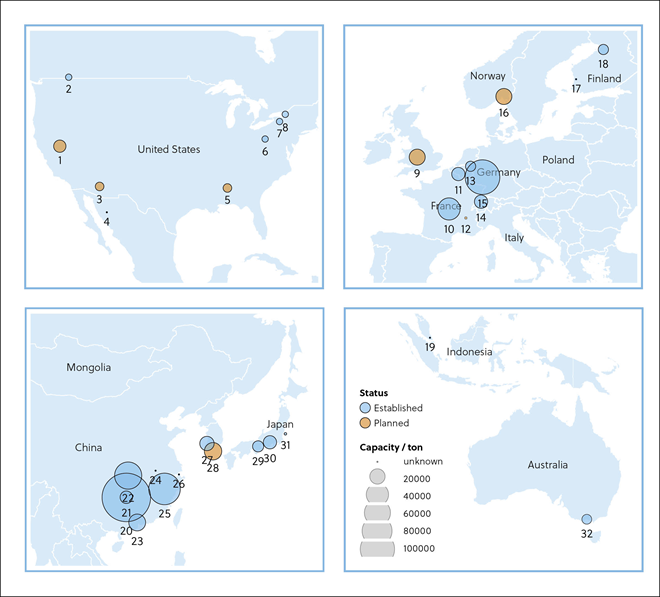
La ECA2 es una proteína de membrana con un dominio enzimático que se localiza en la superficie externa de las células humanas y es la diana y receptora principal del virus SARS-CoV-2 que causa la COVID-19.
Aunque muchos tratamientos y curas tratan de combatir al propio virus, algunos investigadores están intentando encontrar formas de aprovechar la ECA2 para impedir la propagación del coronavirus. La ECA2 desempeña un papel crucial en la invasión de las células del anfitrión por el virus SARS-CoV-2. Por este motivo, algunas iniciativas van dirigidas a desarrollar fármacos que puedan bloquear esta función.



![Código ORCiD del autor: en nuestro sitio web, mostramos el icono del identificador ORCiD junto a los nombres de los autores para indicar que el ORCiD fue autenticado cuando lo introdujo el usuario. Para ver el registro ORCiD de los usuarios, haga clic en el icono. [se abre en una nueva pestaña]](https://chemrxiv.org/engage/assets/public/chemrxiv/logo/orcid.png)