最近刊载于 Frontiers in Bioengineering and Biotechnology 的一篇综述文章中,作者指出,“我们正处于一场疗法革命之中”。 文章表示,RNA 疗法在现代研究和临床开发中迅速发展,部分原因在于人们对用于治疗当前新冠肺炎的 RNA COVID-19 疫苗的兴趣。
传统药物开发一直以所谓的小分子药物(定义为任何低分子量有机化合物)为主,这些药物在医学领域仍有许多应用。 然而,随着生物技术和分子生物学的进步,研究人员得以设计大分子药物,包括单克隆抗体、重组蛋白、寡核苷酸和基因/基因片段等候选药物。 因此,“生物制剂”已成为当今至关重要的治疗工具。 截至 2020 年初,全球十大畅销药物中有七种都是生物制剂。
此外,核酸药物设计方兴未艾,正在飞速发展。 虽然 RNA 疗法的临床开发一直以来受到效率和免疫原性等挑战的阻碍,但最近 mRNA COVID-19 疫苗的成功以及数种 RNA 药物的获批为该领域带来了巨大动力。 借助 CAS 内容合集™ 这一最大的人工收录的已发表科学文献合集,我们研究了 RNA 在现代医学中的应用。
阅读相关 CAS 洞察报告:《RNA 衍生药物:研究趋势和发展综述》
RNA 疗法的优势和挑战
针对“不可成药”的靶向疗法
RNA 疗法的一大优势是 RNA 药物可用于“不可成药”的分子靶向疗法,而小分子药物则很难或不可能实现这一点。 只有大约五分之一的蛋白质可以作为常用药物(包括小分子和抗体)的靶点,且传统的小分子或单克隆抗体(与蛋白质受体或酶的活性位点口袋结合,因此需要进行翻译)无法用于非编码 RNA 靶向疗法。
易于合成
相比蛋白质,RNA 产品的制造过程简单、成本较低、速度较快,这些主要的制造优势在最近的 RNA 疫苗开发中尤为重要。 核酸策略还可通过利用哺乳动物细胞的细胞机制来应对复杂合成过程的要求,例如翻译后修饰。
此外,可以快速调整 RNA 序列,为不同靶点提供定制分子。 这大大加快了开发过程,例如实现了COVID-19 RNA 疫苗的快速开发。
安全性和副作用
由于 DNA 药物会进入细胞核,可能整合到宿主基因组中,因此引起了安全问题。 除了编辑基因组的 CRISPR-Cas 系统 RNA 之外,RNA 不会改变基因组材料,也不会带来基因组整合的风险。
然而,RNA 疗法可能存在特异性问题,具有副作用风险,其对降解的敏感性可能会导致药效学较差,从而使其应用变得复杂。 其中一些问题可以通过化学修饰 RNA 来应对,这也是研究的一项重点。
递送
与小分子疗法相比,RNA 疗法往往具有较大尺寸和高电荷,因此难以以天然形式在细胞内进行递送。
RNA 疗法的研究趋势
自 1995 年以来,包含 RNA 疗法信息的期刊和专利数量稳步增加,患者数在 2001 年左右达到高峰(可能与首次使用转染编码肿瘤抗原的 mRNA 的树突状细胞进行人体临床试验有关),2020 年,相关期刊数量激增(很可能是由于人们对 COVID-19 mRNA 疫苗的兴趣所致)(图 1)。

随着新型 RNA 的发现,RNA 研究逐渐变得更加多样化,特别是在 siRNA、miRNA、lncRNA 和 CRISPR 领域(图 2)。 circRNA、外泌体 RNA、lncRNA 和 CRISPR 领域的出版物数量增长速度明显快于其他领域。 值得注意的是,2020 年,CRISPR 技术占 RNA 相关专利申请总量的 20%。 与此同时,越来越多的 CRISPR 疗法获批进入临床试验阶段。

干扰新发现 RNA 的功能被视为一种前景光明的治疗工具,可以克服传统疗法的不足之处(表 1)。
表 1:不同类型 RNA 的治疗作用
RNA 疗法针对的是哪些治疗领域?
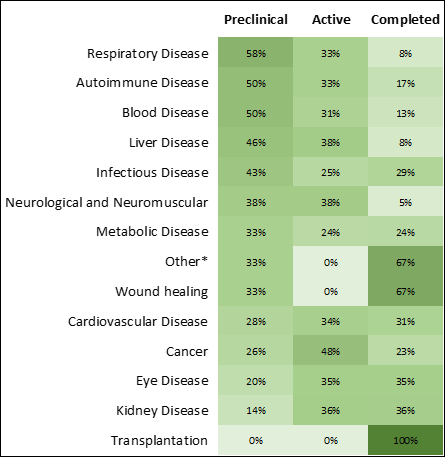
在研究阶段,传染病和癌症疗法增长最快,数量最多(图 3 和 4)。 新冠疫情加速了用于传染病的 RNA 药物的研究,增加了获批的疗法数量(图 4),将首个获批 mRNA 疗法推向市场。

解决 RNA 疗法中的挑战
RNA 化学修饰可用于防止 RNA 降解并提高靶点特异性,降低因脱靶效应而产生副作用的风险。 除了化学修饰外,递送载体(包含纳米材料)还可用于保护 RNA 不被降解并帮助将治疗药物运送到所需靶点。
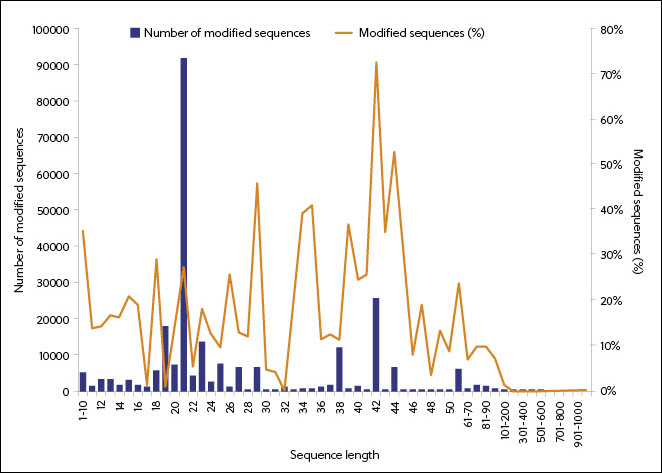
根据 CAS 内容合集中的数据,RNA 修饰的使用始于 1995 年,并且一般采用较小的序列长度(图 5)。 修饰的长 18-27 个核苷酸的 RNA 占有优势,反映了这种序列长度在特定形式的 RNA(siRNA 和 ASO)中的使用。 检查获得 FDA 批准的 RNA 药物中的修饰后证实了 RNA 类型与其修饰之间的相关性。
RNA 碱基修饰
非典型核苷酸如果含有干扰氢键形成的修饰,可破坏带靶点双链体形成过程的热稳定性,从而通过限制脱靶结合来提高靶点特异性。 此外,修饰可以提高 RNA 的治疗性能。 在治疗性 mRNA(例如 COVID-19 mRNA 疫苗)中使用修饰的碱基 N1-甲基假尿苷可以促进翻译并降低对 mRNA 的细胞毒副作用和免疫反应。 辉瑞公司的 Comirnaty 和 Moderna 的 Spikevax mRNA 疫苗还使用 7-甲基鸟苷上端,通过 5' 三磷酸连接到 mRNA 的 5' 端,复制此防止 mRNA 5' 端降解的天然 mRNA 上端
核糖修饰
RNA 中核糖 2' 位置的修饰可以增加稳定性并减少脱靶效应。 2' 位最常见的修饰包括 2'-O-甲基、2'-氟、2'-O-甲氧基乙基 (MOE) 和 2'-胺。
骨架修饰
糖-磷酸骨架中磷酸基团的修饰可以通过中和可能干扰跨膜转运的负电荷来提高 RNA 递送,并增强对核酸酶的抗性,从而延长其组织消除半衰期。 使用最为广泛的骨架修饰之一是硫代修饰。
RNA 纳米载体相关研究
虽然生物屏障(免疫原性和核酸酶稳定性等)通常通过改变 RNA 的化学结构来解决,但需要额外的递送系统来攻克体内的其他屏障。 将 RNA 封装到纳米颗粒中是保护和递送 RNA 的有效途径。 目前,CAS 内容合集中有近 7,000 篇科学出版物与 RNA 递送系统相关。 RNA 载体相关研究以脂质纳米颗粒为主,紧随其后的是聚合物纳米载体(图 6)。

结论
RNA 疗法代表了一种快速扩展的药物类别,有望改变许多疾病的治疗标准。 与传统小分子和生物分子药物相比,这种疗法具有成本较低、制造相对简单并且能够靶向曾经“不可成药”的位点等几大优势。 可以通过化学修饰和 RNA 纳米载体消除或减少其在稳定性、递送和脱位点效应方面遇到的挑战。 CAS 内容合集中的检索结果表明,COVID-19 等传染病和癌症是 RNA 的关键治疗领域,且 circRNA、外泌体 RNA、lncRNA 和 CRISPR 的出版物数量增速极高,其中 CRISPR 相关研究数量正呈爆炸式增长。
聆听专家意见
如需获得更多见解,请查看最近的 ACS 网络研讨会,了解最令当今 RNA 疗法领域领导者兴奋的研究进展。 本次小组讨论由来自不同研究背景的专家组成,包括:
- John P. Cooke 博士,RNA 疗法中心医学主任
- Robert DeLong 博士,堪萨斯州立大学纳米技术创新中心副教授
- Barb Ambrose 博士,CAS 高级信息科学家
- Ramana Doppalapudi 博士,Avidity Biosciences 化学部副总裁
- 审核人:Gilles Georges 博士,CAS 副总裁兼首席科学官