Gain new perspectives for faster progress directly to your inbox.

共有結合阻害剤は、治療薬の一種として近年人気が高まっています。米国食品医薬品局(FDA)は、主にがんの治療を中心に、いくつかの適応症にわたって複数の共有結合阻害剤を承認しています。 共有結合阻害剤のその独特な作用機序には、一般的な非共有結合阻害剤と比較していくつかの利点があり、治療法開発で有望視されています。
これまで研究者は、安全性に対する懸念や設計・製造上の課題から、共有結合阻害剤の研究を避けてきました。 しかし、昨今その流れは変わりつつあります。
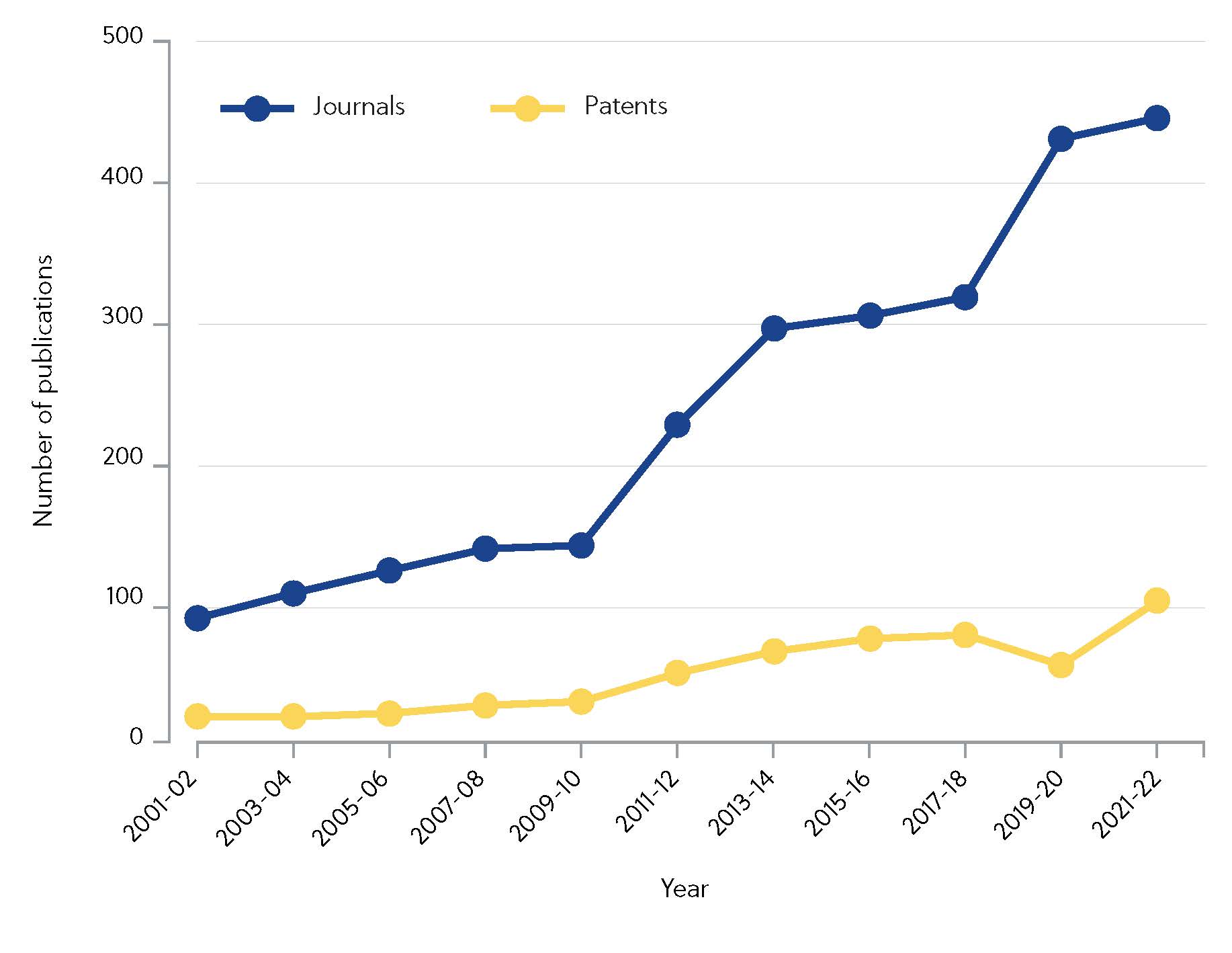
CASでは、2000年以降、共有結合阻害剤のサブセットについて言及している10,000件以上の科学文献を特定しています。 特筆すべきなのは、この10年間で研究活動が活発化しているということです。2010年以降、学術誌への発表件数は4倍になっています(図1)。
こういったさまざまな努力に対し、成果が出てきています。共有結合阻害剤として大成功を収めたイブルチニブとオシメルチニブは、2020年に合計43億3000万ドルの売上を達成しました。 しかし、疑問は残ったままです。つまり、共有結合阻害剤とはいったい何なのか、なぜ企業や学術機関の研究所は非共有結合阻害剤よりも共有結合阻害剤を好むようになってきているのか、ということです。
その名が示すように、共有結合阻害剤は標的タンパク質と共有結合を形成します。それは通常、それを不可逆的に修飾します。 可逆的に結合する非共有結合阻害剤とは異なり、共有結合阻害剤は標的と持続的な結合を形成するため、効果が強化され、また作用時間も長くなります。 これにはメリットもデメリットもあります。
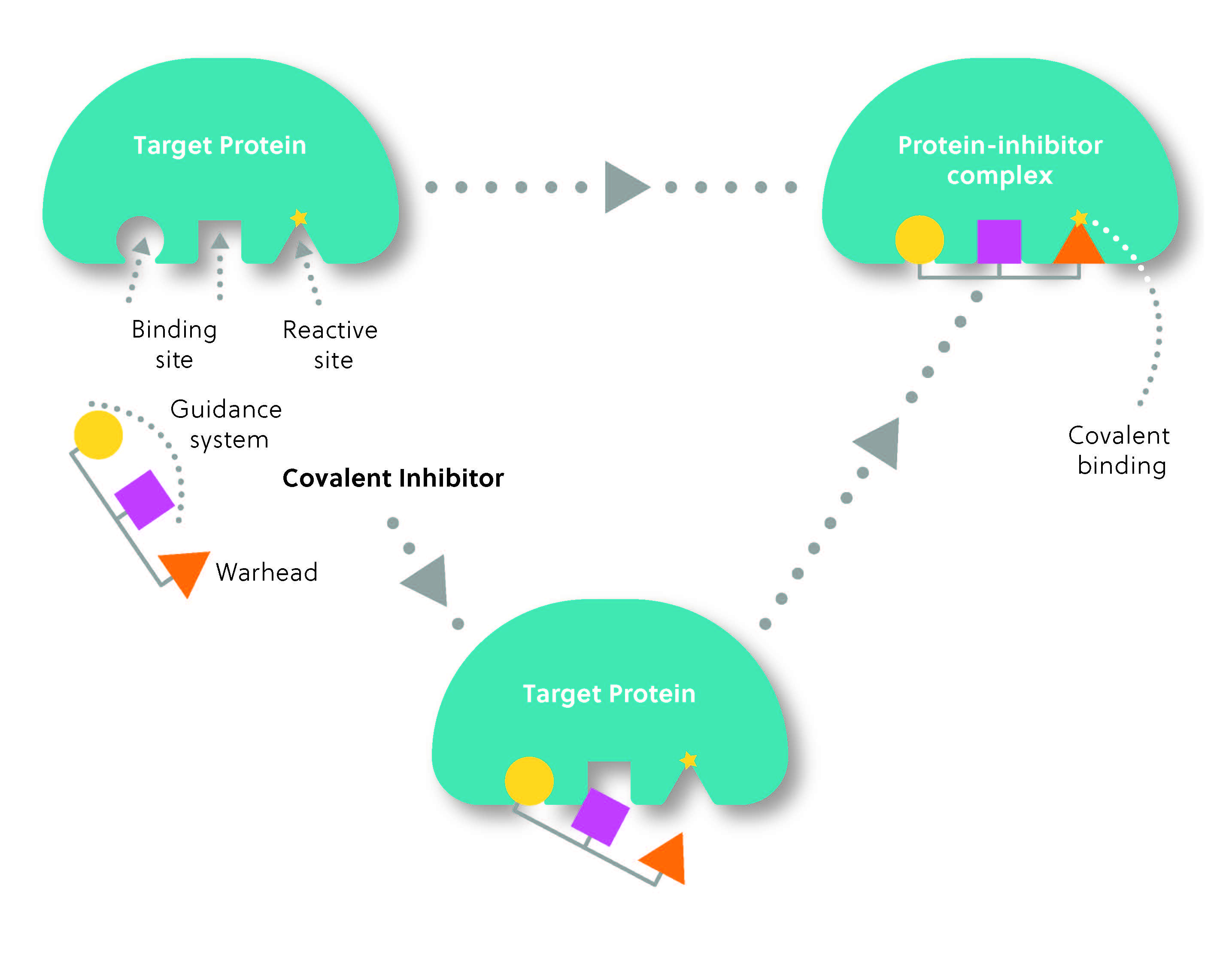
共有結合阻害剤の構造は一般的に2つの部分から成っています。標的と共有結合を形成する反応基または「弾頭」と、標的に対する阻害剤の選択性を決定する「誘導システム」です(図2)。 これは赤外線誘導ミサイルのようなもので、誘導システムが標的を見つけ、弾頭が「攻撃」して共有結合を形成するのです。
共有結合阻害剤は、特に新しいイノベーションではありません。 実際に、共有結合阻害剤は1世紀以上も前から病気の治療に使われており、ペニシリンはその最も古い例のひとつです。 ペニシリン系抗生物質は標的酵素と共有結合することで、細菌の細胞壁合成を阻害し、細胞膜の破裂を引き起こします。 別のよく知られた例としてアスピリンがあります。これは、炎症性伝達物質の生成に関与する主要酵素を不可逆的にアセチル化するものです。 興味深いことに、これらの薬剤が共有結合メカニズムによって作用することが発見されたのは、すでに広く使用された後のことでした。 実際、主要な共有結合阻害薬の多くは、合理的な薬物設計によってではなく、偶発的に発見されたものなのです。
共有結合阻害剤のメリット
共有結合阻害剤には潜在的な利点が数多く存在します。 非共有結合阻害剤が酵素と自由に結合・解離するのに対して、共有結合阻害剤は強固で持続的な結合を標的と形成します。 つまり、標的タンパク質の活性を長時間にわたって効果的に停止させられるため、より持続的な治療効果が期待できるというわけです。 効果が強化されるということは、薬剤の投与量を減らして低頻度で投与できるため、副作用のリスクを下げ、服薬遵守を高め、治療費を削減できる可能性があることを意味します。
さらに、共有結合阻害剤は卓越した選択性を示し、意図した標的に正確に結合できます。 この特性により、一般的な結合ポケットを持たないタンパク質など、非共有結合阻害剤では難かしいものでも標的にできるようになります。 実際、KRAS(最も頻繁に変異するがん遺伝子)のように、以前は「アンドラッガブル」とされていた標的も、今では共有結合阻害剤を用いることで標的化できるようになっています。 最初のKRAS阻害剤であるソトラシブが承認されたことは、治療困難ながんの管理にとって重要なマイルストーンとなっています。
共有結合阻害剤のデメリット
共有結合阻害剤を有望な治療薬としている特性の多くは、医薬品開発の際は逆に課題となってしまう場合があります。 結合が不可逆的ということは、どんな結合も選択的でなければならないことを意味します。 弾頭が十分に選択的でないと、薬剤が意図しないタンパク質に結合してしまい、長期的に有害な標的外効果をもたらしかねません。 さらに標的タンパク質の中には、変異を起こしたり構造変化を起こすことで、共有結合阻害剤が結合することを阻害するものが存在します。 その結果耐性が生じて、薬剤の長期的な有効性が低下することもあります。
こういった課題があることから、共有結合阻害剤の設計には、弾頭の反応性や結合部位の特異性、形成される共有結合の安定性など、さまざまな要因を注意深く考慮する必要があります。 反応基は「ゴルディロックスの原理」に従う必要があります。つまり複合体形成時に標的との結合を形成するのに十分な反応性がある一方、非結合時には他のタンパク質標的や官能基との結合を形成しない程度に弱い反応性が求められるのです。 各要素間で最適なバランスを得るのは、複雑で時間もかかります。
共有結合阻害剤治療薬の台頭
共有結合阻害剤の開発を加速させる上で、技術の進歩は重要な役割を果たしました。 この分野で大きな転機となったのは、研究者が偶発的にメカニズムを発見するのではなく、開発の初期段階から共有結合性に注目し始めたことです。
研究者らは、効果的な共有結合阻害剤による治療法を開発するために、2つの主要アプローチを活用しました。それは、リガンド優先と求電子剤優先です。 リガンド優先アプローチは、標的タンパク質における特定のアミノ酸残基と反応できる低分子を設計するという方法です。 それに対して、求電子剤優先アプローチでは、薬剤の弾頭部分に注目し、標的タンパク質の求核残基と共有結合を形成できる、反応性の求電子基を同定します。
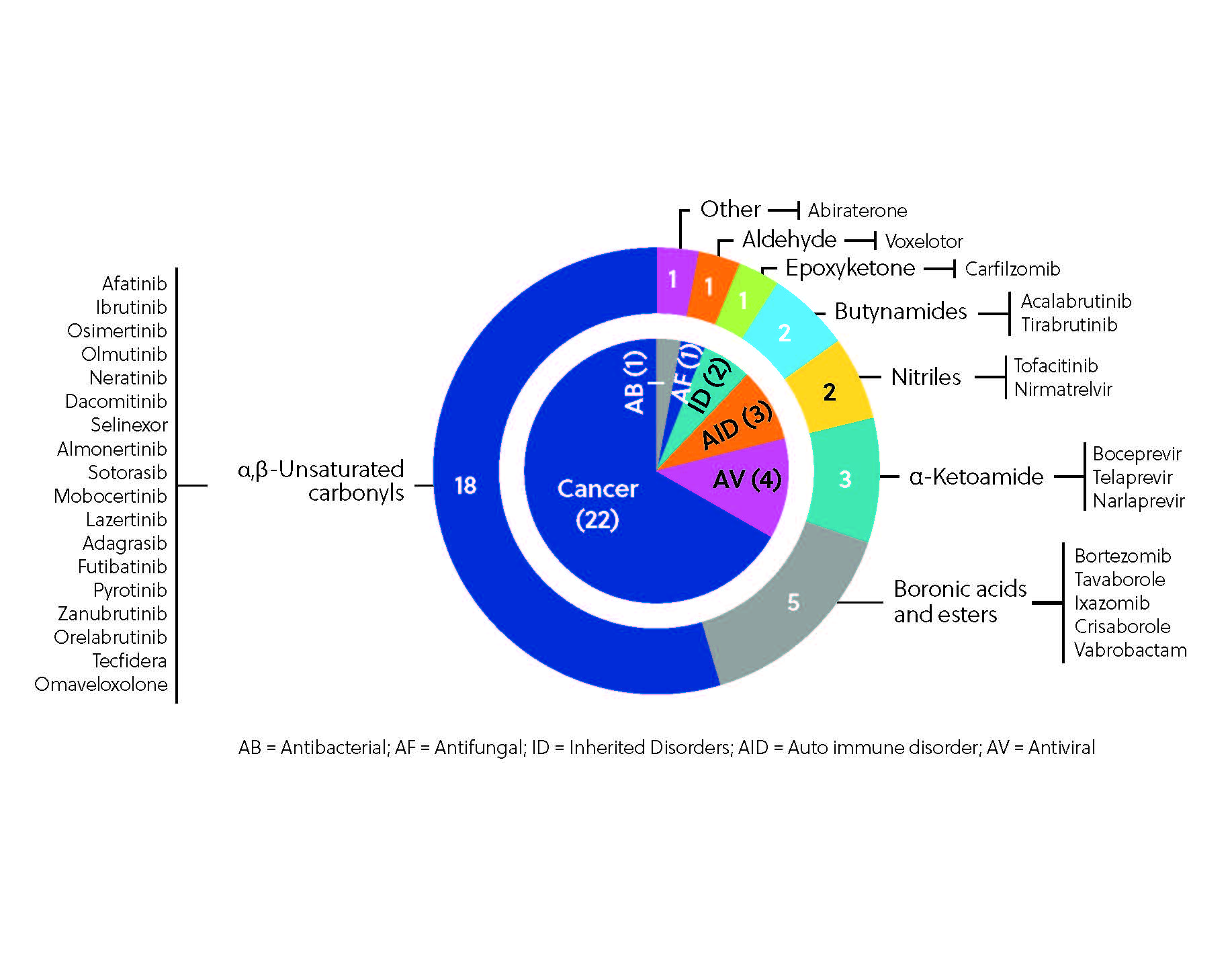
現在までに、世界で30種類以上の共有結合阻害剤が治療薬として承認されています(図3)。特に注目すべきなのは前述のイブルチニブで、2021年には世界の医薬品売上高トップ10に入っています。 イブルチニブは、アファチニブ、ダコミチニブ、ネラチニブとともに、リガンド優先アプローチによって発見された注目すべきキナーゼ阻害剤のひとつです。
共有結合阻害剤のもうひとつの有望な用途は、ウイルスのプロテアーゼを阻害する特性です。 可逆的な共有結合性SARS-CoV-2 MPRO阻害剤であるニルマトルビル(リトナビルと併用)は、COVID-19の治療薬としてFDAから承認され、脆弱な患者(vulnerable patient)にとって待望の経口治療の選択肢となりました。 ニルマトルビルは、それまでに研究されていた共有結合阻害剤の構造誘導による適応を介した求電子剤優先アプローチによって開発されました。
共有結合阻害剤の今後
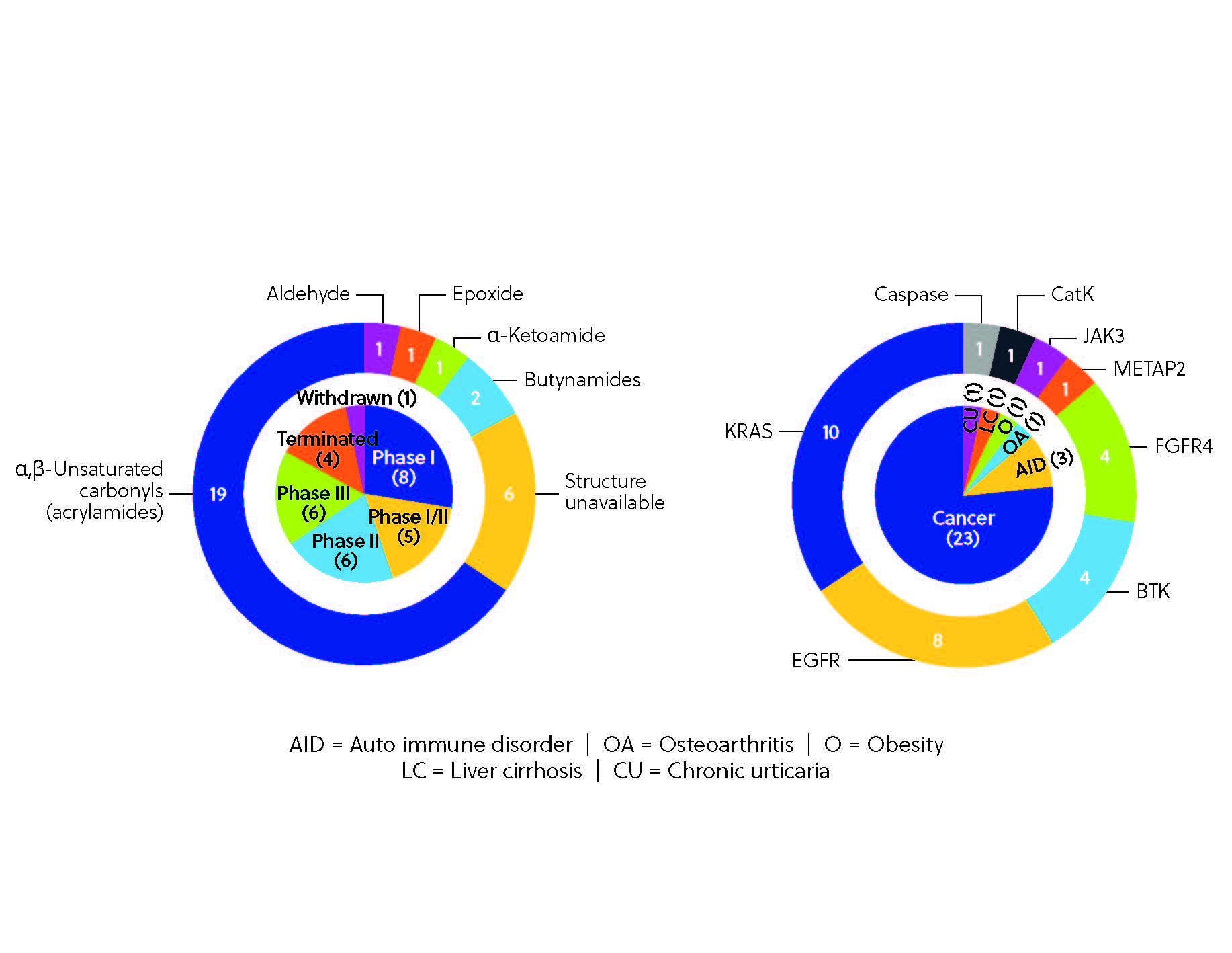
共有結合阻害剤の臨床開発パイプラインは可能性に満ちています。 BTK阻害剤レミブルチニブ、第三世代EGFR-TKIナザルチニブ、選択的FGFR4阻害剤ロブリチニブなど、いくつかの共有結合阻害剤の臨床試験が現在実施されています(図4)。 開発パイプラインは多様性に富んでおり、関節リウマチや円形脱毛症などの自己免疫疾患から、肥満症や変形性関節症などその他の疾患まで、さまざまな治療領域にわたる複数のタンパク質が標的とされています。 この多様性は、先進的なスクリーニングプラットフォームやケモプロテオミクスを駆使した探索など、新たなツールや技術により可能になった共有結合阻害が、いかに可能性を秘めているかの証拠です。 こういった技術により、研究者は膨大な化合物ライブラリをスクリーニングし、プロテオーム内の共有結合相互作用を直接可視化することが可能になります。 これらのイノベーションにより、さらに正確で強力な共有結合阻害剤の登場が予想されます。
共有結合阻害剤の台頭は、医薬品開発の転換点になりました。 標的タンパク質と持続的な結合を形成するその能力は、技術の進歩と相まって、治療薬の新時代への道を切り開きました。 この分野の研究がますます発展していく中、共有結合阻害剤は、さまざまな疾患の治療に革命をもたらし、患者の生活を向上させる大きな可能性を秘めています。 共有結合阻害剤に関するさらなる詳細や、どのトレンドに注目するべきかといった専門家の意見などについては、CASのウェビナーをご覧いただくか、ChemRXiV誌に掲載された最新記事をご覧ください。その他のがん症関連トピックについては、RAS阻害剤に関する詳しい状況分析、または標的タンパク質の分解と分子接着剤についての詳細情報をご覧ください。