L'innovation dans l'industrie biopharmaceutique est un facteur étroitement surveillé des résultats positifs pour la santé publique et sur le plan commercial. Malgré un intérêt prononcé pour le suivi de l'innovation comme mesure du succès, il n'y a guère d'accord sur la manière de le mesurer efficacement. Comme bien d'autres choses dans la vie, l'évaluation de l'innovation dans le secteur pharmaceutique dépend du point de vue dont on se place. Les principales métriques citées pour l'innovation dans les médicaments par les analystes sont le nombre de médicaments nouvellement approuvés ou, parfois, le nombre de candidats médicaments entrant dans les différentes phases du pipeline de développement. Ces mesures basées sur le comptage, associées à d'autres métriques non basées sur le résultat de comptages, comme les titres de premier de sa catégorie et les désignations de traitement innovant, sont informatives et mettent en évidence les progrès importants. Elles présentent également l'avantage d'être assez faciles à suivre et à comparer. Toutefois, elles n'appréhendent pas le caractère innovant inhérent aux nouvelles entités moléculaires (NEM) du point de vue d'un chimiste.
Dans un nouvel article publié récemment dans ACS Medicinal Chemistry Letters, mon collègue Alan Lipkus et moi-même abordons ce sujet du point de vue de la chimie synthétique à un stade précoce. Le résultat est une nouvelle approche pour mesurer et décrire l'innovation médicamenteuse à un stade précoce basée sur une analyse structurelle des NEM. Cette approche, lorsqu'elle est comparée aux mesures existantes basées sur les résultats, contribue à une vue plus complète du paysage de l'innovation pharmaceutique.
Globalement, l'innovation est-elle en hausse ou en baisse dans le secteur pharmaceutique ? Lisez l'article complet en accès ouvert pour en savoir plus au sujet de la méthodologie et voir l'ensemble des résultats de notre analyse au cours des deux dernières décennies.
Définir un cadre structurel de l'innovation dans les médicaments
Notre nouvelle approche de la caractérisation de l'innovation dans les médicaments basée sur la nouveauté structurelle s'appuie sur le concept d'une infrastructure moléculaire. L'infrastructure chimique est définie comme la sous-structure comprenant tous les systèmes annulaires et les fragments de chaîne qui les relient. En utilisant un programme de classification qui prend en compte les informations sur l'infrastructure moléculaire (au niveau de l'échafaudage et de la forme) ainsi que l'année au cours de laquelle un médicament est approuvé, chaque NEM est assignée à l'une des trois catégories suivantes : pionniers, conquérants ou colonisateurs, comme indiqué ci-dessous.
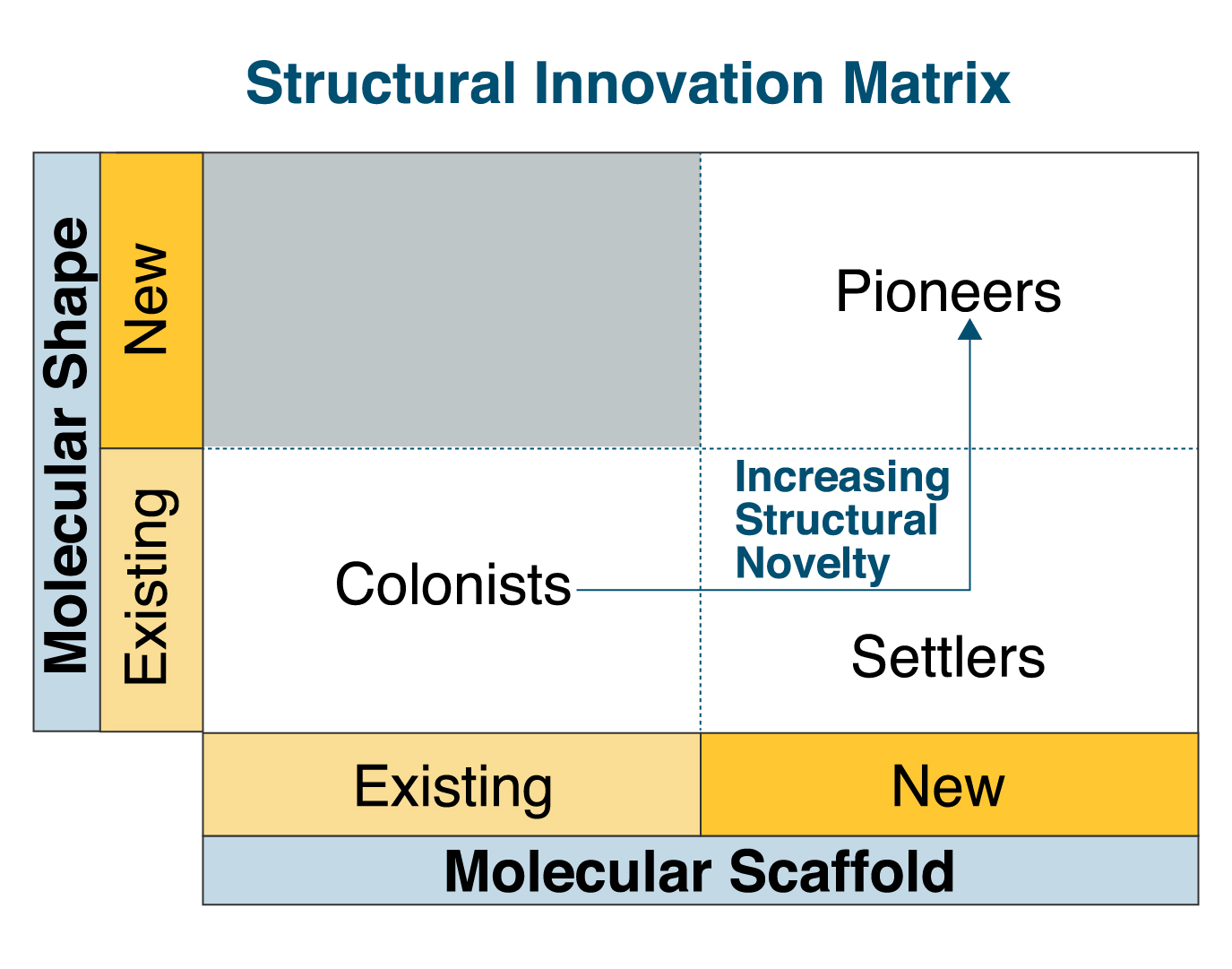
L'approbation d'un nouveau médicament par la FDA, que ce soit par le biais d'un progrès incrémentiel ou d'une toute nouvelle structure, est un accomplissement majeur et la principale mesure du succès de la plupart des équipes de découverte de médicaments. Par conséquent, les trois catégories de cette infrastructure représentent un certain niveau d'innovation. Toutefois, aux fins de comparaison dans cette étude, les pionniers sont considérés comme les plus innovants.
Connecter l'innovation structurelle aux résultats
Même s'il est certainement intéressant de célébrer l'innovation en elle-même, pour être utile d'un point de vue stratégique, toute mesure de l'innovation d'un médicament doit démontrer une certaine corrélation avec des résultats positifs qui s'alignent sur les objectifs de l'entreprise. La mise sur le marché d'un médicament star qui traite un besoin médical important et apporte un retour significatif sur l'investissement dans la recherche est considérée par beaucoup comme le sommet de l'innovation dans le médicament. Selon cette mesure, l'analyse de CAS démontre que près de 65 % des médicaments vedettes actuels contiennent au moins un composant pionnier. Les pionniers se sont également avérés plus de deux fois plus susceptibles que les autres catégories de médicaments d'atteindre le statut de star (plus d'un milliard de dollars de revenus annuels) dans les 5 ans suivant leur lancement. En outre, si on utilise la désignation de traitement innovant de la FDA américaine pour qualifier l'impact potentiel d'un médicament sur la santé publique, notre étude démontre que les pionniers sont nettement plus (plus de 2,5 fois) susceptibles d'être à l'origine de ces nouveaux traitements prometteurs.
Le médicament star Imbruvica (ibrutinib) démontre l'impact puissant de l'innovation structurelle. La tyrosine kinase de Bruton, un inhibiteur classé meilleur produit de sa catégorie, découvert par Celera Genomics et développé conjointement, puis commercialisé par Pharmacyclics et Janssen, a été approuvé par la FDA américaine en 2013. Son potentiel thérapeutique et commercial a été le facteur crucial du rachat de Pharmacyclics par AbbVie pour près de 21 milliards de dollars en 2015. Ce pionnier structurellement nouveau a obtenu à ce jour 11 approbations de la FDA en tout pour différentes indications et est l'un des deux seuls traitements à petites molécules à avoir reçu plus de trois désignations de traitement innovant par la FDA. Imbruvica (ibrutinib) a généré un montant de ventes total de 7,24 milliards de dollars pour toutes les indications en 2019.
Suivre les sources d'innovation structurelle
Compte tenu de ses bienfaits pour la santé et de ses avantages commerciaux, il n'est pas surprenant de constater une augmentation majeure du volume des pionniers et du nombre d'entreprises qui ont découvert des pionniers depuis quelques années. Tous deux ont pratiquement doublé au cours de la dernière décennie : 84 pionniers ont été créés par 61 entreprises entre 2000 et 2009 et 164 pionniers ont été produits par 109 entreprises de 2010 à 2019.
Pour évaluer les principales sources d'innovation pharmaceutique, nous avons divisé les pionniers en deux groupes : ceux qui provenaient d'entreprises que nous définissons comme « Big Pharma » en raison de leur chiffre d'affaires lié aux médicaments, notamment AbbVie, AstraZeneca, Bayer, Bristol-Myers Squibb, Eli Lilly, GlaxoSmithKline, Johnson & Johnson, Merck & Co., Novartis, Pfizer, Roche et Sanofi, et ceux qui étaient issus d'autres organisations (le reste de l'écosystème). Conformément à notre orientation vers l'innovation de la découverte de médicaments à un stade précoce, nous avons crédité l'entreprise de R&D qui a découvert la NEM plutôt que celle qui l'a développée ou qui a obtenu l'approbation pour le médicament.
Cette analyse indique que le nombre agrégé de pionniers provenant des Big Pharma a augmenté de presque 50 % entre la décennie 2000-2009 et la décennie 2010-2019, et qu'une majorité des entreprises relevant des Big Pharma a enregistré une hausse du nombre de pionniers, comme illustré dans le tableau ci-dessous. La plus notable était Bayer, qui n'avait fait approuver aucun pionnier entre 2000 et 2009 et qui a obtenu quatre approbations entre 2010 et 2019. AbbVie et Bristol-Myers Squibb ont également augmenté le nombre de leurs médicaments de quatre unités au cours de cette période.
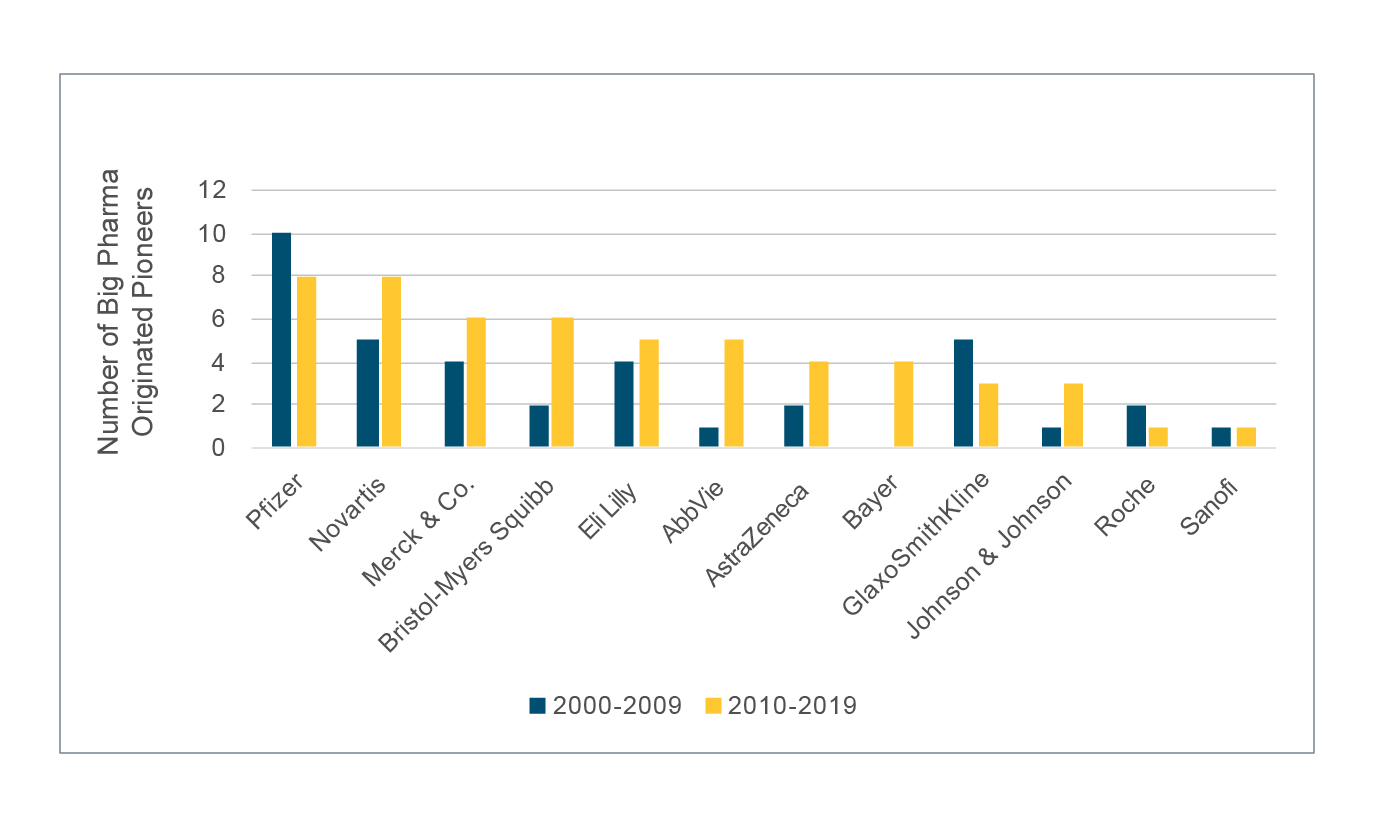
Le nombre de pionniers provenant du reste de l'écosystème a augmenté de plus de 130 % entre la décennie 2000-2009 et la décennie 2010-2019, alors que le nombre d'entreprises du reste de l'écosystème ayant découvert des pionniers a doublé au cours de cette même période. Les entreprises les plus notables étaient Gilead, Eisai, Shionogi et Vertexn qui n'avaient fait approuver aucun pionnier entre 2000 et 2009, mais en a fait approuver quatre ou plus de 2010 à 2019.
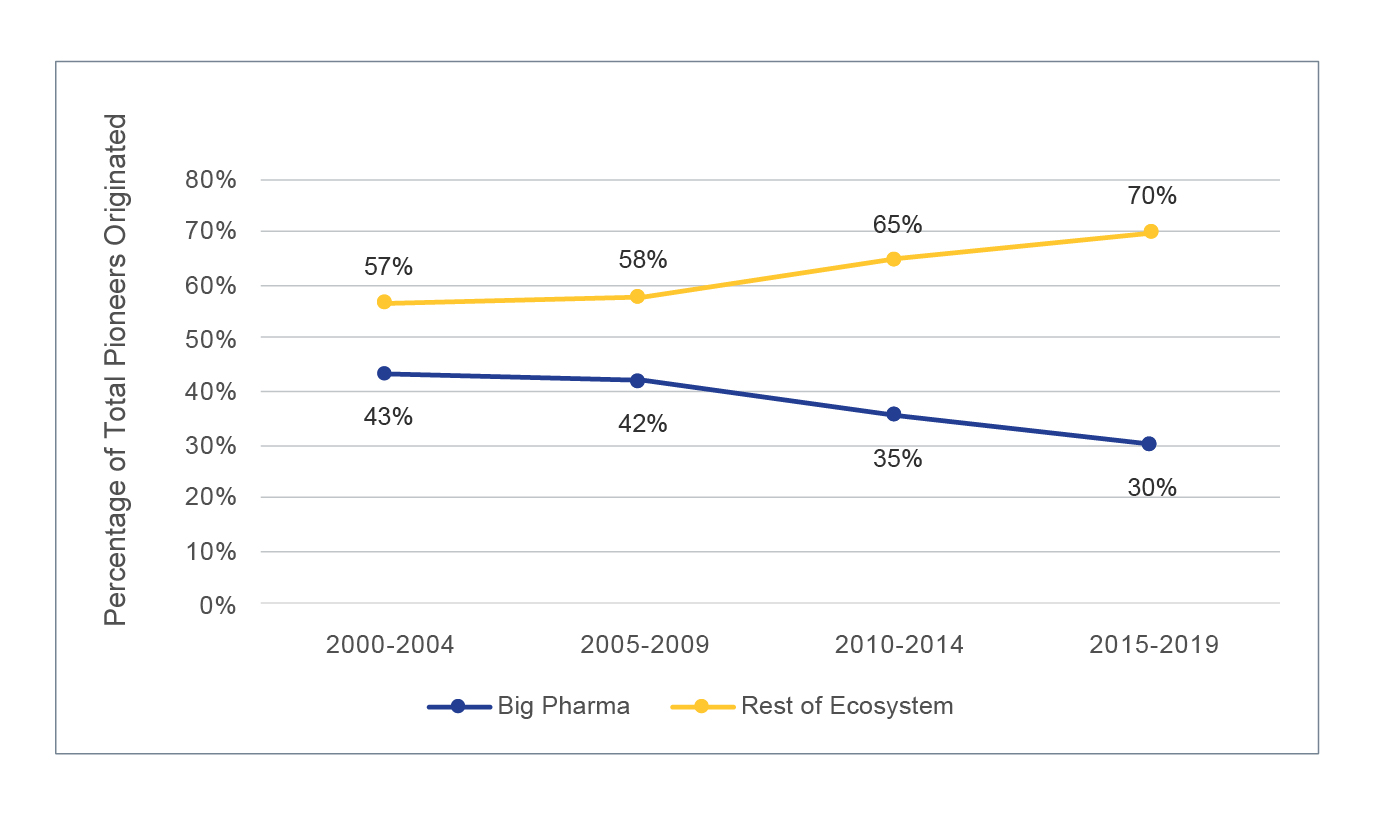
Malgré une augmentation globale du nombre de pionniers créés par les Big Pharma, cette analyse met aussi en évidence un fossé de l'innovation structurelle qui s'élargit entre les Big Pharma et le reste de l'écosystème, comme illustré dans le tableau ci-dessous. Ce changement est probablement déterminé par des facteurs comme l'importance croissante des méthodes in silico dans le processus de découverte de médicaments et la plus large disponibilité de bibliothèques de composés de haute qualité qui ont réduit les barrières à l'entrée.
Adopter de nouvelles approches pour optimiser les opportunités d'innovation
Ces résultats pourraient suggérer qu'en matière d'innovation, l'échelle n'est plus un avantage aussi important qu'autrefois, et je pense que cet avantage se réduira encore à l'avenir. Alors que l'échelle physique de la capacité de R&D d'une entreprise était un agent majeur du volume de l'innovation, tandis que la découverte en force brute cède le pas à des approches augmentées in silico, les capacités et actifs numériques commencent à niveler le terrain de la découverte.
Alors que les informations provenant de jeux de données massifs via l'apprentissage machine et les analyses avancées continuent à accélérer la recherche de médicaments en phase précoce en favorisant la hiérarchisation des candidats médicaments les plus susceptibles de réussir, les entreprises qui exploitent les données le plus efficacement pour amener des médicaments sur le marché en moins de temps gagneront un avantage concurrentiel. Cette hausse d'efficacité présente aussi l'opportunité d'améliorer l'innovation en explorant de façon plus complète de nouveaux domaines de l'espace chimique et en tenant compte d'une plage plus large de candidats potentiels dans la chasse aux traitements efficaces. Même s'il importe peu que le traitement final qui permet de soigner une maladie soit ou non un pionnier, un conquérant ou un colonisateur, la structuration intentionnelle d'un portefeuille de candidats varié est en moyenne susceptible de produire un taux de réussite plus élevé au fil du temps.
Pour bénéficier de cette opportunité, les équipes de recherche peuvent avoir besoin d'aide pour surmonter une tendance enracinée à contourner des formes d'innovation structurelle plus ambitieuses et l'aversion naturelle au risque des humains pour parvenir à un pipeline d'innovation diversifié. Il a été maintes fois prouvé que la réalisation d'une innovation reproductible dans tout domaine passe par une approche structurée. Ce cadre d'innovation structurelle offre aux équipes une opportunité d'évaluer les portefeuilles de médicaments candidats à un niveau macro et micro. Depuis un niveau macro, combien sont recherchés dans chaque catégorie et quel niveau d'investissement est attribué à chaque type d'innovation structurelle ? Du point de vue micro, les bibliothèques de composés et les jeux de données d'entraînement sont-ils suffisamment divers pour produire un large éventail de résultats méritant une enquête plus poussée ? La poursuite d'opportunités identifiées comme résultant de ces interrogations a le potentiel d'utiliser des gains d'efficacité entraînés par les nouvelles technologies et de les traduire non seulement en bénéfices croissants, mais aussi en meilleurs résultats pour les patients.
Votre effort de R&D pourrait-il bénéficier d'une évaluation de vos opportunités d'innovation d'un point de vue structurel et quelles données pourraient vous aider à être plus innovant ? Contactez l'équipe de CAS Services pour discuter des aperçus uniques qu'une analyse personnalisée pourrait vous apporter.

